Tetracloreto de carbono pode ser expresso como CCl4, e é feito de uma molécula de carbono e quatro moléculas de cloreto. O tetracloreto de carbono é não-polar. Porque é que o tetracloreto de carbono é não-polar? É não-polar porque os momentos dipolo da molécula são uniformemente espaçados em torno do átomo central de carbono. Isto significa que os seus efeitos individuais são cancelados, e a molécula é neutra.
Os quatro átomos de cloro são posicionados simetricamente nos quatro cantos de um tetraedro, e uma única ligação une cada um deles ao átomo de carbono no centro da molécula. Como resultado, o CCl4 não tem momento dipolo líquido positivo ou negativo. Se um átomo diferente do cloro tivesse sido posicionado em qualquer outro lugar de uma molécula, a molécula teria um momento dipolo e o CCl4 seria polar como resultado.
“Definimos a química orgânica como a química dos compostos de carbono”. – August Kekule
É a resposta rápida em relação à polaridade do tetracloreto de carbono. Entretanto, seria benéfico falar sobre a polaridade das moléculas em geral e examinar o tetracloreto de carbono e suas propriedades para entender porque ele é não-polar na natureza.
O que significa para um molécula ter polaridade?
Quando você ouve o termo polar, você provavelmente pensa nos pólos norte e sul da terra. Estes pólos norte e sul estão localizados em extremos opostos da terra, semelhante a como uma bateria pode ter um pólo positivo e um pólo negativo. As moléculas e as ligações entre os átomos também podem ter polaridade. Uma molécula é definida como polar quando os átomos que constituem a molécula estão dispostos de forma a dar uma extremidade da molécula uma carga positiva e a outra extremidade da molécula uma carga negativa.
Uma molécula polar é criada quando um átomo que tem um elevado nível de electronegatividade se combina ou liga com um átomo que tem um nível de electronegatividade mais fraco. A molécula resultante tem uma região com alta eletronegatividade e uma região com baixa eletronegatividade ou pólos elétricos. Um dos exemplos mais famosos de uma molécula polar é a água, e é graças à natureza polar da água que ela serve como base para a vida na terra.
Em contraste, as moléculas não polares não têm pólos eléctricos, e os electrões dentro deles são distribuídos de uma forma mais igualitária. As moléculas não-polares carecem de uma carga notável em ambas as extremidades da molécula. A maioria dos hidrocarbonetos líquidos são de natureza não-polar.
Em suma, uma molécula que tem dipolos que não se cancelam é polar, enquanto moléculas não-polares são aquelas em que as cargas de átomos se cancelam umas às outras e não há carga numa extremidade da molécula ou na outra.
Exemplos de Moléculas Polares
Como mencionado anteriormente, a água é uma molécula polar. As ligações que existem entre os átomos de oxigénio e os átomos de hidrogénio estão distribuídas de tal forma que ambos os lados do átomo, tanto do oxigénio-hidrogénio como das ligações, estão uniformemente espaçados. O resultado é que o lado do oxigénio, ou topo da molécula, tem uma carga ligeiramente negativa enquanto que os átomos de hidrogénio, ou a parte inferior da molécula, tem uma carga ligeiramente positiva.
Etanol é uma molécula polar porque os átomos de oxigénio que estão dentro da molécula têm mais electronegatividade do que os outros átomos. Os átomos de oxigénio atraem mais electrões devido ao seu maior potencial de electronegatividade, e os grupos de ligação -OH na molécula têm cargas negativas em geral, mesmo que a carga negativa seja muito ligeira.
“A vida só existe no universo porque o átomo de carbono possui certas propriedades excepcionais”. – James Jeans
ADVERTISEMENT
Outros exemplos de moléculas polares incluem dióxido de enxofre (SO2), sulfureto de hidrogénio (H2S) e amoníaco (NH3).
Esteja avisado que uma molécula pode ser composta de ligações polares e ainda assim ser não polar. Um exemplo é o dióxido de carbono, que tem quatro ligações, mas os momentos dipolares da molécula acabam por neutralizar-se mutuamente, pelo que a molécula é não-polar.
Exemplos de moléculas não-polares

Exemplos de moléculas não-polares incluem nitrogênio, metano, ozônio e oxigênio. Estas são moléculas homonucleares ou moléculas compostas de átomos de apenas um elemento. Moléculas não-polares que não são homonucleares incluem dióxido de carbono, mencionado acima, e metano. Tolueno e gasolina são também exemplos de substâncias não-polares. Como regra geral, os compostos de carbono são não-polares, embora haja algumas exceções, como o monóxido de carbono. O monóxido de carbono é linear por natureza, o que normalmente tornaria uma molécula não-polar, mas a diferença de eletronegatividade entre a molécula de oxigênio e a molécula de carbono é substancial o suficiente para que a molécula seja polar. Os alcinos não se dissolvem na água, e são considerados moléculas não-polares. Os gases inertes ou nobres também são classificados como moléculas não polares porque os gases são apenas átomos únicos dos seus respectivos elementos, tais como néon, hélio, argônio e crípton.
Prever a polaridade de uma molécula
Examinar os valores de eletronegatividade dos átomos de uma molécula irá ajudá-lo a determinar se a molécula é ou não polar ou não polar. Diferenças significativas entre os valores de eletronegatividade implicam que os elétrons são igualmente compartilhados entre os átomos da molécula. Como os electrões estarão mais próximos de um átomo do que de outro, essa região da molécula será polar, embora para determinar a polaridade de toda a molécula todas as ligações devem ser tidas em conta.
O factor decisivo na polaridade ou não polaridade de uma molécula é a sua geometria. Se uma extremidade da molécula tem uma carga negativa enquanto a outra extremidade da molécula tem uma carga positiva, a molécula será polar. No entanto, se as cargas são distribuídas uniformemente e orbitam um átomo central, a molécula é provavelmente não-polar. Você pode usar isto para prever se uma molécula será polar ou não-polar. Nem todas as moléculas têm um momento dipolo, e isto pode tornar a previsão da polaridade de uma molécula um pouco mais difícil. Como exemplo, moléculas que podem ser viradas e espelhadas através de um plano geométrico, não têm momentos dipolo porque os momentos dipolo não podem compreender mais do que um único ponto.
Fatos Sobre o Tetracloreto de Carbono
Tetracloreto de Carbono foi descoberto pela primeira vez pelo químico francês Henri Victor Regnault em meados do século XIX. O químico foi descoberto através de uma combinação de cloro e clorofórmio. Apesar disso, o tetracloreto de carbono é derivado principalmente do metano hoje em dia. A produção de tetracloreto de carbono opera frequentemente usando os subprodutos das reacções de cloração para derivar o composto. Isto inclui os subprodutos da criação do clorofórmio e do diclorometano. O tetracloreto de carbono é bastante volátil na natureza, libertando um cheiro semelhante ao dos produtos químicos de limpeza a seco. O tetracloreto de carbono também é solvente e por isso é útil na dissolução de substâncias não polares como óleos e gorduras.
Tetracloreto de carbono tem muitas aplicações diferentes e tem sido utilizado como agente de limpeza, como refrigerante e em extintores de incêndio. O tetracloreto de carbono é frequentemente utilizado na criação de lâmpadas de lava, tornando a cera mais pesada.
“… A molécula de carbono é revestida com pensamento?”. – Saul Bellow
Por causa do impacto ambiental do tetracloreto de carbono, a sua produção tem diminuído acentuadamente desde os anos 80. O protocolo de Montreal limitou a produção de clorofluorocarbonos, e como o tetracloreto de carbono é um ingrediente chave na criação de CFC, o tetracloreto de carbono tem tido como resultado uma forte diminuição da produção. Os efeitos adversos à saúde do tetracloreto de carbono também causaram uma diminuição em sua produção e, embora já tenha sido amplamente utilizado como solvente, hoje em dia é raramente utilizado para tais fins.
Tetracloreto de carbono é extremamente tóxico para o fígado, e outras substâncias prejudiciais ao fígado são frequentemente comparadas contra a toxicidade do tetracloreto de carbono. Altas concentrações de tetracloreto de carbono podem não só danificar o fígado, mas também os rins. A exposição prolongada ao tetracloreto de carbono pode causar um coma ou morte. A exposição ao químico também pode aumentar a chance de desenvolver câncer.
Por que o tetracloreto de carbono é polar?
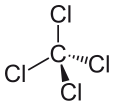
Depois de vermos o que faz uma molécula polar, e olhando para alguns exemplos de moléculas polares, podemos agora compreender melhor porque é que o tetracloreto de carbono é uma molécula não polar. A primeira coisa que deve ser feita ao tentar determinar se uma molécula é polar e não-polar é calcular os valores de eletronegatividade dos átomos dentro da molécula. A polaridade da ligação entre dois átomos deve ser determinada e todas as ligações devem ser consideradas quando se tenta determinar a polaridade da molécula. No entanto a diferença de valores de eletronegatividade entre cloreto e carbono, no caso do tetracloreto de carbono, não é o único fator que deve ser considerado. A forma da molécula também deve ser considerada. Enquanto existem dipolos presentes dentro da molécula, a forma linear do tetracloreto de carbono significa que os efeitos dos diferentes momentos dipolares na molécula se anulam mutuamente, e a molécula é neutra ou não-polar como resultado.