Dada a abundância de funções que um biorreator deve desempenhar, você pode estar se perguntando como ele pode fazer tudo isso. De que componentes é que ele precisa? Como você sabe quais são as condições do biorreator atualmente e como você pode corrigi-las? E finalmente, só por perspectiva: como você pega os dados capturados durante um bioprocesso em lote, exibe-os de forma significativa e depois os salva e avalia enquanto os mantém organizados?
Os parâmetros mais importantes do processo e os mecanismos para regulá-los são abordados abaixo:
- Mistura de culturas
- Controle de temperatura
- Controle de pH
- Alimentação de nutrientes
- Gaseificação
- Pressão controle
- Prevenir a formação de espuma
Mistura de cultura
A cultura num biorreator precisa de ser sempre bem misturada. Se os nutrientes no biorreator não estiverem suficientemente dispersos, as condições em certas partes do biorreator irão desviar-se significativamente do ideal. O pH pode ser demasiado ácido, por exemplo, ou o fornecimento de nutrientes pode ser insuficiente. Desvios como estes não só reduzem a eficiência do bioprocesso planejado, mas também podem promover modificações genéticas. A distribuição da temperatura é uma preocupação adicional. Sem agitação uniforme, os microorganismos ou culturas celulares ao longo da borda do vaso serão literalmente fervidos, enquanto aqueles no meio ficam com os pés frios. Se você já aqueceu a sopa no microondas e depois a comeu com grande antecipação sem mexê-la, você saberá o que queremos dizer.
A velocidade de agitação típica varia entre outras coisas, dependendo do organismo cultivado:
| Organismo | Ritmo de mistura | ||||
| Bactérias, Levedura, Fungos | 500 – 1500 min-1 | ||||
| Mamífero, Células de Insectos ou Plantas | 30 – 300 min-1 | ||||
Ajustar velocidades de agitação para o cultivo de microrganismos, células vegetais, células animais ou células de insectos é muito importante, uma vez que estas reagem de forma diferente ao stress de cisalhamento, i.e., a tensão mecânica causada pela agitação. Dependendo da linha celular, as culturas celulares podem ter uma resposta muito mais intensa à agitação demasiado vigorosa, ou seja, simplesmente morrem, uma tendência que os cientistas descrevem com mais precisão (e diplomaticamente) como sendo “sensíveis ao stress de cisalhamento”. A disponibilidade de oxigênio pode ser variada durante o bioprocesso alterando a velocidade de agitação, garantindo assim um crescimento celular ideal.
Medir e controlar a temperatura
Microorganismos e culturas celulares possuem enzimas que funcionam melhor dentro de certas faixas de temperatura e pH. Se as condições caírem fora destas faixas, o bioprocesso desejado irá proceder muito mais lentamente, porque o crescimento e o desempenho metabólico são altamente dependentes destas enzimas, ou seja, proteínas catalíticamente ativas. No pior dos casos, condições ambientais desfavoráveis podem até mesmo destruí-las. As culturas de células de mamíferos são mais confortáveis dentro de uma faixa muito estreita de temperaturas – uma que só está presente da sua perspectiva quando a temperatura dentro do vaso de cultura é de 37 °C.
Por isso, um sensor de resistência de platina conhecido como sensor Pt100 é usado no biorreator para determinar a temperatura. Ele tem uma resistência de 100 Ω a 0 °C, e cobre muito bem a faixa de medição biologicamente relevante esperada quando calibrado adequadamente.
A faixa típica de temperatura varia entre outras coisas, dependendo do organismo cultivado:
| Organismo | Gama de temperatura | ||||
| Bactérias, Levedura, Fungos | +20 °C a +60 °C | ||||
| Mamífero, Células de insectos ou plantas | +25 °C a +37 °C | ||||
Se trabalhar a temperaturas próximas ou abaixo da temperatura ambiente, necessitará de um sistema de refrigeração activo, tal como um refrigerador recirculante. Para a maioria dos bioprocessos, a temperatura deve permanecer constante durante todo o cultivo. Para alguns produtos, porém, como a penicilina ou proteínas recombinantes (ou seja, proteínas bioengenharia usando organismos geneticamente modificados), mudar a temperatura no final da fase de crescimento ativa genes importantes para a formação do produto e é, portanto, benéfico. Para os métodos de produção que envolvem culturas celulares, a temperatura é por vezes também reduzida no final do bioprocesso (uma técnica conhecida como “mudança de temperatura” em biotecnologia) para que o produto final permaneça estável para uso posterior.
Existem várias formas de utilizar um circuito de aquecimento e/ou arrefecimento para regular a temperatura:
- >
- >
-
- Um bloco de aquecimento eléctrico com espiral de arrefecimento incorporado
- Uma almofada de aquecimento de silicone enrolada à volta do vaso de cultivo após a esterilização
- Uma camisa dupla na qual circula água. A temperatura é ajustada através de um aquecedor elétrico ou vapor e uma válvula solenóide para a entrada de água de resfriamento
-
Medir e controlar o pH
Medir e controlar o pH é um aspecto muito importante dos bioprocessos, já que mudanças no pH podem alterar significativamente as condições de crescimento – geralmente com grandes conseqüências. Os meios de cultura normalmente incluem tampões, ou seja, substâncias que mitigam alterações demasiado bruscas no pH causadas pela adição de um ácido ou de uma base. Como um ácido pingando no meio de cultura pode danificar muitas linhas celulares, os cientistas muitas vezes enriquecem cuidadosamente a mistura gasosa usada na cultura celular com CO2 ao invés de adicionar um ácido líquido. O gás dissolve-se então no meio de cultura, permitindo que o dióxido de carbono influencie o pH em combinação com um tampão.
Gamas típicas de pH dependendo do organismo cultivado:
| Organismo | pH | ||||
| Bactérias, Leveduras, Fungos | 4.5 – 7.0 | ||||
| Células de mamíferos | 6.7 – 7.4 | ||||
| Insectar células | 6.2 – 6.9 | ||||
| Células da planta | 5.5 | ||||
Para medir o pH durante o bioprocesso, cada biorreator é equipado com um sensor de pH conhecido como um eletrodo combinado para o pH. O biorreator pode corrigir quaisquer desvios no pH; para este fim, um ácido e/ou uma solução alcalina é disponibilizada e conectada ao vaso de cultura através de tubos e bombas. A concentração do ácido e da base deve ser habilmente selecionada para que isto funcione – se for muito alta, as gotas de ácido concentrado ou de base podem danificar os microorganismos e as culturas celulares antes de serem distribuídas no biorreator. Se, por outro lado, a concentração for muito baixa, os operadores terão que adicionar mais ácido ou base, diluindo desnecessariamente o meio de cultura.
Adicionando nutrientes
Durante um bioprocesso, os microrganismos geralmente consomem uma grande variedade de nutrientes. A composição básica de um meio nutriente geralmente consiste em água, uma fonte de energia utilizável pelo organismo (por exemplo, glicose), assim como os nutrientes que ele necessita (carbono, nitrogênio e fósforo), sais e oligoelementos. Dependendo do organismo, outros compostos são necessários que não podem ser sintetizados por si (vitaminas, aminoácidos essenciais, etc.).
Dependente da estratégia do bioprocesso, estes nutrientes são todos disponibilizados no início de um bioprocesso (bioprocesso batch) ou adicionados ao longo do tempo, como em um lote alimentado ou em um processo contínuo.
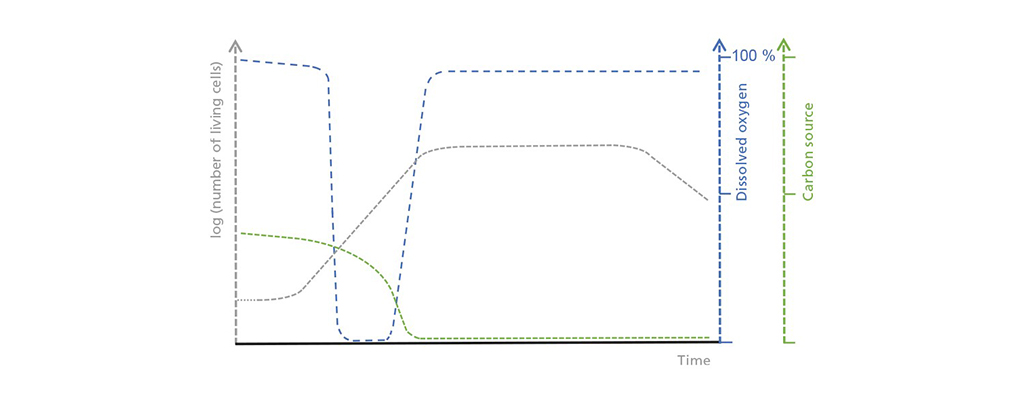
Indicação esquemática das correlações entre a concentração de células vivas, oxigênio dissolvido e a fonte limitadora de carbono na operação em lote. Na fase inicial de atraso, a contagem de células vivas apenas aumenta lentamente, o que leva a uma absorção moderada mas constante da fonte de carbono. O consumo de oxigénio aumenta durante a fase de crescimento exponencial até exceder a entrada possível de oxigénio. Uma vez esgotada a fonte de carbono, a fase estacionária começa e é seguida por uma fase morta, durante a qual a contagem de células vivas diminui drasticamente.
Se você quiser saber mais sobre as diferentes estratégias de alimentação, dê uma olhada no nosso blog-post: The Difference Between Batch, Fed-batch and Continuous Processes.
Gassing
Durante o bioprocesso, o biorreator alimenta uma mistura de gás estéril, como o ar, no meio de cultura. A agitação constante não só distribui os nutrientes – também reduz o tamanho das bolhas de gás que surgem no recipiente de cultura, libertando assim eficientemente oxigénio para a solução nutritiva. Isto é importante, porque microorganismos e culturas celulares só podem absorver o oxigênio que foi dissolvido na solução nutritiva.
As demandas de oxigênio variam: bactérias aeróbicas precisam de oxigênio, enquanto outras preferem misturas gasosas como o gás de síntese (“syngas”). Os organismos anaeróbicos, no entanto, podem prescindir totalmente da gaseificação, alimentando-se apenas de substâncias inorgânicas e orgânicas do meio de cultura, como nitrato ou fumarato.
Microorganismos não semelhantes, as culturas celulares são gaseadas com mais do que apenas ar – o conteúdo de oxigénio da mistura gasosa também pode ser influenciado usando nitrogénio puro e oxigénio puro. A composição exacta depende da aplicação da cultura de células. Para manter a atmosfera gasosa constante, o biorreator precisa de sistemas de controle precisos.
No início do bioprocesso, por exemplo, uma cultura muitas vezes precisa de menos oxigênio – e, portanto, de uma alimentação de gás menor – uma vez que o crescimento ainda está progredindo lentamente. Mais tarde, porém, o crescimento mais rápido requer muito mais oxigênio. Além de garantir um fornecimento constante do gás ou mistura de gás desejado, o biorreator também fornece a quantidade certa de gás no momento certo. Para isso, o biorreator tem portas de gás conectadas ao ar pressurizado do edifício, um compressor ou um cilindro de gás.
A taxa de gaseificação é normalmente medida em litros por minuto. Para ter um parâmetro genérico aplicável a vários biorreatores, a taxa também é freqüentemente indicada como a taxa de gaseificação específica, que se refere a múltiplos do volume de trabalho (volumes por minuto, vvm) e é expressa como min-1. Um valor típico para bioprocessos microbianos é de 1 a 1,5 vezes o volume de trabalho por minuto. Para um biorreator com 4 L de volume de trabalho, a taxa máxima de gaseificação seria, portanto, 4 L * 2 L L-1 min-1 = 8 L min-1. Em culturas celulares, pelo contrário, a taxa máxima é frequentemente de 10% a 15% do volume de trabalho por minuto como forma de manter pequenas bolhas de gás e, assim, evitar a formação de espuma e danos às células por rebentamento de bolhas.
Mudar a taxa de gás, no entanto, não é a única forma de controlar a eficiência com que o biorreator fornece oxigénio e outros gases ao meio de cultura. Quanto maior for a superfície do número total de bolhas de gás no biorreator – ou seja, quanto mais finamente distribuídas as próprias bolhas de gás – mais eficientemente o oxigênio será transferido do gás para a fase líquida. Isto significa, por exemplo, que o aumento da velocidade de agitação pode melhorar a oxigenação dos microorganismos, uma vez que o agitador torna as bolhas de gás ainda menores e assim aumenta a área total da superfície de todas as bolhas de gás no biorreator.
Regulação precisa do pO2 – e assim o controle preciso da taxa de gaseificação e da composição do gás – é muito importante uma vez que, normalmente, o pO2 não deve ser o fator inibidor de crescimento para a cultura. Se não for suficientemente controlado, porém, o pO2 torna-se o fator limitante.
Desde que a alimentação de gás para o biorreator é geralmente seca, a umidade do biorreator pode ser coletada no fluxo de saída durante a gaseificação. Com uma alta taxa de gaseificação, não só o nível de enchimento cairia, mas a umidade também bloquearia o filtro de exaustão, impedindo a ventilação adequada e permitindo que a pressão se acumule. Para evitar este efeito, os biorreatores são equipados com um eficiente resfriador de escape onde a umidade no escape condensa e pode pingar de volta para o biorreator antes que ele chegue ao filtro de escape.
Medir e controlar a pressão
Quanto maior a pressão no vaso, mais oxigênio é dissolvido. Recipientes de cultura feitos de vidro são frequentemente aprovados apenas para uma pressão de até 0,5 bar, que não é nem metade da pressão de um pneu de bicicleta com enchimento moderado. A uma pressão de funcionamento mais elevada, os vasos de cultura de vidro ligeiramente danificados podem rebentar, o que constitui um risco de segurança. É por isso que você deve sempre assegurar uma linha de escape livre e não pressurizada do biorreator, mantendo o filtro de escape seco e substituindo-o regularmente – no processo, você também estará assegurando a integridade do vaso de cultura, é claro. Ao contrário dos vasos de cultura de vidro, os biorreatores de aço inoxidável são projetados para pressões mais elevadas e, mesmo em sua configuração padrão, são adequados para pressões de até 2 bar (um pneu de bicicleta bem cheio). Além disso, sistemas como esses são frequentemente equipados com um mecanismo de controle de pressão baseado em um sensor de pressão no biorreator e uma válvula proporcional na linha de escape. Estes não só podem medir a pressão no biorreator – como também podem controlá-la ativamente.
>
> >
>
>
Prevenir a formação de espuma
>
Fora das banheiras e copos de cerveja, a espuma é um efeito colateral bastante impopular, especialmente nos biorreatores. A espuma forma-se na interface entre a fase líquida e gasosa no recipiente de cultura e pode rapidamente encontrar o seu caminho para cima sob a placa superior. No pior dos casos, ela então bloqueia o filtro de exaustão que, por sua vez, bloqueia o fluxo de gás. A maioria dos biorreactores está, portanto, equipada com um sistema para combater a formação de espuma. Disjuntores mecânicos de espuma no headspace são reservados para bioreatores de aço inoxidável bastante grandes, enquanto sistemas de controle antiespuma baseados em agentes químicos (como PPG, Struktol ou antiespumantes à base de silicone) podem ser encontrados em bioreatores menores.
Um sistema de controle antiespuma típico consiste de um sensor instalado a uma altura específica no vaso de cultura. Se a altura da espuma atingir o sensor, um agente antiespuma é bombeado de um reservatório para o vaso de cultura. Esses antiespumantes são ativos na interface líquido-gás e aumentam a tendência de colapso das bolhas de espuma. Em casos particularmente teimosos onde a espuma não se dissolve imediatamente, repetir o procedimento após um tempo predefinido (uma estratégia “shot & delay”). É aconselhável ter cuidado ao utilizar um agente antiespuma – se dispensar um pouco mais do que o necessário, este pode ficar como uma segunda pele na superfície do líquido, o que dificulta a troca de gás. Os antiespumantes também contrariam a transferência eficiente de oxigênio, pois a mudança na tensão superficial promove o colapso das bolhas de gás no biorreator, reduzindo assim a área de superfície disponível para a troca de gás. A seleção do agente apropriado também depende do bioprocesso em questão, pois bactérias e células reagem de forma diferente a certos produtos químicos.
Bonus: Os benefícios da utilização de um software SCADA
Agora, os resultados gerados em um biorreator devem ser coletados e avaliados da forma mais central possível, pois esta é a única forma de implementar efetivamente algoritmos de dados grandes e modernos para gerar mais informações e entender melhor como um processo funciona. Esse é o trabalho do software SCADA. No primeiro passo, todos os dados do biorreator podem ser lidos – sem grandes entradas por parte do usuário – e armazenados de forma centralizada, a fim de avaliá-lo por si só ou compará-lo com outros dados de lote. Isto rapidamente aciona idéias para novos experimentos e possivelmente até mesmo estratégias de lotes complexos. Um software SCADA profissional permite que você os planeje facilmente e depois controle o biorreator, que idealmente será um processo totalmente automatizado. Além disso, o software SCADA também integra vários componentes no ambiente do biorreator. Estes incluem ferramentas para otimização de processos usando a técnica de projeto de experimentação (DoE) ou poderosos sensores de software, que podem ser usados simultaneamente para computar informações adicionais diretamente dos parâmetros do processo batch e até mesmo para regular esses parâmetros. Por exemplo, o quociente respiratório (RQ) pode ser usado para obter uma estimativa da atividade metabólica por meio da razão entre o dióxido de carbono excretado e o oxigênio absorvido.
Existem tantas possibilidades – especialmente quando o biorreator e o software SCADA são perfeitamente compatíveis – que não poderíamos descrever todas elas. Se você está interessado em saber mais sobre todos os softwares modernos SCADA que temos para oferecer, veja o software da plataforma de bioprocessos eve®
