08 Ago 2019
Menção ApoE e Alzheimer, e a conversa se volta para o alelo E4, o gene de mais forte suscetibilidade à doença. Mas o ApoE tem outro lado, no ApoE2. Embora esta isoforma proteja contra a doença de Alzheimer, os cientistas mal a estudaram. Agora o ApoE2 está atraindo o escrutínio, pois os cientistas estão perguntando exatamente como algumas pessoas mantêm sua acuidade mental até a velhice. Na Conferência Internacional da Associação Alzheimer, realizada de 14 a 18 de julho em Los Angeles, um estudo dos genótipos ApoE em 5.000 casos de AD confirmados por autópsia revelou que as pessoas com duas cópias do E2 vêem o risco de demência despencar por uma impressionante queda de 90% em comparação com aquelas com o genótipo comum E3/E3. Outros trabalhos sugeriram que isso poderia ser porque o ApoE2 reduz a patologia amilóide e tau, e aumenta o volume de matéria cinzenta em regiões críticas do cérebro. Os benefícios do E2 parecem específicos ao Alzheimer, não genéricos à neurodegeneração.
ApoE é a principal proteína que transporta o colesterol no cérebro. Tem sido estudada desde sua descoberta como um gene de risco AD no início dos anos 90, mas está emergindo recentemente como um centro de respostas glial para a deposição de amilóide e tau agregado (noticiário de Ago 2018; noticiário de Set 2017). O gene existe como três alelos polimórficos – E2, E3 e E4 – com uma frequência mundial de 8%, 78% e 14%, respectivamente. Várias formas mutantes também são conhecidas, por exemplo, as chamadas mutações de Heidelberg, Pittsburgh e Christchurch (Feussner et al., 1992; Kamboh et al., 1999; Wardell et al., 1987).
ApoE4 recebe de longe a maior atenção dos investigadores de AD, porque aumenta o risco de AD até 15 vezes, dependendo da população estudada, e ocorre em 40 por cento das pessoas com AD. O E2, o alelo protetor, tem recebido pouca atenção, porque é o menos comum dos três e está largamente ausente das amostras de AD. Pessoas com uma cópia do E2 têm metade da chance de desenvolver DA em comparação com aquelas com o genótipo mais comum do E3/E3. Mas será que o E2 adicional tem um efeito além disso? “Não sabemos se a dose de E2 tem um risco diferencial, ou seja, se o risco de E2/2 é significativamente menor que E2/3”, disse Eric Reiman ao apresentar o estudo.
Para descobrir, Reiman e colegas do Banner Alzheimer’s Institute, Phoenix, Gyungah Jun da Universidade de Boston, Joseph Arboleda do Massachusetts Eye and Ear, Yakeel Quiroz do Massachusetts General Hospital, e colegas do AD Genetics Consortium decidiram olhar para os dados de muitos cérebros. Eles analisaram a contribuição dos três alelos ApoE para o risco de demência e patologia em 5.007 cérebros do ADGC. Esta amostra incluiu 4.018 casos de demência por Alzheimer confirmados por autópsia, mais 989 doadores patológicos e cognitivamente não afetados. Além de fornecer números suficientes para estudar os homozigotos E2/E2, esta coorte evita a questão confusa do diagnóstico errado, eliminando demências não devidas à DC, bem como pessoas que tinham patologia de DC no momento da morte, mas sem demência.
Como esperado, os homozigotos ApoE2 eram raros – apenas 24 em mais de 5.000 pessoas, ou 0,5 por cento. Em comparação com outros genótipos, era muito menos provável que eles tivessem AD. Os homozigotos E2 constituíam 0,1% dos casos, mas 1,9% dos controles saudáveis. Em contraste, os homozigotos ApoE4/4 representaram 15,6% dos casos e apenas 1% dos controles. Em outras palavras, 19 dos 24 homozigotos ApoE2/2 eram cognitivamente saudáveis, mas apenas 10 dos 633 homozigotos ApoE4/4 eram.
E2 tinham uma redução de risco de 66% em comparação mesmo com portadores de E2/3, uma redução de risco de 87% em comparação com o genótipo mais comum, E3/3, e uma redução de risco de 99,6% em comparação com pessoas que eram E4/4. Basicamente, a maioria das pessoas com E4/4 tem demência Alzheimer, enquanto poucas com ApoE 2/2 do.
Having dois alelos E2 correlacionados com menos placa amilóide e tau neurofibrilares emaranhado patológico. O efeito protetor do ApoE2 na patologia tau ainda era aparente mesmo quando ajustado para a carga da placa amilóide. Isso reflete dados recentes de animais sugerindo que o ApoE4 atua para piorar a patologia tau independente da amilóide (Shi et al., 2017).
A principal descoberta do novo estudo ecoa a de um estudo anterior de Pieter-Jelle Visser, Universidade de Maastricht, Holanda, e colegas. Eles tinham encontrado 16 portadores do ApoE2/2 numa amostra de 7.583 pessoas, das quais 10 eram cognitivamente normais e amilóides-negativos, enquanto 301 dos 386 portadores do ApoE4/4 na amostra tinham demência de Alzheimer. Esta amostra, no entanto, não foi confirmada por patologia (Jansen et al., 2015).
Quão importante é a confirmação neuropatológica? Reiman et al. compararam as estimativas de risco derivadas da coorte autopsia-verificada com aquelas calculadas a partir de uma coorte de 23.857 pessoas vivas que foram clinicamente diagnosticadas como tendo provável demência por AD ou sendo cognitivamente normais, e que eram de estado amilóide desconhecido. Nessa análise, o efeito protetor de 2/2, e o aumento do risco devido a 4/4, ambos foram subestimados. Por exemplo, os cientistas constataram que a odds ratio associada ao E4/E4 sobre E3/E3 na amostra clínica foi de 10,7, contra 31,22 nos casos patologicamente confirmados. Os efeitos das doses de E2 e E4 também foram subestimados na amostra viva. Assim, a análise de autópsia fornece estimativas de risco atualizadas, e provavelmente mais precisas, para todos os genótipos ApoE, acreditam Reiman e colegas, pelo menos para esses participantes de pesquisa não-hispânicos brancos.
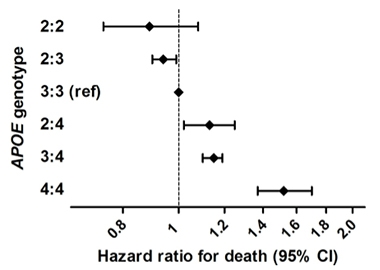
Life Extending. Em um grande estudo epidemiológico combinando seis coortes de base populacional de pessoas com ascendência européia, os homozigotos ApoE2 apresentavam menor risco de morrer do que outros genótipos. Os homozigotos ApoE4 estavam em maior risco.
O impacto do ApoE no Alzheimer é conhecido por ser diferente entre os grupos étnicos. Este tipo de estudo é necessário com sujeitos mais diversos, mais homozigotos E2/2 e levando em conta possíveis efeitos dos alelos ApoE sobre a sobrevivência, o que poderia distorcer os resultados. No entanto, Reiman disse: “Nossos resultados sugerem que a homozigocidade ApoE2 está associada a um risco excepcionalmente baixo de AD, que o impacto do APOE e suas variantes sobre o risco de AD é significativamente maior do que anteriormente apreciado, e que há uma razão imperiosa para descobrir tratamentos que promovam esse efeito protetor”
que se justapõem aos resultados recentes de Sudha Seshadri, University of Texas Health, San Antonio, Frank Wolters, Erasmus Medical Center, Rotterdam, Holanda, e colegas. Eles encontraram uma vantagem de sobrevivência para portadores do ApoE2 em um estudo com 38.537 pessoas de seis coortes de base populacional (Wolters et al., 2019). Eles identificaram 239 homozigotos do E2, que tiveram as vidas mais longas. O efeito do E2 foi apenas parcialmente explicado pelos seus efeitos sobre os lipídios no sangue ou doença vascular. O E4 homozigotos tinha o maior risco de morte, e isto foi em grande parte explicado pela sua associação com demência. Seshadri disse a Alzforum que os investigadores irão analisar a AD e a mudança cognitiva, e também as medidas de amilóide e tau PET nesta amostra.
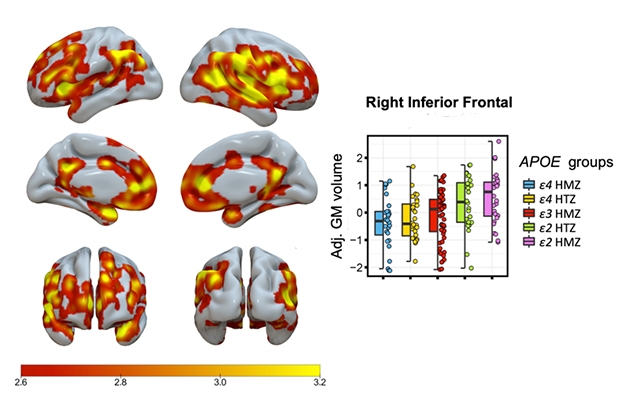
Bit by Bit. O sombreamento indica áreas com um aumento significativo no volume de matéria cinzenta relacionado ao genótipo ApoE, com homozigotos E4/4 tendo o menor e E2/2s o maior volume. O gráfico mostra os dados de uma região cerebral.
Como o ApoE2 pode conferir resiliência? Para descobrir, Gemma Salvadó, Barcelonaβeta Brain Research Center, Espanha, apresentou um estudo onde ela e os co-autores reuniram dados de imagem de diferentes amostras em tantos homozigotos ApoE2 mais antigos quanto puderam. Seu objetivo era comparar a estrutura cerebral do E2/2 com a de outros genótipos ApoE.
Anteriormente, o E2 tinha sido ligado a mudanças sutis na morfologia cerebral em pessoas saudáveis, incluindo atrofia hipocampal mais lenta na velhice e hipocampos maiores na meia-idade (Chiang et al., 2010; Fennema-Notestine et al., 2011). Na infância, os portadores de E2 têm sido relatados como portadores de corticais entorhinais mais espessos do que os homozigotos E3 ou portadores de E4 (Shaw et al., 2007). Mas todos estes estudos se concentraram em pessoas com uma cópia do E2.
Para descobrir o que esse E2 extra faria, Salvadó coletou e analisou dados de ressonância magnética em pessoas com deficiência cognitiva no estudo ALFA em Barcelona (Molinuevo et al. 2016), na coorte do Centro Médico da Universidade de Amsterdã, nos estudos de imagem de acesso aberto da OASIS e no ADNI. Ela encontrou 28 homozigotos E2/E2. Ela combinou cada um deles com outros cinco sujeitos do mesmo centro em termos de idade, sexo e nível de educação, e um de todos os outros genótipos ApoE. Isso deu um total de 168 indivíduos, com idade média de 62,
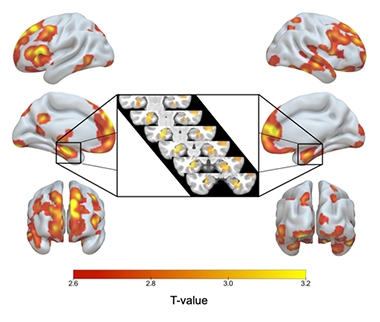
ApoE2/2 Acima de 3/3. Sombreamento vermelho a amarelo indica regiões do cérebro onde os homozigotos ApoE2 tinham mais matéria cinzenta do que os homozigotos E3, incluindo ambos os hipocampos (inset).
Comparados com seus pares E3/3, os E2/2s tinham maior volume de matéria cinzenta em seus hipocampos e outras áreas de assinatura AD, incluindo o córtex temporal medial, temporal inferior, pólo temporal, pré-cuneus e regiões parietais superiores. Os homozigotos E2 também tinham mais matéria cinzenta em áreas relacionadas à resiliência cognitiva no envelhecimento, nomeadamente nas áreas cingular anterior e pré-frontal medial (Arenaza-Urquijo et al., 2019; Harrison et al., 2018). Quando comparados com os heterozigotos E2/3, os homozigotos E2 apresentavam poucas diferenças significativas na matéria cinzenta, mas tinham hipocampos ainda maiores que os 2/3s.
Salvadó relatou um aumento gradual, relacionado ao genótipo, no volume de matéria cinzenta, com os homozigotos E4/4 tendo o menor, E3/3s tendo o intermediário, E2/3s o maior, e E2/2s o maior volume (ver imagem abaixo).

ApoE2/2 Acima de 2/3. Em comparação com o genótipo de protecção seguinte, os homozigotos ApoE2/3, E2 têm mais matéria cinzenta apenas em algumas pequenas áreas.
Ela acredita que a matéria cinzenta maior em áreas estratégicas do cérebro pode ajudar os homozigotos E2 a lidar com a patologia AD, se e quando ela aparecer. Como o ApoE2 enche o córtex entorhinal já na infância, a resiliência pode surgir de processos de desenvolvimento, disse ela.
“Estas são descobertas muito importantes”, comentou Reiman. “Eles sugerem que se a atrofia é como corroer a banda de rodagem dos pneus, os homozigotos E2 podem começar com mais banda de rodagem”, disse ele. Salvadó está tentando expandir o estudo para olhar mais homozigotos de coortes adicionais, e outros modos de imagem.
Terry Goldberg, Columbia University, New York, tem estudado mecanismos potenciais de neuroproteção mediada pelo ApoE2 há anos (Conejero-Goldberg et al., 2014). Na AAIC, Goldberg apresentou resultados sobre a relação dos alelos ApoE com a neuropatologia na DA e estendeu a análise para outras doenças.
Ele utilizou dados sobre 1.557 cérebros da base de dados do Centro Nacional de Coordenação de Alzheimer que tinham avaliações tanto clínicas quanto neuropatológicas. Como ele tinha tão poucos homozigotos E2, Goldberg agrupou os genótipos E2/E2 e E2/E3, para uma amostra de 130. Nesse grupo combinado, um em cada quatro cérebros tinha alterações neuropáticas AD, comparado com 40% dos E3/3, 65% dos E3/4 e 85% dos E4/4. Consistente com trabalhos anteriores, os portadores de E2 tinham a patologia amilóide mais leve, poucas placas neuriticas e a patologia tau mais leve. Uma análise estatística de mediação sugeriu que a associação do ApoE2 com a redução dos emaranhados passou em parte pelo seu efeito sobre a amilóide, e foi parcialmente independente da amilóide. Isso se encaixa nos resultados de Reiman.
Neste conjunto de dados, ApoE2 também foi fortemente protegido, mesmo que Goldberg não tenha analisado homozigotos: O E2 reduz o risco de amilóide e tau patologia pela metade em comparação com o E3, e em 90% em comparação com o E4.
O que é mais potente, E2 ou E4? Comparando os genótipos E2/E4 e E3/E4, Goldberg encontrou níveis comparáveis de patologia. O emparelhamento do E2/E4 foi pior. Isto sugere que o E4 ultrapassa os efeitos protetores do E2. “Pode-se dizer que o E4 é tóxico”, concluiu Goldberg. Isso sugere que terapias usando construções virais para introduzir o E2 no tecido cerebral do E4-expressor podem não ser úteis, disse ele.
E que tal outras doenças neurodegenerativas?
A literatura oferece resultados mistos sobre E2 e E4 em demência frontotemporal. Alguns estudos sugerem que o E2 promove o risco (notícias de Mar 2016) enquanto outros o creditam com proteção e culpam o risco do E4 (Mishra et al., 2017). Na AAIC, Goldberg relatou que o E2 foi associado com patologia mais grave do TDP-43 entre 103 casos de demência frontotemporal, e com mais tau patologia em 28 casos de doença de Pick e 51 casos de paralisia supranuclear progressiva. Ele advertiu que estes números são tão pequenos que os resultados podem ser espúrios. Goldberg não sabe se esses pacientes tinham C9ORF72 ou mutações progranulinas, e o acúmulo de TDP-43 pode estar associado à idade. Nos casos da patologia da sinucleína α, Goldberg descobriu que o ApoE4 promove, e o E2 reduz, a propagação da patologia do corpo Lewy fora de sua origem no cérebro médio, em áreas límbicas e neocorticais
Conjuntamente, estes estudos destacam uma apreciação renovada do enorme impacto que o ApoE exerce sobre a patogênese da DA (por exemplo, ver Wu e Zhao, 2016). A profunda proteção proporcionada pelo E2 provavelmente reacenderá o interesse entre os desenvolvedores de medicamentos, que já tentaram e falharam antes, mas podem agora achar apropriado revisitar este alvo.-Pat McCaffrey
Citações de notícias
- ApoE: Culpa Microglial Comum no Envelhecimento, Alzheimer e Tauopatia? 11 Ago 2018
- ApoE4 Faz Todas as Coisas Piorarem, Do Começo ao Fim 20 Set 2017
- Et Tu, ApoE2? Alegações de Papel Só o Papel Aumenta o Risco de Demência na ALS 1 Mar 2016
Citações de Papel
- Feussner G, Funke H, Weng W, Assmann G, Lackner KJ, Ziegler R.Severe tipo III hiperlipoproteinemia associada com o fenótipo incomum da apolipoproteína E1 e o genótipo epsilon 1/’null’. Eur J Clin Invest. 1992 Set;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST.A novel mutation in the apolipoprotein E gene (APOE*4 Pittsburgh) is associated with the risk of late-onset Alzheimer’s disease. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoprotein E2-Christchurch (136 Arg—-Ser). Nova variante da apolipoproteína E humana em paciente com hiperlipoproteinemia tipo III. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.ApoE4 exacerba marcadamente a neurodegeneração mediada pelo tau num modelo de tauopatia do rato. A natureza. 2017 Set 28;549(7673):523-527. Epub 2017 Set 20 PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Prevalência da patologia amilóide cerebral em pessoas sem demência: uma meta-análise. JAMA. 2015 Maio 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE investigadores.O impacto do genótipo APOE na sobrevivência: Resultados de 38.537 participantes de seis coortes de base populacional (E2-CHARGE). PLoS Um. 2019;14(7):e0219668. Epub 2019 Jul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .Hippocampal atrophy rates and CSF biomarkers in elderly APOE2 normal subjects. Neurologia. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.Presença do alelo ApoE ε4 associado ao córtex frontal mais fino na meia-idade. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN.Cortical morphology in children and adolescents with different apolipoprotein E gene polymorphisms: an observational study. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.O projecto ALFA: Uma plataforma de pesquisa para identificar as características fisiopatológicas precoces da doença de Alzheimer. Alzheimer Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3 PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P. A assinatura metabólica cerebral da resiliência cognitiva nos 80+: além das patologias de Alzheimer. Cérebro. 2019 Abr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ.Brain morphology, cognition, e β-amilóide em adultos mais velhos com desempenho de memória superior. Envelhecimento do Neurobiol. 2018 Jul;67:162-170. Epub 2018 Mar 27 PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE.APOE2 melhora a neuroproteção contra a doença de Alzheimer através de múltiplos mecanismos moleculares. Mol Psiquiatria. 2014 Fev 4; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium.Gene-based association studies report genetic links for clinical subtypes of frontotemporal dementia. Cérebro. 2017 Abr 5; PubMed.
- Wu L, Zhao L.ApoE2 e doença de Alzheimer: hora de dar uma olhada mais de perto. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
Outra Leitura
Não há Leitura adicional disponível