Abstract
O objectivo deste estudo, centrado num pequeno número de casos, é lidar com o angiossarcoma da mama, representando menos de 1% de todos os tumores mamários de tecido mole, e finalmente partilhar a nossa experiência. Como consequência da terapia de conservação da mama (TBC) que é o tratamento padrão hoje em dia, um novo tipo de angiossarcoma tem sido destacado: Angiossarcoma induzido por radiação (RIAS).
Aqui é relatada uma análise retrospectiva das características dos pacientes RIAS, juntamente com um relato do tratamento integrado e o resultado de seis casos de RIAS tratados em nossa instituição de 2013 a 2018.
Angiossarcoma de mama como consequência de cirurgia e radioterapia tem sido raramente registrado, mas é uma complicação documentada do tratamento irradiante do câncer de mama, com alta taxa de recorrência e maus resultados.
Sobra-se um desafio clínico, radiológico e histológico, sendo portanto necessário um alto índice de suspeita em pacientes suscetíveis. A mastectomia simples é a opção de tratamento primário, entretanto, um número crescente de estudos sobre o uso de radioterapia e quimioterapia, cada um com grau variável de sucesso, está sendo focado. A reirradiação pode ser levada em consideração a fim de aumentar o controle local, enquanto a quimioterapia pode ser considerada para casos em estágio mais avançado.
Abreviação
RIAS: Angiossarcoma induzido por radiação; TBC: Terapia de conservação dos seios; AS: Angiossarcoma mamário; RMN: Ressonância Magnética; IMRT: Radioterapia Modulada por Intensidade
Palavras-chave
Angiossarcoma de Mama (AS), Angiossarcoma induzido por radiação (RIAS), Mastectomia radical (RM), Tumores induzidos por radiação, Radioterapia adjuvante, Radioterapia Modulada por Intensidade (IMRT)
Introdução
Neste trabalho estão sendo discutidos o diagnóstico, gerenciamento e resultado do RIAS em um pequeno número de pacientes com câncer de mama.
Como um tumor vascular muito raro, o angiossarcoma de mama (AS) pode ser dividido em primário, se surgir sem um precursor conhecido, ou secundário, se ocorrer no local de pele previamente irradiada, caso em que é conhecido como Angiossarcoma Induzido por Radiação (RIAS) da mama . Porém, ainda não existem diretrizes baseadas em evidências sobre o tratamento ideal dos angiossarcomas.
Nas pacientes submetidas à cirurgia de conservação da mama com radioterapia adjuvante, a incidência estimada de RIAS varia entre 0,05 e 0,3%, sendo responsável por menos de 1% dos tumores mamários e por aproximadamente 3% de todos os sarcomas de tecidos moles.
A incidência de RIAS parece estar aumentando, talvez refletindo o longo período de latência para o desenvolvimento destes tumores após a adoção generalizada da radioterapia adjuvante para o câncer de mama.
O diagnóstico de RIAS da mama é frequentemente retardado devido ao seu aspecto benigno e à dificuldade em diferenciá-lo das alterações cutâneas inespecíficas induzidas pela radiação prévia ou de outra doença . Os achados radiológicos também são frequentemente inespecíficos. Embora o RIAS normalmente se desenvolva 10 anos após o tratamento com radiação para o câncer de mama, o período de latência pode variar de 6 meses a 20 anos, levando alguns autores a acreditar que provavelmente está sendo subnotificado e que as taxas de incidência reais são, portanto, mais altas. Como a incidência do câncer de mama está aumentando, o uso da cirurgia de conservação da mama seguida de radioterapia tem substituído a mastectomia radical como tratamento padrão. A incidência associada da RIAS também está a aumentar, com uma incidência acumulada estimada de 0,9-3,2 por 1000 casos de cancro da mama. Em um grande estudo de coorte populacional, um histórico de radioterapia prévia como tratamento do câncer de mama foi associado a um aumento de 26 vezes no risco de desenvolvimento de angiossarcoma quando comparado com grupos de controle não irradiados . O prognóstico para pacientes com RIAS continua pobre, com taxas de sobrevida global de 5 anos variando de 27 a 48%. Apesar do RIAS ter sido descrito pela primeira vez no início da década de 1920, sua biologia molecular ainda é controversa e, portanto, não há uma terapia específica disponível.
Correntemente, a ressecção cirúrgica agressiva é comumente advogada como o tratamento de escolha. Há uma falta de dados que comprovem a eficácia da quimioterapia adjuvante.
A cirurgia, sob a forma de excisão ampla ou mastectomia, é a base do tratamento na doença localizada. Alguns estudos relataram uma associação entre as margens de R0 e a melhora da taxa de sobrevivência, embora não tenha sido demonstrado que seja independente de outros fatores biológicos, como o tamanho do tumor . Há algumas evidências de que a quimioterapia neoadjuvante pode melhorar os resultados no tratamento do angiossarcoma, cuja raridade limita nosso conhecimento a relatos de casos ou a pequenas séries de casos retrospectivos.
A fim de caracterizar uma população de pacientes com RIAS, tratados em nosso hospital por um período de 5 anos, realizamos um estudo retrospectivo analisando a utilidade da mamografia, ultra-som e ressonância magnética (RM) para o nosso diagnóstico .
Nosso trabalho foi relatado de acordo com os critérios da SCARE .
Materiais e Métodos
Nossa série de casos diz respeito a pacientes com angiossarcoma de mama histologicamente comprovado, desenvolvido após radioterapia para câncer de mama, entre 2013 e 2018, e analisa estratégias de tratamento com uma abordagem multidisciplinar.
As pacientes afetadas, seis mulheres com angiossarcoma de mama induzido por radiação, foram identificadas através de uma busca exaustiva no período mencionado do registro de câncer de nossa instituição, no Hospital Universitário de Catânia. A idade média foi de 70 anos, variação: 59-79 anos de idade. Os pacientes tinham realizado o diagnóstico e o manejo terapêutico prévio em várias instituições, de modo que a informação não está toda disponível. A descrição das características dos pacientes e os procedimentos de tratamento realizados após o diagnóstico do RIAS estão descritos na Tabela 1. Todas as pacientes haviam sido submetidas a tratamento conservador de mama no momento do diagnóstico, com radioterapia adjuvante administrada por radioterapia convencional em conformidade tridimensional a uma dose total de 50 Gy, com fracionamento diário de 2 Gy, com ou sem reforço do leito tumoral de 10 Gy. Os tumores foram do lado direito em 3 pacientes, e do lado esquerdo nos outros 3. Durante o tratamento adjuvante, cinco em cada seis pacientes receberam quimioterapia sistêmica à base de antraciclina, de acordo com diretrizes institucionais, enquanto todos os pacientes receberam terapia hormonal adjuvante inibidora da tamoxifena/aromatase. Nenhum paciente tinha câncer HER2-positivo no momento do diagnóstico.
Pós um período médio de 7,6 anos (variação: 5-11 anos), foi realizado o diagnóstico de angiossarcoma ipsilateral da mama: os sinais mais freqüentemente exibidos pelas pacientes no início foram nódulos cutâneos de cor vermelha-violeta, localizados no contexto de campos de irradiação, com uma taxa de crescimento moderadamente variável de algumas semanas a 4-6 meses. Todos os pacientes receberam uma confirmação histológica de angiossarcoma secundário e foi realizada uma mastectomia radical em todos os casos. Para diagnosticar RIAS, foram seguidos os critérios de Cahan e Arlen: sarcoma surgido no campo irradiado anterior; um período de latência de pelo menos 3 anos entre a radioterapia e o desenvolvimento do sarcoma; e uma distinção histológica entre o sarcoma secundário e a neoplasia primária. Todos os seis pacientes receberam um trabalho radiológico completo com mamografia, ultra-som e RM (em 4/6 pacientes) na tentativa de confirmar a suspeita clínica de RIAS, mas não foram identificadas características patognomônicas. O crescente interesse da literatura científica em identificar características específicas da “assinatura de radiação” ainda não produziu dados consolidados. Três dos seis pacientes destacados em nossa série de casos foram objeto de um estudo imunohistoquímico para a avaliação da expressão da MYC, que havia mostrado uma alta expressão em tais pacientes. A Tabela 1 também relata as características histológicas do tumor. A data do diagnóstico da RIAS foi definida como o dia em que foi feito o diagnóstico histológico. O período de latência foi definido como o tempo da primeira sessão de radiação e a data do diagnóstico de RIAS. Apenas uma paciente apresentou metástases síncronas (no pulmão) no diagnóstico de RIAS, enquanto outras cinco pacientes apresentaram apenas doença mamária.
Tabela 1: Características das pacientes e procedimentos de tratamento. Ver Tabela 1
Todas as pacientes submetidas à cirurgia em nosso Hospital foram discutidas em uma reunião multidisciplinar de sarcoma em fase pré-operatória. Os pacientes foram classificados como portadores de doença ressecável se a avaliação pré-operatória indicasse que uma margem negativa de 2 cm ou maior poderia ser obtida pela cirurgia com ou sem reconstrução cirúrgica plástica na forma de um único retalho miocutâneo pediculado ou livre. Se as margens negativas desejadas exigissem uma reconstrução mais extensa, como por exemplo com ressurfacing extenso por grandes enxertos de pele, o paciente seria classificado como portador de doença irresecável.
Doença rapidamente progressiva, onde o volume da doença aumentou durante um período de 2-3 semanas, passando de adequada para mastectomia isolada ou em combinação com um retalho pediculado para requerer reconstrução mais extensa, também foi considerada irresecável em termos oncológicos.
Biópsias pré-operatórias foram realizadas para confirmar a presença de AS e excluir outras doenças.
Ressecção completa macroscópica foi considerada pelo cirurgião cirúrgico. Histologicamente, a ressecção foi classificada como R0 (microscopicamente negativa) se as margens negativas fossem superiores a 1 cm circunferencialmente ou R1 (microscopicamente positiva) se o tumor se estendesse até ou dentro de menos de 1 cm da margem de ressecção.
Quatro pacientes foram recrutados para reirradiação imediata, enquanto um paciente foi tratado após 13 meses quando ocorreu uma recidiva parietal (ela havia recusado a reirradiação imediata), o último paciente foi excluído da reirradiação, pois ele havia atingido os limites de dose para o coração no tratamento anterior. A decisão sobre a administração de quimioterapia adjuvante foi tomada caso a caso, com base nos dados disponíveis em relação aos tratamentos anteriores recebidos e ao estado de desempenho dos pacientes. Um paciente recebeu quatro ciclos de quimioterapia epirubicina-ifosfamida, um de epirubicina sozinho durante seis ciclos, três foram excluídos por razões médicas (idade, comorbidades ou dose de tolerância das antraciclinas já atingidas anteriormente). Um paciente recebeu semanalmente paclitaxel durante 12 ciclos para metástases pulmonares síncronas.
Radioterapia foi administrada levando em conta as doses recebidas de tecidos saudáveis na irradiação anterior e administração prévia de antraciclinas. Por estas razões, optamos por realizar a re-irradiação por meio de radioterapia modulada por intensidade (IMRT, ver Figura 1), utilizando uma técnica step-and-shoot, de acordo com nossos procedimentos institucionais . A dose de radiação e esquema de fracionamento utilizados variaram: duas pacientes receberam fracionamento convencional a 50 Gy, duas pacientes receberam 40 Gy (porque o tempo decorrido da irradiação anterior era curto e a neoplasia localizava-se na mama esquerda), uma paciente 35 Gy em 5 Gy fração uma vez por semana (devido à menor complacência clínica).
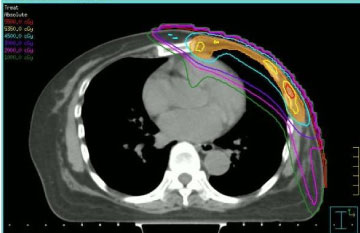 Figura 1: Imagem de TC transversal com distribuição de dose com intensidade modulada por passo e intensidade de tiro. Ver Figura 1
Figura 1: Imagem de TC transversal com distribuição de dose com intensidade modulada por passo e intensidade de tiro. Ver Figura 1
Resultados
Não foram relatadas margens positivas nos pacientes que receberam mastectomia radical realizada pela mesma equipe cirúrgica.
Mastectomia radical contínua, os pacientes receberam tratamento como planejado, sem nenhuma interrupção, tanto para quimioterapia quanto para radioterapia. Em um tempo médio de seguimento de 22 anos (variação: 1,5-4 anos), três pacientes estão vivos, sem evidências de recidiva ou doença progressiva. Um paciente com metástases pulmonares sincrônicas no momento do diagnóstico ainda está recebendo tratamento oncológico ativo. Uma paciente desenvolveu metástases pulmonares e ósseas, mas ainda está viva no momento da submissão do trabalho. Os dois últimos pacientes desenvolveram metástases pulmonares, uma das quais associada à recidiva local, e morreram após 8-10 meses (a distribuição das características dos pacientes em relação à apresentação da doença e ao tratamento recebido está descrita na Tabela 1). No total, a sobrevida livre de doença foi de 14 meses para cinco pacientes sem doença sistêmica ao diagnóstico de RIAS, enquanto a sobrevida livre de progressão para paciente metastático sincrônico ao diagnóstico foi de 12 meses.
Como podemos esperar, resultados de sobrevida mais pobres, relatados na literatura, foram notados em pacientes com doença localmente avançada inadequada para o tratamento cirúrgico, em comparação com os casos da nossa série. Estes fatores destacam a importância do diagnóstico precoce em pacientes com RIAS. Os angiossarcomas muitas vezes se apresentam de forma insidiosa com alterações de pele roxa ou vermelha e podem ser facilmente confundidos com hematomas ou alterações benignas da pele, levando a atrasos na investigação e diagnóstico. A detecção precoce e o encaminhamento imediato podem potencialmente reduzir o número de pacientes com doença irresectável e melhorar o controle local e distante da doença.
Discussão
Tumores induzidos por radiação normalmente surgem no contexto ou na borda do campo de irradiação, onde a dose não é uniforme e pode resultar inferior à necessária para induzir a destruição celular, ou causar mutações que podem levar ao processo de carcinogênese. Como efeito da radiação ionizante, as modificações químicas e bioquímicas induzidas nos organismos vivos produzem alterações funcionais e morfológicas das células causando um dano biológico. Cada célula, capaz de se replicar, pode tornar-se potencialmente cancerosa; se as células que apresentam modificações cromossômicas escaparem dos controles celulares normais, pode ocorrer carcinogênese.
A probabilidade de desenvolver tumores em pacientes submetidos a radioterapia para tratamento do câncer de mama é muito baixa e não pode limitar o uso da radioterapia quando indicada. Doses de radiação acima de 50 Gy induzem a morte celular e doses menores (
Muitos estudos têm sugerido a correlação entre o início dos sarcomas de tecido mole e os tratamentos de radiação realizados para lidar com tumores de mama. A radioterapia aumenta o risco de desenvolvimento de sarcomas de partes moles e, em particular, de desenvolvimento de angiossarcoma. RIAS representa, aproximadamente, menos de 1% dos tumores de mama . O angiossarcoma radioinduzido tem muitas manifestações clínicas: As pacientes frequentemente apresentam alterações cutâneas assintomáticas que dificilmente podem ser distinguidas das alterações actínicas comuns que podem ser encontradas após o tratamento radioterápico da mama. As pacientes frequentemente apresentam um inchaço palpável, uma área vermelho-púrpura semelhante a um hematoma. Os angiossarcomas podem ser confundidos com manifestações benignas como angiomas ou telangiectasias atípicas. Pápulas roxas ou nódulos eritematosos também podem ocorrer.
Apesar de todos os esforços terapêuticos, a taxa de sobrevida em cinco anos varia de 27% a 62,8% (2-3). Embora o RIAS normalmente se desenvolva 10 anos após tratamentos de radiação para câncer de mama, o período de latência pode variar de 6 meses a 20 anos. O angiossarcoma radioinduzido é indistinguível do angiossarcoma espontâneo, mas algumas diferenças podem ser avaliadas: Lae, et al. compararam a amplificação c-myc no cromossomo 8q24,21 em 32 espécimes RASB e 15 espécimes de angiossarcoma esporádico .
Em nossa série, os pacientes apresentaram sinais inespecíficos de doença, mas o diagnóstico foi feito prontamente na maioria dos casos. O período de latência foi de acordo com o relatado na literatura, com um tempo médio de 76 anos.
É sabido que a NVR tem uma alta taxa de recidiva. A recidiva local, seja no leito do tumor ou ao longo da cicatriz cirúrgica, é relatada na maioria (96%) dos casos de RIAS. Isto é provavelmente devido ao crescimento multifocal do RIAS ou remanescentes de tecido maligno após a cirurgia, mesmo com margens cirúrgicas negativas. A doença metástática, mais freqüentemente nos pulmões e no fígado, pode estar presente ao mesmo tempo ou logo após as recidivas locais. Abbott, et al. revisaram retrospectivamente todos os casos de RIAS publicados a partir de 2017 e resumiram os dados . Os autores constataram que a taxa de recidiva local foi de 59% e que o tempo médio de recidiva foi de 6 meses (intervalo, 1-78 meses). Descobriram também que a doença metastática era geralmente precedida por pelo menos uma recidiva local e que os locais mais comuns eram os pulmões, a mama contralateral e o esqueleto. Além disso, sua revisão histológica de 42 casos sugeriu que a RIAS pouco diferenciada estava associada a um alto risco de metástase, enquanto tumores bem diferenciados apresentavam maior risco de recorrência local do que de metástases distantes.
Sarcoma induzido por radiação é uma neoplasia rara, porém altamente agressiva. Seu manejo é motivo de debate, pois não há diretrizes de tratamento disponíveis, o prognóstico é pobre e a taxa de sobrevida em 5 anos varia muito, como relatado anteriormente . Entretanto, a ressecção cirúrgica agressiva é comumente defendida como o tratamento de escolha.
A cirurgia, na forma de mastectomia com ou sem reconstrução plástica, é o tratamento de escolha em pacientes que apresentam doença localizada. Na série de pacientes em tratamento, é possível alcançar margens de ressecção microscopicamente completas (R0) em mais de 80%. As RIAS apresentam-se tipicamente como lesões multifocais. A tendência desta patologia para a criação de depósitos microsatélite pode contribuir para a dificuldade de obtenção de controlo local.
A importância da realização de uma ressecção patológica completa tem sido enfatizada na literatura, embora não tenham sido publicadas diretrizes padronizadas quanto à distância de remoção recomendada. Na série atual, verificou-se que aqueles que desenvolveram recidiva local tiveram margens mais próximas do que aqueles que não o fizeram. Entretanto, o estado marginal não foi encontrado como prognóstico independente dos resultados oncológicos nesta série. Isto sugere que a capacidade de alcançar maiores margens depende de outros fatores biológicos tumorais que também determinam o desfecho, tais como o tamanho. É provável que a biologia tumoral seja a principal responsável pelo desfecho no RIAS, embora a cirurgia inicial deva visar a desobstrução macroscópica, deve-se advertir que alcançar maiores margens negativas não equivale necessariamente a melhorar os resultados dos pacientes.
Embora o número crescente de estudos com foco em quimioterapia e radioterapia, seja neoadjuvante ou adjuvante, seu papel permanece pouco claro. Há falta de dados que comprovem a eficácia da quimioterapia adjuvante, dados recentes sugerem que a radioterapia pode ser útil na prevenção de recidivas. A radioterapia adjuvante após a cirurgia, segundo Johnstone et al. permite um melhor controle local . O papel da IMRT no tratamento da parede torácica está atualmente sob avaliação, pois pode reduzir a taxa de incidência de toxicidade por radiação, diminuindo a irradiação de órgãos em risco (OARs). Em um estudo de comparação dosimetria, os autores relatam que a IMRT planeja a parede torácica e o alvo, em comparação com os tratamentos convencionais, permite diminuir a dose máxima, aumentar a dose mínima, resultando assim em melhor conformidade e uniformidade do volume alvo .
O papel e eficácia da quimioterapia não foi estabelecido, pois o conjunto de dados disponíveis provém de grupos de amostras de pequeno tamanho, dos quais não é possível tirar conclusões definitivas, mas provavelmente pacientes com grau de malignidade mais alto, G3 e com recidiva, poderiam se beneficiar mais da quimioterapia neo ou adjuvante.
O uso de quimioterapia neo/adjuvante também foi associado à melhoria do controle local da doença em uma grande série retrospectiva de pacientes com sarcomas induzidos por radiação de todos os locais, embora não associado à melhoria das taxas de recidiva sistêmica ou sobrevivência . A quimioterapia adjuvante não produziu um benefício em termos de controle local ou estudo global de sobrevivência de sarcomas de tecidos moles de alto risco tratados com cirurgia e radiação . Como tal, há poucas evidências que sugiram que a quimioterapia neo/adjuvante produza um benefício de sobrevivência no RIAS, embora certamente possa ser útil como terapia de indução antes da cirurgia naqueles que apresentam doença localmente avançada e possa oferecer aos pacientes paliação eficaz da doença além disso. Terapias direcionadas podem oferecer um tratamento alternativo em pacientes com doença progressiva.
Em nossa série, como conseqüência da alta tendência à recorrência local desta neoplasia, decidimos propor a todos os pacientes uma segunda irradiação, com exceção de um deles para os problemas dosimétricos acima mencionados. Um paciente recusou a re-irradiação imediata e o tratamento foi realizado em caso de recidiva. Não foi possível programar um tratamento radiante homogêneo para todos os pacientes, devido à heterogeneidade da amostra para doses de irradiação previamente utilizadas, má aderência clínica em um caso e, sobretudo, falta de indicações claras da literatura e das diretrizes. Em qualquer caso, decidimos realizar o tratamento por meio de uma técnica modulada por intensidade, a fim de permitir uma distribuição adequada da dose, uma redução da exposição dos tecidos saudáveis circunvizinhos, especialmente para o parênquima pulmonar subjacente e para o coração.
Conclusões
Radioterapia no tratamento do câncer de mama está associada a um risco aumentado de sarcoma subseqüente, mas a porcentagem de risco é muito baixa.
RIAS é uma lesão rara, agressiva de tecidos moles, com opções de tratamento limitadas e altas taxas de recidiva local e sistêmica.
Observação cuidadosa após radioterapia adjuvante é necessária. O tratamento padrão envolve cirurgia com mastectomia simples e radioterapia adjuvante. A quimioterapia pode ter um papel na redução da doença localmente avançada, embora não tenha efeito comprovado na sobrevida.
Angiossarcoma é significativamente mais prevalente nos casos tratados com radioterapia, ocorrendo especialmente no campo de radiação ou adjacente a ele. A pequena diferença no risco de sarcoma subseqüente para pacientes com câncer de mama que recebem radioterapia não supera o benefício da radioterapia.
No entanto, nossa série é muito pequena para tirar conclusões finais e esta é uma limitação do estudo. Uma avaliação mais aprofundada é necessária, também através de um maior número de estudos de caso, a fim de se ter uma melhor classificação da patologia e permitir uma gestão multidisciplinar mais precisa.
Conflitos de interesse
Nenhum dos autores tem qualquer conflito de interesse a revelar.
Fontes de financiamento
Nenhum.
Aprovação ética
Aprovação foi dada pelo comitê de ética da Universidade de Catânia.
Consentimento informado
Consentimento livre e esclarecido foi obtido do paciente para publicação deste relato de caso e das imagens que o acompanham. Uma cópia do consentimento escrito está disponível para revisão pelo Editor Chefe desta revista, mediante solicitação.
Contribuições do Autor
Trovato Agata: Revisão e edição do artigo.
Registo de Estudos de Pesquisa
Nenhum.
Divulgação
Nenhum dos autores tem algo a divulgar.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Angiossarcoma primário e secundário da mama. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Resultados a longo prazo em pacientes com angiossarcoma de mama associado à radiação após cirurgia e radioterapia para câncer de mama. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma: a large-scale single-institution review. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Angiossarcoma da mama associado à radiação cutânea: mau prognóstico em uma rara malignidade secundária. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Clinical management of secondary angiosarcoma after breast conservation therapy. Rep. Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Sarcoma da mama induzido por radiação: uma revisão sistemática. Oncologista 17: 405-418.
- Huang J, Mackillop WJ (2001) Aumento do risco de sarcoma de partes moles após radioterapia em mulheres com carcinoma da mama. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Angiossarcoma associado à radiação após câncer de mama: alta taxa de recorrência e baixa sobrevida apesar do tratamento cirúrgico com ressecção R0. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Manejo cirúrgico do angiossarcoma induzido por radiação após terapia de conservação da mama. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Localised angiosarcomas: the identification of prognostic factors and analysis of treatment impact. Uma análise retrospectiva do Grupo Francês Sarcoma (GSF/GETO) Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Talidomida combinada com quimioterapia neoadjuvante no angiossarcoma da mama com resposta patológica completa: relato de caso e revisão da literatura. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Quimioterapia neoadjuvante para o angiossarcoma cutâneo/de tecidos moles primário: determinação do comportamento tumoral antes da ressecção cirúrgica. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Contralateral lymph node metastasis in a woman with new primary breast cancer: Doença sistêmica ou difusão locoregional? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement: Diretrizes de relato de caso cirúrgico baseadas em consenso. Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Secondary sarcomas after radiotherapy for breast cancer: sustained risk and poor survival. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) A amplificação c-myc pode discriminar de forma confiável a pós-tradiação do angiossarcoma primário da mama? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiossarcoma da mama após cirurgia e radioterapia para o cancro da mama. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiossarcoma após terapia de conservação da mama. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Dosimetric evaluation of integrated IMRT treatment of the chest wall and supraclavicular region for breast cancer after modified radical mastectomy. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) Uma meta-análise sistemática de ensaios controlados aleatórios de quimioterapia adjuvante para sarcoma de partes moles localizado e ressecável. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Quimioterapia adjuvante com doxorubicina, ifosfamida e lenograstim para sarcoma de tecidos moles ressecável (EORTC 62931): um ensaio controlado multicêntrico randomizado. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Casos de tuberculose mamária ascendendo na Sicília. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Role, timing and technique of radiotherapy in pediatric pleuropulmonary synovial sarcoma. Futuro Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Radioterapia modulada por intensidade para mesotelioma pleural maligno recidivante. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Experiência de radioterapia modulada por uma única instituição para mesotelioma pleural maligno na Universidade de Catania. Future Oncol 14: 17-21.
Citação
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) A Single Institution Study Experience of Secondary Breast Angiosarcoma after Breast Conserving Treatment: Gestão Multidisciplinar. Int J Cancer Clin Res 6:114. doi.org/10.2393737/2378-3419/1410114