Koltetraklorid kan uttryckas som CCl4 och består av en kolmolekyl och fyra kloridmolekyler. Koltetraklorid är opolär. Varför är koltetraklorid opolär? Den är opolär eftersom molekylens dipolmoment är jämnt fördelade runt den centrala kolatomen. Detta innebär att deras individuella effekter upphävs och att molekylen är neutral.
De fyra kloratomerna är symmetriskt placerade i de fyra hörnen av en tetraeder, och en enkelbindning förenar var och en av dem med kolatomen i molekylens centrum. Som ett resultat av detta har CCl4 inget positivt eller negativt dipolmoment. Om en annan atom än klor hade placerats på någon annan plats i molekylen skulle molekylen ha ett dipolmoment och CCl4 skulle därför vara polärt.
”Vi definierar organisk kemi som kemi av kolföreningar”. – August Kekule
Det är det snabba svaret angående polariteten hos koltetraklorid. Det skulle dock vara fördelaktigt att prata om molekylers polaritet i allmänhet och undersöka koltetraklorid och dess egenskaper för att förstå varför den är opolär i naturen.
Vad betyder det för en molekyl att ha polaritet?
När du hör termen polär tänker du troligen på jordens nord- och sydpoler. Dessa nord- och sydpoler ligger i motsatta ändar av jorden, på samma sätt som ett batteri kan ha en positiv och negativ pol. Molekyler och bindningarna mellan atomer kan också ha polaritet. En molekyl definieras som polär när de atomer som utgör molekylen är arrangerade på ett sätt som ger den ena änden av molekylen en positiv laddning och den andra änden av molekylen en negativ laddning.
En polär molekyl skapas när en atom som har en hög elektronegativitetsnivå kombineras eller binds med en atom som har en svagare elektronegativitetsnivå. Den resulterande molekylen har ett område med hög elektronegativitet och ett område med lägre elektronegativitet eller elektriska poler. Ett av de mest kända exemplen på en polär molekyl är vatten, och det är tack vare vattnets polära natur som det utgör grunden för livet på jorden.
Däremot saknar opolära molekyler elektriska poler, och elektronerna i dem fördelas på ett mer jämnt sätt. Opolära molekyler saknar en anmärkningsvärd laddning i molekylens båda ändar. De flesta kolvätevätskor är opolära i naturen.
Sammanfattningsvis är en molekyl som har dipoler som inte upphäver varandra polära, medan opolära molekyler är sådana där atomernas laddningar upphäver varandra och där det inte finns någon laddning i den ena eller andra änden av molekylen.
Exempel på polära molekyler
Som tidigare nämnts är vatten en polär molekyl. De bindningar som finns mellan syreatomerna och väteatomerna är fördelade så att båda sidorna av atomen, båda syre-väte- och bindningarna, är jämnt fördelade. Resultatet är att syrgassidan, eller toppen av molekylen, har en svagt negativ laddning medan väteatomerna, eller botten av molekylen, har en svagt positiv laddning.
Etanol är en polär molekyl eftersom de syreatomer som finns i molekylen har en högre elektronegativitet än de andra atomerna. Syreatomerna drar till sig fler elektroner på grund av sin högre elektronegativitetspotential, och -OH-bindningsgrupperna i molekylen har negativa laddningar totalt sett, även om den negativa laddningen är mycket svag.
”Livet existerar i universum bara för att kolatomen besitter vissa exceptionella egenskaper”. – James Jeans
ADVERTIVERING
Andra exempel på polära molekyler är svaveldioxid (SO2), vätesulfid (H2S) och ammoniak (NH3).
Varnas för att en molekyl kan bestå av polära bindningar och ändå vara opolär. Ett exempel är koldioxid, som har fyra bindningar men molekylens dipolmoment slutar med att neutralisera varandra så att molekylen är opolär.
Exempel på opolära molekyler

Exempel på opolära molekyler är kväve, metan, ozon och syre. Dessa är homonukleära molekyler eller molekyler som består av atomer från endast ett grundämne. Opolära molekyler som inte är homonukleära är bland annat koldioxid, som nämns ovan och metan. Toluen och bensin är också exempel på opolära ämnen. Som allmän regel är kolföreningar opolära, även om det finns några undantag som kolmonoxid. Kolmonoxid är linjär till sin natur, vilket vanligtvis skulle göra en molekyl opolär, men skillnaden i elektronegativitet mellan syre- och kolmolekylen är tillräckligt stor för att molekylen ska vara polär. Alkyner löser sig inte i vatten och anses vara opolära molekyler. De inerta eller ädelgaserna klassificeras också som opolära molekyler eftersom gaserna endast består av enstaka atomer av sina respektive grundämnen, t.ex. neon, helium, argon och krypton.
Förutsägning av en molekyls polaritet
En undersökning av elektronegativitetsvärdena för atomerna i en molekyl hjälper dig att avgöra om det är troligt att molekylen kommer att vara polär eller opolär. Betydande skillnader mellan elektronegativitetsvärdena innebär att elektronerna är jämnt fördelade mellan atomerna i molekylen. Eftersom elektronerna kommer att vara närmare en atom än en annan kommer det området av molekylen att vara polärt, men för att bestämma polariteten hos hela molekylen måste alla bindningar beaktas.
Den avgörande faktorn för en molekyls polaritet eller opolaritet är dess geometri. Om molekylens ena ände har en negativ laddning medan molekylens andra ände har en positiv laddning kommer molekylen att vara polar. Men om laddningarna är jämnt fördelade och kretsar kring en central atom är molekylen förmodligen opolär. Du kan använda detta för att förutsäga om en molekyl kommer att vara polär eller opolär. Alla molekyler har inte ett dipolmoment, och detta kan göra det lite svårare att förutsäga en molekyls polaritet. Som exempel kan nämnas att molekyler som kan vändas och speglas över ett geometriskt plan inte har dipolmoment eftersom dipolmoment inte kan omfatta mer än en enda punkt.
Fakta om koltetraklorid
Koltetraklorid upptäcktes för första gången av den franske kemisten Henri Victor Regnault i mitten av 1800-talet. Kemikalien upptäcktes genom en kombination av klor och kloroform. Trots detta framställs koltetraklorid numera huvudsakligen från metan. Produktionen av koltetraklorid fungerar ofta genom att man använder biprodukterna från kloreringsreaktioner för att få fram föreningen. Detta inkluderar biprodukter från skapandet av kloroform och diklormetan. Koltetraklorid är ganska flyktigt av naturen och avger en lukt som liknar kemtvättskemikalier. Koltetraklorid är också lösningsmedel och är därför användbart vid upplösning av opolära ämnen som oljor och fetter.
Koltetraklorid har många olika användningsområden och har använts som rengöringsmedel, som kylmedel och i brandsläckare. Koltetraklorid används ofta vid tillverkningen av lavalampor och gör vaxet tyngre.
”… Är kolmolekylen fodrad med tanke?” – Saul Bellow
På grund av koltetrakloridens miljöpåverkan har dess produktion minskat kraftigt sedan 1980-talet. Montréalprotokollet begränsade produktionen av klorfluorkarboner, och eftersom koltetraklorid är en viktig ingrediens i skapandet av klorfluorkarboner har produktionen av koltetraklorid minskat kraftigt till följd av detta. De negativa hälsoeffekterna av koltetraklorid har också lett till att produktionen har minskat, och även om koltetraklorid en gång i tiden användes i stor utsträckning som lösningsmedel används det numera sällan för sådana ändamål.
Kolvtetraklorid är extremt giftigt för levern, och andra leverskadande ämnen jämförs ofta med koltetrakloridens giftighet. Höga koncentrationer av koltetraklorid kan inte bara skada levern utan även njurarna. Långvarig exponering för koltetraklorid kan leda till koma eller dödsfall. Exponering för kemikalien kan också öka risken för att utveckla cancer.
Varför är koltetraklorid polärt?
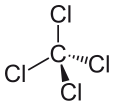
Efter att ha sett vad som gör en molekyl polär och tittat på några exempel på polära molekyler kan vi nu bättre förstå varför koltetraklorid är en opolär molekyl. Det första man bör göra när man försöker avgöra om en molekyl är polär eller opolär är att beräkna elektronegativitetsvärdena för atomerna i molekylen. Polariteten hos bindningen mellan två atomer måste fastställas, och alla bindningar måste beaktas när man försöker fastställa molekylens polaritet. Ändå är skillnaden i elektronegativitetsvärden mellan klorid och kol, i fallet med koltetraklorid, inte den enda faktorn som måste beaktas. Molekylens form måste också beaktas. Även om det finns dipoler i molekylen innebär koltetrakloridens linjära form att effekterna av de olika dipolmomenten i molekylen upphäver varandra, och molekylen är därför neutral eller opolär.