Apoptos

Apoptos, eller programmerad celldöd, är ett starkt reglerat sätt för en organism att selektivt eliminera celler. Denna process spelar en viktig roll i embryogenesen, för att upprätthålla en organisms storlek och för att eliminera skadade eller avvikande celler. Apoptosens betydelse för människors hälsa understryks av de många sjukdomar som beror på avvikande apoptos. Dysreglering av apoptos har kopplats till olika cancerformer, neurologiska och kardiovaskulära sjukdomar och autoimmuna sjukdomar.
Vi skiljer vanligen mellan två olika typer av apoptos: den intrinsiska vägen, som förmedlas av mitokondrier som svar på interna stimuli, t.ex. DNA-skador, och den extrinsiska vägen, som förmedlas av extracellulära dödsreceptorer (t.ex. bindning av FasL till FasLG-receptorn) (figur 1). Båda vägarna bygger på proteaser som kallas initiatorkaspaser som aktiverar en kaskad av effektorkaspaser, vilket leder till apoptos. Övergång mellan de intrinsiska och extrinsiska vägarna förmedlas via BH-3 interagerande domän dödsagonist (Bid).
Den intrinsiska vägen (figur 1) initieras av Bcl-2-homologiproteiner. I den klassiska apoptosvägen aktiveras Bcl-2-proteinerna Bax och Bak som svar på interna stimuli som DNA-skada eller oxidativ stress. Dessa två proteiner interagerar därefter med Bid och infogas i det yttre mitokondriella membranet. Detta resulterar i vad som anses vara den punkt där det inte finns någon återvändo i apoptos – mitokondriernas yttre membranpermeabilisering (MOMP). MOMP leder till att proapoptotiska faktorer som cytokrom c släpps ut i cytoplasman. Cytokrom c i cytoplasman binder APAF-1 och dATP för att rekrytera pro-caspase-9 och bildar apoptosomen. Bildandet av apoptosomen utlöser klyvning av pro-caspase-9 till dess aktiva proteasform, caspase-9. Caspase-9 är ett initiatorcaspas som sedan aktiverar nedströms effektorcaspas, såsom caspase-3 och -7, genom proteolys, vilket utlöser caspaskaskaden som leder till apoptos.
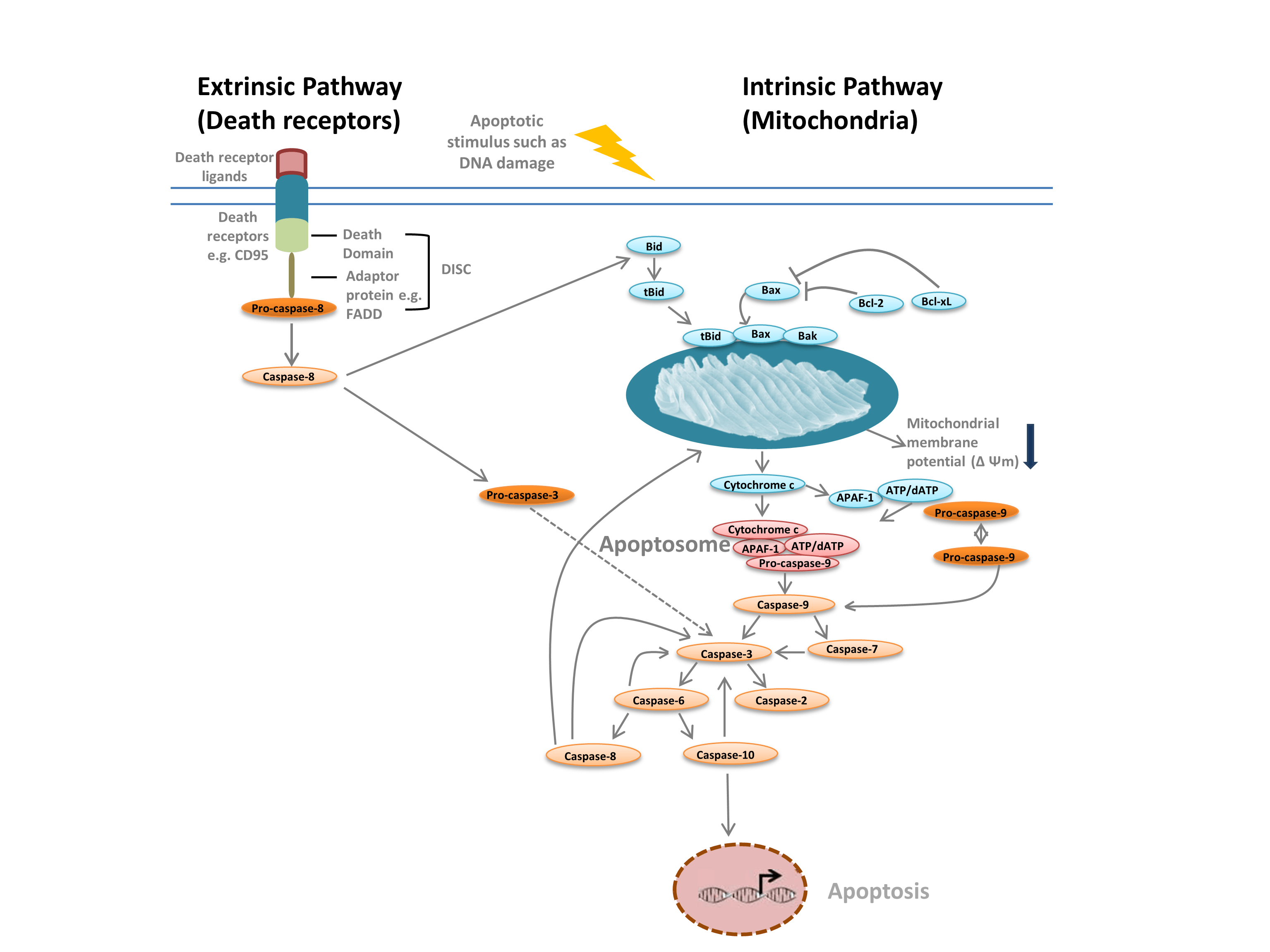
Fig. 1. Apoptosens vägar.
Den extrinsiska vägen utlöses av bindning av ligander till dödsreceptorer. Vid ligandbindning oligomeriseras dödsreceptorer och rekryterar adaptorproteiner som FADD. Detta möjliggör rekrytering av pro-caspase-8, den inaktiva formen av initiatorcaspase-8, och bildandet av det dödsinducerande signalkomplexet (DISC). Pro-caspase-8 oligomeriseras och klyvs till sin aktiva form, caspase-8, som i sin tur klyver och aktiverar effektorn caspase-3. Caspase-3 aktiverar i sin tur proteolytiskt olika andra caspaser, vilket leder till apoptos. I vissa fall kan aktivering av den extrinsiska vägen också leda till aktivering av den intrinsiska vägen, medierad genom Bid.
Apoptos skiljer sig från oprogrammerad celldöd/nekros. Nekros är en oreglerad process som initieras av yttre skada och skiljer sig från apoptos på flera viktiga sätt (tabell 1). I takt med att vi har lärt oss mer om apoptos och nekros och identifierat nya mekanismer för celldöd, t.ex. nekroptos, har dock gränserna mellan apoptos och nekros blivit mer suddiga. De särskiljande egenskaper som beskrivs i tabell 1 är dock fortfarande användbara riktlinjer.
Tabell 1. Egenskaper för apoptos och nekros.
| Apoptos | Nekros |
| Celler krymper | Celler sväller |
| Fagocyter/makrofager slukar celler | Cell. debris frigörs |
| Processen är icke-inflammatorisk | Processen är inflammatorisk |
Det är användbart att dela in denna process i steg när man analyserar apoptos:
- Apoptos inleds och signalkaskader aktiveras
- Celler krymper och rundas av, förmedlat av caspaser
- Organellerna ändrar form och membranen börjar blöda
- Kärnkondensering börjar
- DNA-fragmentering kan observeras
- Apoptotiska kroppar bildas
- Apoptotiska kroppar fagocytoseras
Dessa apoptotiska stadier, tillsammans med de kända mediatorerna för apoptos, kan användas som identifierare av apoptos. När du väljer en apoptosanalys bör du tänka på vilken fråga du vill ställa – caspasaktivitetsanalyser är utmärkta indikatorer på initiering av apoptos medan DNA-fragmenteringsanalyser kan användas för att identifiera celler i de sena stadierna av apoptos, när de är irreversibelt bundna till programmerad celldöd.
När man utför apoptosanalyser är det alltid klokt att inkludera livsduglighetsfärgämnen som propidiumjodid (PI) för att skilja apoptotiska celler från nekrotiska celler och för att visuellt inspektera celler eller vävnader i mikroskopet för att hitta viktiga morfologiska indikatorer på apoptos.
Bedömning av apoptos
1. Morfologiska förändringar
Tidssvarstagning av levande celler kan användas för att följa apoptos i realtid och är särskilt användbar för att identifiera membranblödning. För vävnader kan transmissionselektronmikroskopi användas för att identifiera många av de strukturella förändringar som följer med apoptosstadierna. Vävnader kan också färgas med hematoxylin och eosin för att visualisera makrofager som har slukat apoptotiska celler. Acridine orange (AO) är ett annat färgämne som ofta används för att visualisera apoptotiska celler. Detta populära livsduglighets- och proliferationsfärgämne kan användas för att bedöma apoptos eftersom dess emissionsspektrum skiftar till orange när det befinner sig i den sura lysosom-miljön; detta gör färgämnet användbart för att identifiera uppslukade apoptotiska celler. DNA-bindande färgämnen som DAPI, Hoechst, propidiumjodid (PI) och 7-AAD kan användas för att visualisera kärnblödning, medan cellkrympning kan detekteras antingen i en flödescytometer som en minskning av framåtspridning (FSC) eller visuellt med hjälp av ljusmikroskopi.
2. Förändringar i mitokondriell membranpotential
Förändringar i membranpotentialen indikerar att en cell har passerat ”point of no return” och nu är engagerad i apoptos. En kollaps av mitokondriernas membranpotential kan detekteras genom flödescytometri eller immunofluorescens med hjälp av potentiometriska färgämnen.
Tetrametylrhodaminetylestrar (TMRE), tetrametylrhodaminmetylester (TMRM) och JC-1 är vanligt förekommande potentiometriska färgämnen. TMRE och TMRM aggregeras i mitokondrierna i icke-apoptotiska celler och fluorescerar starkt orange eller rött. I apoptotiska celler med minskad mitokondriell membranpotential finns dessa färgämnen i hela cytoplasman i sin monomera form och visar minskad röd fluorescens. Färgämnena kan användas i kombination med fluoroformärkta testmetoder för caspasinhibitorer (FLICA) (se nästa avsnitt) för att identifiera apoptotiska celler baserat på två egenskaper: nedbrytning av mitokondriernas membranpotential och caspasaktivering (figur 2).
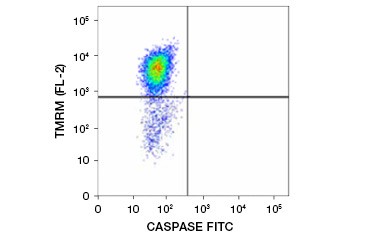
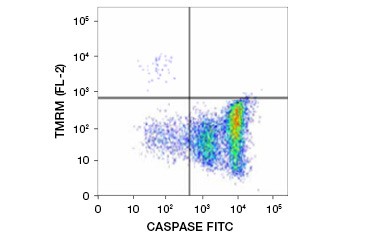
Fig. 2. Detektion av minskning av mitokondriell membranpotential och caspasaktivering med flödescytometri. Simultan förlust av orange fluorescens från TMRM och ökning av grön fluorescens, som visar caspasaktivering mätt med FAM-FLICA Polycaspase Kit, visar apoptotiska celler (nedre högra kvadranten).
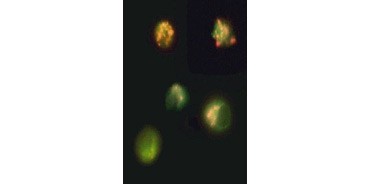
Fig. 3. Nedbrytning av mitokondriernas membranpotential visualiserad med hjälp av JC-1. Jurkat-celler färgades med MitoPT JC-1. Icke-apoptotiska celler (överst) uppvisar rödfärgade mitokondrier medan celler i olika stadier av apoptos uppvisar grön cytoplasmatisk fluorescens.
JC-1 aggregeras också i mitokondrier i ickeapoptotiska celler och återfinns diffunderad i hela cellen i apoptotiska celler. Till skillnad från TMRE och TMRM , som visar minskad fluorescens, ändrar JC-1 färg, från rött till grönt. Detta gör det lätt att skilja mellan ickeapoptotiska röda fluorescerande celler och apoptotiska gröna fluorescerande celler (figur 3). Dessa analyser kan avläsas med hjälp av fluorescensmikroskopi, en flödescytometer eller en lämpligt utrustad mikroplattläsare.
3. Caspaseaktivering
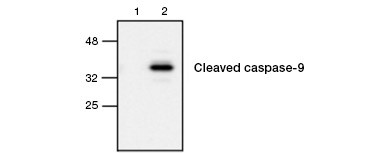
Figur 4. Aktivt caspas-9 påvisas med hjälp av western blot. Western blot-analys av obehandlade (körfält 1) och etoposidbehandlade (körfält 2) celler provad med antikropp mot kanin anti-caspase-9 (aktivt). Aktivt, klyvt caspas-9 påvisas endast vid induktion av apoptos med etoposid.
Caspasaktivering är ett utmärkande kännetecken för apoptos. Vanligt analyserade viktiga apoptotiska caspaser är initiatorcaspaserna 3, 6 och 7 och effektorkaspaserna 2, 8, 9 och 10. Caspasaktivering kan identifieras antingen genom att pro-caspaserna minskar i storlek när de klyvs eller genom att använda antikroppar som endast interagerar med den klyvda, aktiverade formen (figur 4). Båda tillvägagångssätten kan avläsas med hjälp av Western Blotting, medan det senare tillvägagångssättet också kan anpassas för fluorescerande och immunohistokemiska analyser genom att välja antikroppar som är konjugerade med fluorophorer eller biotin. Dessa analyser är kompatibla med både fixerade och ofixerade celler.
En sak som bör hållas i minnet är att initiatorkaspaserna befinner sig långt uppströms i apoptosens signalväg och att deras aktivering inte alltid leder till apoptos. Det är därför klokt att para ihop tester för initiatorkaspaser med tester för effektorkaspaser eller, ännu bättre, med prober för händelser nedströms från point of no return, t.ex. MOMP.
En annan klass av tester för caspasaktivering är fluoroformärkta caspas-substrat, t.ex. FLICA Assays. FLICA Assays binder kovalent och irreversibelt till aktiverade kaspaser; eventuella obundna hämmare diffunderar ut ur cellerna och/eller kan avlägsnas med tvättar. Dessa inhibitorer finns tillgängliga med antingen röda eller gröna färgämnen. Fluorescensintensiteten kan användas som ett kvantitativt mått på caspasaktivitet – apoptotiska celler med hög caspasaktivitet visar mer fluorescens än celler med låg caspasaktivitet. FLICA Assays är kompatibla med levande celler, vävnadssektioner och tunna frysta sektioner, men inte med fixerade celler eller paraffininbäddade vävnader, och kan avläsas genom att kvantifiera fluorescensintensiteten med hjälp av fluorescensmikroskopi, flödescytometri (figur 2) eller en mikroplattavläsare.
För att dra välgrundade slutsatser från caspasaktivitetsanalyser är det alltid klokt att välja mer än en måltavla.
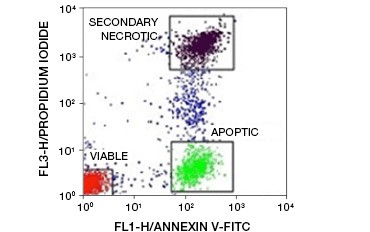
Fig. 5. Annexin-V-konjugat kan användas för att skilja apoptotiska från nekrotiska och livskraftiga celler. Dot-plot som visar Ramos-celler färgade med annexin V:FITC jämfört med propidiumjodid. Tre distinkta populationer kan observeras.
4. Externalisering av fosfatidylserin
En viktig egenskap hos apoptos som kan påvisas även i tidiga stadier är externalisering av fosfatidylserin (PS), en fosfolipid som uteslutande finns i det inre membranet i friska celler. Annexin-V binder fosfatidylserin och annexin-V-konjugat kan därför användas för att bedöma apoptos. Dessa analyser utförs vanligen genom flödescytometri med hjälp av fluoroformärkt annexin-V. Genom att kombinera detta färgämne med ett livsduglighetsfärgämne, t.ex. PI, kan apoptotiska celler skiljas från nekrotiska celler. I dessa tvåfärgade flödescytometriexperiment kan tre populationer lätt särskiljas: annexin-V/PI dubbelnegativa livskraftiga celler, annexin-V-positiva/PI-negativa apoptotiska celler och annexin-V/PI dubbelt positiva sekundära nekrotiska celler
(figur 5).
Phosphatidylserin-externalisering är en dynamisk, reversibel process tills en cell är engagerad i apoptos efter MOMP. Med hjälp av annexin-V-konjugat är det omöjligt att skilja tidiga, reversibla stadier av apoptos från de senare stadierna av apoptos när en cell är bestämd för att dö. Polaritetskänslig indikator för livsduglighet och apoptos (pSIVA) är biosensorer som reversibelt binder PS och därmed tänds och släcks när PS vänder sig från det yttre membranet till det inre membranet (figur 6). En annan fördel med pSIVA-analysen är att pSIVA-sonderna, till skillnad från annexin-V-konjugat, kan tillsättas direkt till dina celler utan tvättsteg. Denna analys kan avläsas med hjälp av immunocytokemi och immunofluorescensmikroskopi, inklusive avbildning av levande celler, vilket gör det möjligt att enkelt jämföra skillnader i apoptosfrekvens som svar på olika experimentella behandlingar i realtid. Eftersom apoptos övervakas i realtid är denna analys inte kompatibel med fixerade celler.
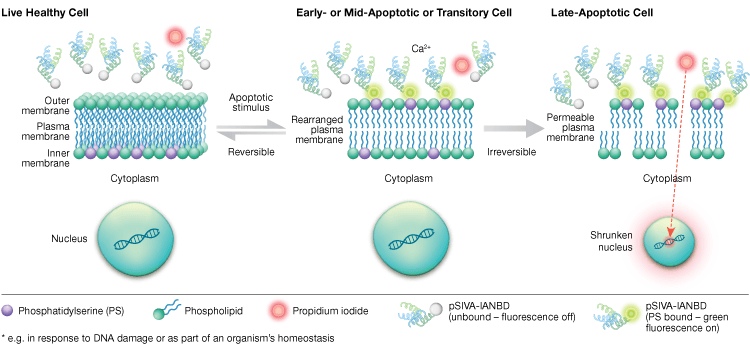
Fig. 6. Med pSIVA-analysen kan man skilja mellan levande, tidigt apoptotiska och sent apoptotiska celler genom att övervaka externalisering och internalisering av fosfatidylserin i realtid.
5. DNA-fragmentering
DNA-fragmentering är ett av de senare stadierna av apoptos och analyseras vanligen genom detektering av DNA-ledare med hjälp av agarosbaserad elektrofores eller terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) metoden.
Ett utmärkande kännetecken för apoptos är fragmentering av DNA i fragment på ~180 bp av caspase-aktiverade endonukleaser. Extraherat genomiskt DNA som körs på en agarosgel kommer därför att visa en karakteristisk DNA-ledning som inte ses i celler som dör genom andra mekanismer, t.ex. nekros.
TUNEL-metoden är ett annat sätt att detektera skapandet av oligonukleosomer genom caspasaktiverat endonukleas. DNA-klyvning resulterar i 3′ hydroxylgrupper (3′-OH-grupper). Vid TUNEL-analysen används enzymet terminal deoxynukleotidyltransferas (TdT) för att lägga till BrdU till dessa 3′-OH-grupper. Inkorporerat BrdU kan sedan detekteras med hjälp av anti-BrdU-antikroppar som är märkta med biotin eller en fluorofor. Denna analys är kompatibel med flödescytometri samt immunohistokemi och immunofluorescens och kan omvandlas till en radiomärkningsanalys genom att använda -TdR i stället för BrdU. Cellerna måste fixeras efter BrdU-inkorporering före färgning.
DNA-fragmentering kan också mätas med flödescytometri med hjälp av sub-G1-analysen. De små, ~180 bp, DNA-fragment som genereras under apoptos läcker ut ur cellerna, vilket minskar det totala DNA-innehållet i apoptotiska celler. Genom att färga DNA med PI kan hypodiploida apoptotiska celler räknas i sub-G1-toppen av PI-histogrammet.
6. Multiplexa apoptosmarkörpaneler
Slutligt säljer många leverantörer paneler för multiplexa immunoassayanalyser av cellpopulationer. Dessa paneler kan analysera flera apoptosmarkörer samtidigt.
Oavsett vilken metod som används för att detektera apoptos måste lämpliga kontroller inkluderas, eftersom experimentella förhållanden och celltyp kan förändra resultatet av vissa analyser. Ta alltid med positiva och negativa kontroller. Inkludera fordonbehandlade kontroller för att ta hänsyn till lösningsmedlens effekter, tillämpningsspecifika kontroller för att kontrollera faktorer som autofluorescens i immunofluorescensförsök och laddningskontroller för Western Blotting.
Tabell 2. Sammanfattning av analyser för att upptäcka kännetecken för apoptos.
| Apoptosstadium | Reagens för att möjliggöra detektion | Användning | |
| PS-flippning | annexin-V-konjugat, pSIVA-prober | Flödescytometri, mikroskopi | |
| Signaleringskaskader initierade | FLICA, caspasantikroppar | Flödescytometri, mikroskopi, western blot | |
| MOMP | TMRM, TMRE, JC-1 | Flödescytometri, mikroskopi, mikroplattavläsare | |
| Cellkrympning | Flödescytometri, mikroskopi | ||
| Membranblödning | hematoxylin + eosin | Mikroskopi | |
| Kärnkondensering | DAPI, Hoechst, PI, 7-AAD | Mikroskopi | |
| DNA-fragmentering | TUNEL, Sub-G1-analys, DNA laddering | Agarosegel, flödescytometri, mikroskopi | |
| Fagocytos av apoptotiska kroppar | Acridinorange, hematoxylin + eosin | Flödescytometri, ljus- och elektronmikroskopi |