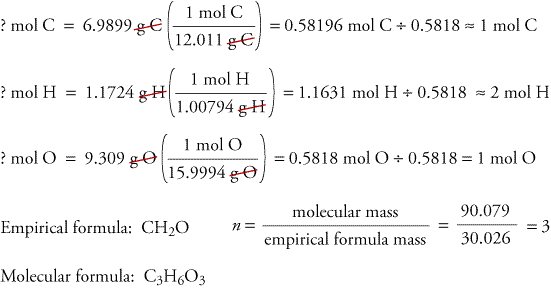Framställning av empiriska och molekylära formler från förbränningsdata
Empiriska och molekylära formler för föreningar som endast innehåller kol och väte (CaHb) eller kol, väte och syre (CaHbOc) kan bestämmas med en process som kallas förbränningsanalys. Stegen för detta förfarande är
Väga ett prov av den förening som ska analyseras och placera det i den apparat som visas i bilden nedan.
Förbränn föreningen helt och hållet. De enda produkterna från förbränningen av en förening som endast innehåller kol och väte (CaHb) eller kol, väte och syre (CaHbOc) är koldioxid och vatten.
H2O och CO2 dras genom två rör. Det ena röret innehåller ett ämne som absorberar vatten och det andra innehåller ett ämne som absorberar koldioxid. Väg vart och ett av dessa rör före och efter förbränningen. Ökningen av massan i det första röret är massan av H2O som bildades vid förbränningen, och ökningen av massan för det andra röret är massan av CO2 som bildades.
Antag att allt kol i föreningen har omvandlats till CO2 och fångats upp i det andra röret. Beräkna massan av kol i föreningen från massan av kol i den uppmätta massan av CO2 som bildas.
Antag att allt väte i föreningen har omvandlats till H2O och fångats in i det första röret. Beräkna massan av väte i föreningen från massan av väte i den uppmätta massan av vatten.
Om föreningen innehåller syre samt kol och väte, beräkna syrets massa genom att subtrahera massan av kol och väte från den totala massan av det ursprungliga provet av föreningen.
Använd dessa data för att bestämma de empiriska och molekylära formlerna på det vanliga sättet.
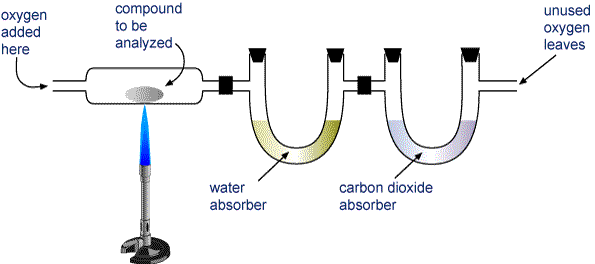
Apparat för förbränningsanalys En förening som innehåller kol och väte (CaHb) eller kol, väte och syre (CaHbOc) förbränns helt och hållet och bildar H2O och CO2. Produkterna dras genom två rör. Det första röret absorberar vatten och det andra röret absorberar koldioxid.
För att illustrera hur empiriska och molekylära formler kan bestämmas från data som härrör från förbränningsanalys, låt oss betrakta en substans som kallas trioxan. Formaldehyd, CH2O, är instabil som ren gas och bildar lätt en blandning av ett ämne som kallas trioxan och en polymer som kallas paraformaldehyd. Det är därför som formaldehyd löses upp i ett lösningsmedel, t.ex. vatten, innan det säljs och används. Molekylformeln för trioxan, som innehåller kol, väte och syre, kan bestämmas med hjälp av data från två olika experiment. I det första experimentet förbränns 17,471 g trioxan i den apparat som visas ovan, och 10,477 g H2O och 25,612 gCO2 bildas. I det andra experimentet konstateras att trioxans molekylmassa är 90,079.
Vi kan få fram denmolekylära formeln för en förening från dess empiriska formel och dess molekylära massa. (Se texten för en påminnelse om hur detta görs.) För att få fram den empiriska formeln måste vi bestämma massan i gram av kol, väte och syre i 17,471 g trioxan. Vi måste alltså utföra dessa allmänna steg.
För det första, konvertera från de givna uppgifterna till gram kol, väte och syre.
För det andra, bestäm den empiriska formeln från gram kol, väte och syre.
För det tredje, bestäm den molekylära formeln från den empiriska formeln och den givna molekylmassan.
Då vi antar att allt kol i trioxan har reagerat till koldioxid, kan vi hitta kolmassan i 17,471 g trioxan genom att beräkna kolmassan i 25,612 g koldioxid.

Då vi antar att allt väte i trioxan har reagerat för att bilda H2O,kan vi hitta massan av väte i 17,471 g trioxan genom att beräkna massan av väte i 10.477 g H2O.

Då trioxan endast innehåller kol, väte och syre, kan vi beräkna syrets massa genom att subtrahera massorna av kol och väte från trioxans totala massa.
? g O = 17,471 g trioxan – 6,9899 g C – 1,1724 g H = 9.309 g O
Vi beräknar nu den empiriska formeln, den empiriska formelns massa och molekylformeln.
ExempelStudieblad: Du vill beräkna molekylformeln för en förening som endast innehåller kol och väte (CaHb) eller kol, väte och syre (CaHbOc), och du har fått dess molekylära massa och massorna av CO2 och H2O som bildas vid förbränning av en given massa av föreningen.
Allmänt förfarande
Beräkna antalet gram kol i föreningen genom att beräkna antalet gram kol i den givna mängden koldioxid.

Beräkna antalet gram väte i föreningen genom att beräkna antalet gram väte i den givna mängden H2O.

Om föreningen innehåller syre, beräkna antalet gram syre i den genom att subtrahera massorna av kol och väte från den givna totala massan av föreningen.
? g O = (givet) g totalt – (beräknat) g C – (beräknat) g H
Beräkna föreningens empiriska formel utifrån grammen kol, väte och syre.
Beräkna formelmassan för den empiriska formeln och dividera den givna molekylmassan med den empiriska formelmassan för att få n.
Multiplicera var och en av de nedanstående tecknen i den empiriska formeln med n för att få fram molekylformeln.
EXEMPEL – Att få fram en molekylformel frånförbränningsdata:
Dianabol är en av de anabola steroiderna som har använts av vissa idrottare för att öka storleken och styrkan på sina muskler. Det liknar det manliga hormonet testosteron. Vissa studier visar att de önskade effekterna av läkemedlet är minimala, och biverkningarna, som inkluderar sterilitet och ökad risk för levercancer och hjärtsjukdomar, hindrar de flesta människor från att använda det. Dianabol:s molekylformel, som består av kol, väte och syre, kan bestämmas med hjälp av data från två olika experiment. I det första experimentet förbränns 14,765 g Dianabol och det bildas 43,257 g CO2 och 12,395 g H2O. I det andra experimentet visar det sig att Dianabol har en molekylmassa på 300,44. Vad är molekylformeln för Dianabol?
Lösning: