Molecular Chaperones
Molekylära chaperoner består av ett brett spektrum av proteiner som spelar en viktig roll i cellulär homeostas och som är ansvariga för att hjälpa till med proteinveckningen, sammansättning av multimera proteiner, translokation av proteiner inom och mellan celler, nedbrytning av oönskade eller felveckade proteiner under normala cellulära processer och stabilisering av proteiner genom att förhindra aggregering och hjälpa till med återveckning under stressförhållanden (Lindquist, 1986); Lindquist och Craig, 1988).
Proteiner som rapporterats ha chaperonaktivitet upptäcktes ursprungligen som sådana som överuttrycktes under värmeschock och benämndes därför som värmeschockproteiner (Hsp). Förutom värmeschock är det också känt att andra stressförhållanden, t.ex. kol-, kväve- eller fosfatbegränsande förhållanden, inducerar molekylära chaperoner. Dessa proteiner klassificeras enligt sin molekylvikt i fem huvudfamiljer: (a) Hsp100-familjen, (b) Hsp90-familjen, (c) Hsp70-familjen, (d) Hsp60-familjen och (e) familjen små värmeschockproteiner (sHsp) (Bohen et al., 1995; Schirmer et al., 1996; Bukau och Horwich, 1998). Chaperonerna klassificeras också utifrån deras verkningssätt i: (a) Foldaser, Chaperoner som hjälper till att återveckla oveckade proteiner med hjälp av ATP, t.ex. Hsp70 och Hsp60, b) Holdaser, Chaperoner som binder veckningsintermediärer och förhindrar aggregering, t.ex. sHsp och Hsp40, och c) Disaggregeringar, Chaperoner som aktivt sönderdelar skadliga proteinaggregat, vilket kan leda till att de blir små fragment, t.ex. medlemmar av AAA + ATPase superfamiljen och Hsp100. Denna typ av klassificering gäller med få undantag (Richter et al., 2010; Kim et al., 2013). En stor del av vår förståelse av mekanismerna för chaperonassisterad proteinveckning har härletts från arbetet med chaperonfamiljerna Hsp60 och Hsp70. Denna översikt fokuserar på Hsp60-klassen av molekylära chaperoner och lyfter fram Hsp60 med atypisk struktur och funktion.
Hsp60-familjen/Hsp60-familjen/Chaperoniner
De 60 kDa stora chaperonerna bildar stora oligomeriska ringar och kallas också för chaperoniner. Chaperoniner kan vidare underklassificeras i två grupper på grundval av kravet på co-chaperoniner och deras cellplacering. Chaperoniner av typ I finns i cytoplasman hos prokaryoter och i mitokondrien och kloroplasten hos eukaryoter. De behöver hjälp av co-chaperonin, dvs. Hsp10, som fungerar som ett lock på ringen. Det välstuderade chaperoninet av typ I är känt som GroEL-GroES-systemet i Escherichia coli. Dess homologer är Cpn60/Cpn20 i kloroplaster och mtHsp60/mtHsp10 i mitokondrier (Cheng et al., 1989; Hayer-Hartl et al., 1995; Dickson et al., 2000). Chaperoniner av typ II finns i cytoplasman hos eukaryoter och i arkebakteriella mikroorganismer. De har ett inbyggt lock och behöver därför inga co-chaperoniner för sin funktion (Ranson et al., 1998). Exempel på chaperoniner av typ II är det eukaryota TriC/CCT-maskineriet (TCP-1 ringkomplexet/chaperonin innehållande TCP-1-komplexet), som består av åtta subenheter, och termosomen i arkeabakterier. Till skillnad från typ I-chaperoniner kräver substratoberoende fångst av typ II-chaperoniner hjälp av prefoldin och Hsp70-homologer (Iizuka et al., 2004; Cuéllar et al., 2008). Nyligen rapporterades en tredje grupp som kallas typ III-chaperoniner och som strukturellt liknar typ II-chaperoniner men som mekaniskt och fylogenetiskt skiljer sig från både typ I- och typ II-chaperoniner, t.ex. Carboxydothermus hydrogenoformans chaperonin (Ch-CPN) (Techtmann och Robb, 2010; An et al., 2017; figur 1). Chaperoninerna av typ I, II och III kallas också för chaperoniner av grupp I, II och III.
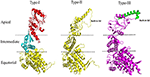
Figur 1. Strukturella egenskaper hos chaperoniner av typ I, typ II och typ III. Den jämförande strukturanalysen av chaperoniner av typ I, typ II och typ III. Strukturerna hämtades från RCSB med koderna PDB: 1AON, 3RUW respektive 5X9U. Chaperonin av typ I är indelat i apikala, intermediära och ekvatoriala domäner, vars motsvarande regioner visas i chaperoniner av typ II och III med hjälp av streckade linjer. Chaperonin av typ II har ett karakteristiskt inbyggt lock i strukturen som spelar rollen som co-chaperonin GroES för chaperonin av typ I. Chaperoniner av typ III liknar strukturellt chaperoniner av typ II i fråga om inbyggt lock. Låsets sekvens, struktur och funktion är dock olika i typ II- och typ III-chaperoniner (An et al., 2017). Programmet PyMOL (PyMOL Molecular Graphics System, version 1.3) användes för att generera denna figur.
Structure-Function of Type I Chaperonins: Prokaryotic Cytosol
E. coli GroEL-GroES
Strukturella och funktionella studier av E. coli GroEL har visat att den bildar en tetradecamerisk struktur som består av två heptameriska ringar som är staplade på varandra och bildar en kavitet, som ändrar sin karaktär från att vara huvudsakligen hydrofob till hydrofil när den binder GroES. Föjning av substratprotein sker i detta hålrum med hjälp av co-chaperonin GroES, som är en kapselliknande heptamerisk struktur (Mande et al., 1996). Varje GroES-monomer har en storlek på 10 kDa. GroEL-monomeren är indelad i tre domäner, nämligen den apikala, intermediära och ekvatoriella domänen. Varje monomer är ~57 kDa stor.
Det finns två modeller föreslagna för den GroEL-GroES-medierade substratproteinveckningen. Asymmetrisk/sekventiell modell, som är allmänt accepterad. I denna modell förekommer GroEL och GroES stökiometriskt i förhållandet 2:1 (förhållandet 14:7 underenheter). I den andra modellen som kallas den symmetriska/simultana modellen, som bygger på det nyligen observerade GroEL-GroES-komplexet, är GroEL:s båda ringar täckta av co-chaperonin GroES i det stökiometriska förhållandet 1:1, dvs. (GroEL-GroES)2, och underenhetsförhållandet 14:14 (Sameshima et al., 2008; Ye och Lorimer, 2013; Fei et al., 2014). Symmetriska (GroEL-GroES)2-komplex har observerats både i närvaro och frånvaro av substratprotein, vilket tyder på ett övergående mellanliggande tillstånd i veckningsreaktionscykeln.
Struktur-funktion hos Chaperoniner av typ I: Endosymbiotiska organeller
Kloroplast- och mitokondriella Chaperoniner
Kloroplast-chaperoninerna benämns vanligen som Cpn60 (GroEL-homologer) och Cpn10 (GroES-homologer). Cpn60-chaperoninerna består av flera underenheter som är divergerade i två besläktade men distinkta α- och β-typer (Dickson et al., 2000; Hill och Hemmingsen, 2001). I motsats till bakteriella chaperoniner, som innehåller flera underenheter och föredrar homo-oligomerisering (Ojha et al., 2005; Gould et al., 2007), bildar kloroplastchaperoniner hetero-oligomerer med sina två typer av chaperonin α och β-underenheter. Heterogenitet finns också i co-chaperoninstrukturen. Cpn10 liknar standardco-chaperonin och bildar en heptamerisk enkelring av 10 kDa-underenheter (Koumoto et al., 2001; Sharkia et al., 2003). Cpn20 har två Cpn10-liknande polypeptidsekvenser som är sammanfogade i tandem. Den renade Cpn20 existerar som en tetramer ringliknande struktur som innehåller 20 kDa underenhet. Den är fullt funktionell in vitro och hjälper till att återforma denaturerat protein i närvaro av både kloroplast Cpn60 och E. coli GroEL (Tang et al., 2006). Dessutom hjälper Chlamydomonas reinhardtii Cpn10 GroEL endast i närvaro av Cpn20 (Tsai et al., 2012). Således finns det en betydande heterogenitet i den oligomeriska sammansättningen av kloroplastchaperoniner.
Den mänskliga mitokondriella chaperonin, mtHsp60, är känd för att ha en proteinveckningsmekanism (mitokondriellt protein) som skiljer sig från GroEL-GroES-systemet och kräver en enda heptamerisk ring för att utföra sin proteinveckningsfunktion tillsammans med sin co-chaperonin, mtHsp10 (Viitanen et al., 1992; Nielsen och Cowan, 1998). Kristallstrukturen av mitokondriellt chaperonin i komplex med sitt co-chaperonin, mtHsp60-mtHsp10, visar dock ett unikt mellanstadium där mtHsp60-mtHsp10 bildar en symmetrisk fotbollsliknande struktur med dubbla ringar, (mtHsp60)14 + 2 (mtHsp10)7.
Typ I Chaperoniner: Icke-kanoniska egenskaper
Multipla Chaperoniner inom olika arter
En analys av fullständigt sekvenserade genomer tyder på att cirka 30 % av alla genomiska sekvensdata har flera kopior av gensekvenser som kodar för chaperoniner (Lund, 2009; Kumar et al, 2015). Fördelningen av dessa multipla chaperoniner baserat på omfattande fylogenetisk analys tyder på att multipla kopior av chaperoningener förekommer främst i fem fylor, nämligen (a) fylum Actinobacteria, (b) fylum Firmicutes, (c) fylum Cyanobacteria, (d) fylum Chlamydia och (e) α-Proteobacteria phylum (Kumar et al, 2015).
Aktinobakterier
Aktinobakterier är grampositiva bakterier och har ett högt G + C-innehåll i sina genomer, t.ex. Mycobacterium tuberculosis, Mycobacterium leprae och Bifidobacterium longum. Dessa arter har vanligtvis två kopior av chaperoningener, där en av kopiorna finns i en operonliknande struktur. Den andra kopian av Cpn60 existerar som en oberoende gen utan närvaro av Cpn10-genen (Rinke de Wit et al., 1992). De aktinobakteriella chaperonin-generna står under reglerande kontroll av transkriptionsfaktorn HrcA som binder till uppströms CIRCE-sekvensen (controlling inverted repeat of chaperone expression) (Duchêne et al., 1994; Grandvalet et al., 1998). I vissa fall förmedlas regleringen genom att transkriptionsfaktorn HspR binder till uppströms HAIR-sekvensen (HspR Associated Inverted Repeat) (Barreiro et al., 2004).
Firmicutes
Firmicutes är grampositiva bakterier och besitter ett lågt G + C-innehåll i sina genomer, t.ex. Staphylococcus aureus, Desulfitobacterium dehalogenans och C. hydrogenoformans. Firmicutes är kända för att ha både prokaryotiska typ I-gener för chaperonin och arkaeliska gener för chaperonin som klassificeras som typ III-chaperonin. Typ I-chaperoniner är arrangerade i ett operoniskt arrangemang med co-chaperonin, medan typ III-chaperoningenen är placerad i dnaK-operonet. Både typ 1 och typ III chaperonin generna regleras av HrcA transkriptionsfaktor (Techtmann och Robb, 2010).
Chlamydiae
Chlamydiae är mestadels obligata intracellulära patogener, t.ex. Chlamydia trachomatis, Chlamydia pneumonia och Chlamydia psittaci. Chlamydia-arter har tre kopior av chaperoningener (McNally och Fares, 2007). Operoniskt arrangemang tyder på att endast en kopia av chaperoningenenerna existerar tillsammans med dess co-chaperonin. Andra chaperoningener är dock lokaliserade separat. Regleringen av klamydiens chaperoningener är komplex. Den första kopian av chaperoningenen induceras av värmeschock och regleras av HrcA-CIRCE-systemet. Den andra kopian av chaperoningenen induceras när Chlamydia befinner sig i monocyter eller makrofager (Kol et al., 1999) och den tredje kopian av chaperoningenen induceras när Chlamydia befinner sig i Hep-2-celler (Gérard et al., 2004). Sådana typer av uttryck och reglering av chaperoningener tyder på livscykelspecifika mönster och oberoende funktionella roller för dem.
α-proteobakterier
Rhizobia, som tillhör klassen α-proteobakterier, är symbiotiska organismer som lever i förening med baljväxter i rotknölarna och är involverade i kvävefixering, t.ex. Bradyrhizobium japonicum, Rhizobium leguminosarum. Rhizobier innehåller flest kopior av chaperoniner. B. japonicum har sju kopior av chaperoningener (Fischer et al., 1993). R. leguminosarum är en välkaraktäriserad organism och har tre kopior av chaperoningener. Genarrangemanget i alla dessa organismer tyder på att de tre kopiorna av chaperoningenen bildar separata operoner med sina respektive co-chaperoningener (George et al., 2004). En av chaperoninoperonerna är belägen på den genomiska ö som innehåller gener som är involverade i kvävefixering. Det regleras av NiF-faktorer som reglerar kvävefixeringsgener (Ogawa och Long, 1995). Den andra kopian av chaperoningenen är inte välstuderad och är känd för att vara involverad i chaperonegenskapen hos flera modellsubstratproteiner (George et al., 2004).
Cyanobakterier
Cyanobakterier är till stor del fotosyntetiska bakterier, t.ex. Synechococcus platensis, Prochlorococcus marinus och Anabaena variabilis. Ungefär 90 % av genomsekvenserna hos cyanobakteriearterna innehåller två kopior av chaperoningener där en av dem är arrangerad på en operon medan den andra chaperoningenen kodas separat. Vissa cyanobakteriearter innehåller tre kopior av chaperoningener, där två av dess chaperoningener är placerade tillsammans med respektive co-chaperoniner i operonet medan den tredje kopian av chaperoningener är oberoende (Lund, 2009; Kumar et al., 2015). Chaperoningener som finns i operoniskt arrangemang med sina co-chaperoniner är essentiella gener medan de som finns oberoende av co-chaperonin är icke-essentiella (Sato et al., 2008). De två cyanobakteriella chaperoningenerna regleras positivt av RpoH och negativt av HrcA-proteiner. Vid värmeschock induceras en av chaperoningenerna snabbt medan den andra chaperoningenen induceras gradvis (Kojima och Nakamoto, 2007; Rajaram och Apte, 2010). Den chaperonin-gen som induceras gradvis vid värmeschock är känd för att vara direkt involverad i fotosyntesen.
Evolutionär linje
I takt med att fler genomiska sekvenser blir tillgängliga tyder analysen av chaperonin-gener på att distributionen och frekvensen av multipla kopior av chaperonin-gener i olika fyler och organismer fortsätter att öka (Lund, 2009; Kumar et al., 2015). För att förstå orsaken till mångfalden av chaperoningener är antingen på grund av horisontell genöverföring eller genduplikation utfördes fylogenetisk analys av GroEL-proteiner över arter, vilket avslöjade att orsakerna till förekomsten av flera kopior av GroEL inte är enhetliga. I ett fåtal fall förekommer genduplicering följt av evolutionärt urval, vilket observerades i myxobakteriella GroELs, mykobakteriella första och andra kopior av GroEL och ett fåtal rhizobiella GroELs. När det gäller den tredje mykobakteriella GroEL-homologen, några få rhizobiella GroEL och metanosarcinala GroEL förekom horisontell genöverföring (Goyal et al., 2006; Kumar et al., 2015).
Det har tidigare föreslagits i vårt labb att mykobakteriella GroEL har duplicerats och genomgått olika selektiva tryck för att utföra distinkta strukturella och funktionella roller under evolutionens gång (Goyal et al., 2006). Biofysiska och biokemiska studier på rekombinant renade GroELs från M. tuberculosis har visat att GroEL1 och GroEL2 existerar som lägre oligomeriska arter i motsats till den tetradekameriska GroEL-strukturen hos E. coli (Qamra et al., 2004). Kristallstrukturen av M. tuberculosis GroEL2 i sin dimeriska form belyste närvaron av distinkta rester vid gränssnittsregionen, som troligen är ansvariga för förändringen i oligomeriseringen (figur 2; Qamra och Mande, 2004). Studier av genombyte och domänbytesstudier på M. tuberculosis GroEL1 tyder på att den ekvatoriala domänen är ansvarig för den misslyckade oligomeriseringen. Den apikala domänen tål stora insättningar och deletioner (Kumar et al., 2009). Ungefär samtidigt visades att GroEL1 har utvecklats för att promiskuöst binda nukleinsyror (Basu et al., 2009) och att oligomerisering underlättas av fosforylering av serinrester (Kumar et al., 2009). Eftersom GroEL2 är känd för att vara ett essentiellt chaperonin i mykobakterier, medan den oligomeriska sammansättningen av GroEL1 regleras posttranslationellt, rapporterades det att tetradekamerisk sammansättning och exakt kommunikation mellan domänerna är en förutsättning för chaperoninaktivitet (Chilukoti et al., 2015).
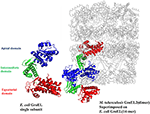
Figur 2. Kristallstrukturen för M. tuberculosis GroEL2 överlagrad på E. coli GroEL-ES struktur. Strukturen av M. tuberculosis GroEL2 (PDB ID:1SJP) visar lägre oligomerisk status (dimer). Färgade i blått, grönt och rött är den apikala, intermediära respektive ekvatoriella domänen. Jämfört med E. coli GroEL (PDB ID: 1AON), som visas i grå färg, förmedlas intersubenheternas interaktion genom den apikala domänen i M. tuberculosis GroEL2-strukturen medan intersubenheternas interaktion sker genom den ekvatoriala domänen i E. coli GroEL. En enda underenhet av M. tuberculosis GroEL2 är anpassad till E. coli GroES-bunden GroEL-ring som representerar en asymmetrisk modell. GroES-strukturen har tagits bort för enkelhetens skull. En enda underenhet av E. coli GroEL har visats med samma färgkodade domäner jämfört med M. tuberculosis GroEL2 för jämförande analys. Programmet PyMOL (PyMOL Molecular Graphics System, version 1.3) användes för att generera denna figur.
Funktionell mångfald
Det är viktigt att undersöka om närvaron av flera kopior av chaperoniner är ansvariga för att de beter sig som kanoniska chaperoniner eller om de har divergerat för att utföra nya funktioner. Det är också viktigt att notera om dessa multipla chaperoniner verkar på gemensamma substrat eller på skilda pooler av substrat. GroEL är mycket konserverade hos olika arter och det har visats att homologer av chaperoniner från andra bakterier kan fungera i E. coli, vilket tyder på att substratproteinerna överlappar varandra och att GroEL-funktionen har en gemensam mekanism. Interaktionerna mellan substratproteiner och GroEL är hydrofoba till sin natur, så konformationsförändringar som medierar exponering av de apikala och ekvatoriala domänerna i kaviteten spelar en nyckelroll vid substratigenkänning och underlättar proteinveckningen. Bindning av substratproteiner till GroEL sker genom α/β-domäner av proteiner utan sekvenslikhet (Kerner et al., 2005; Kumar och Mande, 2011) och ytterligare studier tyder på att GroEL selektivt binder globulära substrat snarare än förlängda polypeptider (Robinson et al., 1994; Goldberg et al., 1997). Flera kopior av chaperoniner i en organism har också rapporterats ha utvecklats för att utföra nya funktioner. GroEL-homologen i en insektssymbiont, Xenorhabdus nematophila, har visat sig vara giftig för insekter, vilket förmedlas genom bindning till alfa-chitin. Mutationsanalys av dessa GroEL-homologer tyder på att den aminosyra som är kritisk för denna typ av aktivitet skiljer sig från den essentiella chaperoninen (Joshi et al., 2008). I M. tuberculosis fungerar GroEL2 som en generalistisk chaperonin (Hu et al., 2008) medan GroEL1 rapporteras vara associerad med nukleoider (Basu et al., 2009). Således är det uppenbart att genduplicering av groEL-gener har lett till den funktionella mångfalden av chaperoniner och/eller distinkt substratspektrum för intracellulär proteinveckning.
Posttranslationella modifieringar/Biofilmsbildning
Posttranslationella modifieringar i proteiner används av organismer för att modulera sina fysiologiska processer och anpassa sig till en ständigt föränderlig miljö (Bernal et al., 2014). Chaperoniner har rapporterats vara posttranslationellt modifierade i vissa organismer, och denna modifiering har rapporterats leda till vinst/förlust av deras funktion. Till exempel har fraktionering av M. tuberculosis cellysat visat att tetradekammarform av GroEL1 uppnås endast vid fosforylering vid serinrester (Kumar et al., 2009). På samma sätt har det i en annan rapport visats att fosforylering sker vid treoninrester (Canova et al., 2009). Båda dessa observationer tyder på att oligomerisering av GroEL1 är ett resultat av posttranslationell modifiering.
Många patogener undviker det medfödda immunförsvaret och blir resistenta mot antibiotika genom att bilda biofilmer på epitelceller (Hall-Stoodley och Stoodley, 2005). GroEL:s roll i biofilmsbildningen har belysts i ett fåtal organismer. Till exempel misslyckas GroEL1-mutant av M. smegmatis med att bilda biofilm. Mekanistiska studier visade att M. smegmatis GroEL1 interagerar med enzymet KasA, som är kritiskt för biosyntesen av mykolsyra som är involverad i biofilmsbildningen (Ojha et al., 2005). Intressant nog har det nyligen rapporterats att GroEL i den patogena stammen B. anthracis fosforyleras och därmed modulerar biofilmsbildningen. Dessa fynd belyser att fosforylering av GroEL har funktionella implikationer (Arora et al., 2017). Acetylering är en annan posttranslationell modifiering som förknippas med E. coli- och M. tuberculosis-chaperoniner, men en funktionell roll har ännu inte tillskrivits denna modifiering (Liu et al., 2014). På samma sätt genomgår mitokondriellt co-chaperonin (mtHsp10) acetylmodifiering och kontrollerar veckningen av mitokondriella proteiner under förhållanden med överskott av näringsämnen (Lu et al., 2015).
C-terminal mångfald
Flera studier lyfter fram betydelsen av GroEL:s C-terminala rester för chaperoninets övergripande funktion (Tang et al., 2006; Chen et al., 2013). I de fall som avser flera kopior av chaperoniner har de olika mönster av C-terminala rester. Medan GroEL:s C-terminus (från E. coli) har ett motiv med 13 rester (GGM)4M, har GroEL-homologer från andra organismer (som innehåller flera kopior av chaperoniner) distinkta C-terminala motiv, t.ex.:
a) Histidinrik C-terminal, t.ex. mykobakterier (Colaco och MacDougall, 2014)
b) Mönsterslös C-terminal, t.ex, Rhizobia (George et al., 2004)
c) Liknande (GGM)4M-upprepningar, t.ex. Myxobacteria (Wang et al., 2013)
d) Avsaknad av GGM-liknande svans, t.ex. Methanosarcina (Figueiredo et al., 2004)
Det framgår tydligt att många chaperoninparaloger i olika organismer har GGM-liknande C-terminus. Ett brett spektrum av genomisk organisation ses hos dessa chaperoniner. Dessutom ses också skillnader i deras samexpression med andra chaperoniner och i deras funktioners väsentlighet. Dessa paraloger observeras alltså på ett förbryllande sätt vara antingen viktiga eller oviktiga, samuttryckta med sin co-chaperonin eller inte samuttryckta, och fungerar möjligen som hushålls-chaperoniner. Å andra sidan har chaperoniner som inte har GGM-liknande C-terminus möjligen utvecklats för att utföra nya funktioner (Ojha et al., 2005; Wang et al., 2013; figur 3).

Figur 3. Flera chaperoniner i bakterier som uppvisar mångfald vid C-terminalen. Sekvensanpassning som markerar C-terminala regioner hos de representativa bakteriella GroEL-homologerna med E. coli GroEL. De sista C-terminala resterna av utvalda GroELs i olika bakterier avviker från det kanoniska (GGM)4M-motivet hos E. coli GroEL som visas i den streckade röda rutan. Sekvenserna hämtades från www.uniprot.org och anpassades i MEGA6 med hjälp av MUSCLE-algoritmen (www.megasoftware.net). Formateringen av de anpassade sekvenserna gjordes i Jalview alignment viewer (www.jalview.org). Rester i anpassningen följer standard Clustal-färgschemat i Jalview.
Slutsatser
Typ I chaperoniner är viktiga genom sin roll i den intracellulära proteinveckningen. GroEL-GroES-systemet i bakterier hjälper till att vika cirka 10-15 % av cytosoliska proteiner. Olika strukturer av GroEL som lösts i apo-form, nukleotidbunden form samt i komplex med co-chaperonin GroES försöker förklara dessa chaperonins roll i proteinveckningen (Saibil et al., 2013). Förekomsten av flera chaperoniner och deras roll i olika funktioner tyder på ett evolutionärt tryck mot anpassning till olika miljöförhållanden. Strukturen hos M. tuberculosis GroEL2 belyser ett lägre oligomeriskt tillstånd och mer exponerade hydrofoba ytor, troligen för att öka substratpoolen och energihushållningen (Qamra och Mande, 2004; Qamra et al., 2004; Kumar och Mande, 2011). På grund av närvaron av en histidinrik C-terminal i flera chaperoniner har dessa föreslagits bidra till alternativa biologiska funktioner. M. smegmatis GroEL1 som binder till järn kan bidra till biofilmsbildning (Ojha et al., 2005). Överlevnadsdefekt hos M. tuberculosis groEL1 knockout-stam under förhållanden med låg lufttillförsel kan bidra till syreavkänning genom att direkt binda till metaller eller hjälpa vissa metallproteiner att veckas (Sharma et al., 2016). Strukturen hos andra homologa chaperoninproteiner kommer troligen att besvara den myriad av frågor som är förknippade med de nya funktionerna hos chaperoninhomologer.
Författarbidrag
Alla författare som anges har gjort ett väsentligt, direkt och intellektuellt bidrag till arbetet, och godkänt det för publicering.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
MYA tackar för det ekonomiska stödet för Senior Research Fellowship från Department of Biotechnology (DBT), Ministry of Science and Technology, Government of India. Författarna vill tacksamt tacka för det ekonomiska stödet till arbetet i SCM-laboratoriet genom bidragen BT/PR15450/COE/34/46/2016 och BT/PR3260/BRB/10/967/2011 från DBT.
An, Y. J., Rowland, S. E., Na, J. H., Spigolon, D., Hong, S. K., Yoon, Y. J., et al. (2017). Strukturell och mekanistisk karakterisering av en arkeal-liknande chaperonin från en termofil bakterie. Nat. Commun. 8:827. doi: 10.1038/s41467-017-00980-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Arora, G., Sajid, A., Virmani, R., Singhal, A., Kumar, C. M. S., Dhasmana, N., et al. (2017). Ser/Thr-proteinkinas PrkC-medierad reglering av GroEL är kritisk för biofilmsbildning i Bacillus anthracis. NPJ Biofilms Microbiomes 3:7. doi: 10.1038/s41522-017-0015-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Barreiro, C., González-Lavado, E., Pátek, M. och Martín, J. F. (2004). Transkriptionsanalys av generna groES-groEL1, groEL2 och dnaK i Corynebacterium glutamicum: karakterisering av värmeschockinducerade promotorer. J. Bacteriol. 186, 4813-4817. doi: 10.1128/JB.186.14.4813-4817.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Basu, D., Khare, G., Singh, S., Tyagi, A., Khosla, S. och Mande, S. C. (2009). Ett nytt nukleoidassocierat protein från Mycobacterium tuberculosis är en sekvenshomolog till GroEL. Nucleic Acids Res. 37, 4944-4954. doi: 10.1093/nar/gkp502
PubMed Abstract | CrossRef Full Text | Google Scholar
Bernal, V., Castaño-Cerezo, S., Gallego-Jara, J., Écija-Conesa, A., de Diego, T., Iborra, J. L., et al. (2014). Reglering av bakteriell fysiologi genom lysinacetylering av proteiner. N. Biotechnol. 31, 586-595. doi: 10.1016/j.nbt.2014.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohen, S. P., Kralli, A. och Yamamoto, K. R. (1995). Hold ’em and fold’ em: chaperoner och signaltransduktion. Science 268, 1303-1304.
PubMed Abstract | Google Scholar
Bukau, B., and Horwich, A. L. (1998). Chaperonmaskinerna Hsp70 och Hsp60. Cell 92, 351-366. doi: 10.1016/S0092-8674(00)80928-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Canova, M. J., Kremer, L. och Molle, V. (2009). Mycobacterium tuberculosis GroEL1-chaperonet är ett substrat för Ser/Thr-proteinkinaser. J. Bacteriol. 191, 2876-2883. doi: 10.1128/JB.01569-08
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, D. H., Madan, D., Weaver, J., Lin, Z., Schröder, G. F., Chiu, W., et al. (2013). Visualisering av GroEL/ES när den kapslar in ett vikande protein. Cell 153, 1354-1365. doi: 10.1016/j.cell.2013.04.052
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, M. Y., Hartl, F. U., Martin, J., Pollock, R. A., Kalousek, F., Neupert, W., et al. (1989). Mitokondriellt heat-shock-protein hsp60 är nödvändigt för sammansättning av proteiner som importeras till jästmitokondrier. Nature 337, 620-625. doi: 10.1038/337620a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Chilukoti, N., Kumar, C. M., and Mande, S. C. (2015). GroEL2 från Mycobacterium tuberculosis avslöjar betydelsen av strukturell smidighet i chaperoninfunktionen. J. Bacteriol. 198, 486-497. doi: 10.1128/JB.00844-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Colaco, C. A., and MacDougall, A. (2014). Mykobakteriella chaperoniner: svansen viftar med hunden. FEMS Microbiol. Lett. 350, 20-24. doi: 10.1111/1574-6968.12276
PubMed Abstract | CrossRef Full Text | Google Scholar
Cuéllar, J., Martín-Benito, J., Scheres, S. H., Sousa, R., Moro, F., López-Viñas, E., et al. (2008). Strukturen av CCT-Hsc70 NBD tyder på en mekanism för Hsp70:s leverans av substrat till chaperoninet. Nat. Struct. Mol. Biol. 15, 858-864. doi: 10.1038/nsmb.1464
PubMed Abstract | CrossRef Full Text | Google Scholar
Dickson, R., Weiss, C., Howard, R. J., Alldrick, S. P., Ellis, R. J., Lorimer, G., et al. (2000). Rekonstruktion av högre växters kloroplast chaperonin 60 tetradecamers som är aktiva vid proteinveckning. J. Biol. Chem. 275, 11829-11835. doi: 10.1074/jbc.275.16.11829
PubMed Abstract | CrossRef Full Text | Google Scholar
Duchêne, A. M., Thompson, C. J. och Mazodier, P. (1994). Transkriptionsanalys av groEL-gener i Streptomyces coelicolor A3(2). Mol. Gen. Genet. 245, 61-68. doi: 10.1007/BF00279751
PubMed Abstract | CrossRef Full Text | Google Scholar
Fei, X., Ye, X., LaRonde, N. A., and Lorimer, G. H. (2014). Bildning och strukturer av GroEL:GroES2-chaperoninfotbollarna, den funktionella formen för proteinveckning. Proc. Natl. Acad. Sci. U.S.A. 111, 12775-12780. doi: 10.1073/pnas.1412922111
PubMed Abstract | CrossRef Full Text | Google Scholar
Figueiredo, L., Klunker, D., Ang, D., Naylor, D. J., Kerner, M. J., Georgopoulos, C., et al. (2004). Funktionell karakterisering av ett arkealiskt GroEL/GroES-chaperoninsystem: betydelsen av substratinkapsling. J. Biol. Chem. 279, 1090-1099. doi: 10.1074/jbc.M310914200
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischer, H. M., Babst, M., Kaspar, T., Acuña, G., Arigoni, F. och Hennecke, H. (1993). En medlem av en gro-ESL-liknande chaperoninmultigenfamilj i Bradyrhizobium japonicum samregleras med gener för symbiotisk kvävefixering. EMBO J. 12, 2901-2912.
PubMed Abstract | Google Scholar
George, R., Kelly, S. M., Price, N. C., Erbse, A., Fisher, M. och Lund, P. A. (2004). Tre GroEL-homologer från Rhizobium leguminosarum har olika in vitro-egenskaper. Biochem. Biophys. Res. Commun. 324, 822-828. doi: 10.1016/j.bbrc.2004.09.140
PubMed Abstract | CrossRef Full Text | Google Scholar
Gérard, H. C., Whittum-Hudson, J. A., Schumacher, H. R. och Hudson, A. P. (2004). Differentiellt uttryck av tre Chlamydia trachomatis hsp60-kodande gener i aktiva vs. persisterande infektioner. Microb. Pathog. 36, 35-39. doi: 10.1016/j.micpath.2003.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberg, M. S., Zhang, J., Sondek, S., Matthews, C. R., Fox, R. O. och Horwich, A. L. (1997). Nativliknande struktur av en proteinveckningsintermediär som är bunden till chaperonin GroEL. Proc. Natl. Acad. Sci. U.S.A. 94, 1080-1085. doi: 10.1073/pnas.94.4.1080
PubMed Abstract | CrossRef Full Text | Google Scholar
Gould, P. S., Burgar, H. R. och Lund, P. A. (2007). Homologa cpn60-gener i Rhizobium leguminosarum är inte funktionellt likvärdiga. Cell Stress Chaperones 12, 123-131. doi: 10.1379/CSC-227R.1
CrossRef Full Text | Google Scholar
Goyal, K., Qamra, R. och Mande, S. C. (2006). Multipel genduplikation och snabb evolution i groEL-genen: funktionella implikationer. J. Mol. Evol. 63, 781-787. doi: 10.1007/s00239-006-0037-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Grandvalet, C., Rapoport, G., and Mazodier, P. (1998). hrcA, som kodar för repressorn av groEL-gener i Streptomyces albus G, är associerad med en andra dnaJ-gen. J. Bacteriol. 180, 5129-5134.
Google Scholar
Hall-Stoodley, L. och Stoodley, P. (2005). Biofilmsbildning och spridning och överföring av humanpatogener. Trends Microbiol. 13, 7-10. doi: 10.1016/j.tim.2004.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Hayer-Hartl, M. K., Martin, J. och Hartl, F. U. (1995). Asymmetrisk interaktion mellan GroEL och GroES i ATPase-cykeln för assisterad proteinveckning. Science 269, 836-841. doi: 10.1126/science.7638601
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, J. E., and Hemmingsen, S. M. (2001). Arabidopsis thaliana typ I och II chaperoniner. Cell Stress Chaperones 6, 190-200. doi: 10.1379/1466-1268(2001)006<0190:ATTIAI>2.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Hu, Y., Henderson, B., Lund, P. A., Tormay, P., Ahmed, M. T., Gurcha, S. S., et al. (2008). En Mycobacterium tuberculosis-mutant som saknar groEL-homologen cpn60.1 är livskraftig men kan inte framkalla ett inflammatoriskt svar i djurmodeller av infektion. Infect. Immun. 76, 1535-1546. doi: 10.1128/IAI.01078-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Iizuka, R., So, S., Inobe, T., Yoshida, T., Zako, T., Kuwajima, K., et al. (2004). Den spiralformade utskjutningens roll i konformationsförändringen och den molekylära chaperonaktiviteten hos det arkealiska grupp II-chaperoninet. J. Biol. Chem. 279, 18834-18839. doi: 10.1074/jbc.M400839200
PubMed Abstract | CrossRef Full Text | Google Scholar
Joshi, M. C., Sharma, A., Kant, S., Birah, A., Gupta, G. P., Khan, S. R., et al. (2008). Ett insekticidalt GroEL-protein med kitinbindande aktivitet från Xenorhabdus nematophila. J. Biol. Chem. 283, 28287-28296. doi: 10.1074/jbc.M804416200
PubMed Abstract | CrossRef Full Text | Google Scholar
Kerner, M. J., Naylor, D. J., Ishihama, Y., Maier, T., Chang, H. C., Stines, A. P., et al. (2005). Proteomövergripande analys av chaperoninberoende proteinveckning i Escherichia coli. Cell 122, 209-220. doi: 10.1016/j.cell.2005.05.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, Y. E., Hipp, M. S., Bracher, A., Hayer-Hartl, M. och Hartl, F. U. (2013). Molekylära chaperonfunktioner i proteinveckning och proteostasis. Annu. Rev. Biochem. 82, 323-355. doi: 10.1146/annurev-biochem-060208-092442
PubMed Abstract | CrossRef Full Text | Google Scholar
Kojima, K., and Nakamoto, H. (2007). En ny ljus- och värmeresponsiv reglering av groE-transkriptionen i avsaknad av HrcA eller CIRCE i cyanobakterier. FEBS Lett. 581, 1871-1880. doi: 10.1016/j.febslet.2007.03.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Kol, A., Bourcier, T., Lichtman, A. H. och Libby, P. (1999). Chlamydial och humant värmeschockprotein 60s aktiverar humant vaskulärt endotel, glatta muskelceller och makrofager. J. Clin. Invest. 103, 571-577. doi: 10.1172/JCI5310
PubMed Abstract | CrossRef Full Text | Google Scholar
Koumoto, Y., Shimada, T., Kondo, M., Hara-Nishimura, I. och Nishimura, M. (2001). Kloroplaster har en ny Cpn10 utöver Cpn20 som co-chaperoniner i Arabidopsis thaliana. J. Biol. Chem. 276, 29688-29694. doi: 10.1074/jbc.M102330200
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumar, C. M., Khare, G., Srikanth, C. V., Tyagi, A. K., Sardesai, A. A. och Mande, S. C. (2009). Underlättad oligomerisering av mykobakteriella GroEL: bevis för fosforyleringsmedierad oligomerisering. J. Bacteriol. 191, 6525-6538. doi: 10.1128/JB.00652-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumar, S., and Mande, S. (2011). Protein chaperones and non-protein substrates: on substrate promiscuity of GroEL. Curr. Sci. 100, 1646-1653.
Google Scholar
Kumar, C. M., Mande, S. C. och Mahajan, G. (2015). Flera chaperoniner i bakterier-novella funktioner och icke-kanoniska beteenden. Cell Stress Chaperones 20, 555-574. doi: 10.1007/s12192-015-0598-8
CrossRef Full Text | Google Scholar
Lindquist, S. (1986). Värmeskocksresponsen. Annu. Rev. Biochem. 55, 1151-1191. doi: 10.1146/annurev.bi.55.070186.005443
PubMed Abstract | CrossRef Full Text | Google Scholar
Lindquist, S., and Craig, E. A. (1988). Värmeschockproteinerna. Annu. Rev. Genet. 22, 631-677. doi: 10.1146/annurev.ge.22.120188.003215
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, F., Yang, M., Wang, X., Yang, S., Gu, J., Zhou, J., et al. (2014). Acetylomanalys avslöjar olika funktioner för lysinacetylering i Mycobacterium tuberculosis. Mol. Cell. Proteomics 13, 3352-3366. doi: 10.1074/mcp.M114.041962
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, Z., Chen, Y., Aponte, A. M., Battaglia, V., Gucek, M. och Sack, M. N. (2015). Långvarig fasta identifierar värmechockprotein 10 som ett Sirtuin 3-substrat som belyser en ny mekanism som kopplar mitokondriell proteinacetylering till fettsyraoxidationsenzymets veckning och funktion. J. Biol. Chem. 290, 2466-2476. doi: 10.1074/jbc.M114.606228
PubMed Abstract | CrossRef Full Text | Google Scholar
Lund, P. A. (2009). Flera chaperoniner i bakterier – varför så många? FEMS Microbiol. Rev. 33, 785-800. doi: 10.1111/j.1574-6976.2009.00178.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Mande, S. C., Mehra, V., Bloom, B. R. och Hol, W. G. (1996). Struktur av värmeschockproteinet chaperonin-10 från Mycobacterium leprae. Science 271, 203-207. doi: 10.1126/science.271.5246.203
PubMed Abstract | CrossRef Full Text | Google Scholar
McNally, D., and Fares, M. A. (2007). In silico identifiering av funktionell divergens mellan de flera groEL-genparalogerna i Chlamydiae. BMC Evol. Biol. 7:81. doi: 10.1186/1471-2148-7-81
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, K. L., and Cowan, N. J. (1998). En enda ring är tillräcklig för produktiv chaperoninmedierad veckning in vivo. Mol. Cell 2, 93-99. doi: 10.1016/S1097-2765(00)80117-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Ogawa, J. och Long, S. R. (1995). Rhizobium meliloti groELc locus krävs för reglering av tidiga nodgener av transkriptionsaktivatorn NodD. Genes Dev. 9, 714-729. doi: 10.1101/gad.9.6.714
PubMed Abstract | CrossRef Full Text | Google Scholar
Ojha, A., Anand, M., Bhatt, A., Kremer, L., Jacobs, W. R. och Hatfull, G. F. (2005). GroEL1: en dedikerad chaperon som är involverad i biosyntesen av mykolsyra under biofilmsbildning hos mykobakterier. Cell 123, 861-873. doi: 10.1016/j.cell.2005.09.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Qamra, R., and Mande, S. C. (2004). Kristallstruktur av det 65-kilodaltoniga värmechockproteinet, chaperonin 60.2, från Mycobacterium tuberculosis. J. Bacteriol. 186, 8105-8113. doi: 10.1128/JB.186.23.8105-8113.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Qamra, R., Srinivas, V. och Mande, S. C. (2004). Mycobacterium tuberculosis GroEL-homologer existerar ovanligt nog som lägre oligomerer och behåller förmågan att undertrycka aggregering av substratproteiner. J. Mol. Biol. 342, 605-617. doi: 10.1016/j.jmb.2004.07.066
PubMed Abstract | CrossRef Full Text | Google Scholar
Rajaram, H. och Apte, S. K. (2010). Differentiell reglering av groESL-operonuttryck som svar på värme och ljus i Anabaena. Arch. Microbiol. 192, 729-738. doi: 10.1007/s00203-010-0601-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ranson, N. A., White, H. E. och Saibil, H. R. (1998). Chaperoniner. Biochem. J. 333(Pt 2), 233-242. doi: 10.1042/bj3330233
PubMed Abstract | CrossRef Full Text | Google Scholar
Richter, K., Haslbeck, M. och Buchner, J. (2010). Värmeschockreaktionen: liv på gränsen till döden. Mol. Cell 40, 253-266. doi: 10.1016/j.molcel.2010.10.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Rinke de Wit, T. F., Bekelie, S., Osland, A., Miko, T. L., Hermans, P. W., van Soolingen, D., et al. (1992). Mycobakterier innehåller två groEL-gener: den andra Mycobacterium leprae groEL-genen är arrangerad i en operon med groES. Mol. Microbiol. 6, 1995-2007. doi: 10.1111/j.1365-2958.1992.tb01372.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Robinson, C. V., Gross, M., Eyles, S. J., Ewbank, J. J., Mayhew, M., Hartl, F. U., et al. (1994). Konformationen hos GroEL-bundet alfa-laktalbumin undersökt med masspektrometri. Nature 372, 646-651. doi: 10.1038/372646a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Saibil, H. R., Fenton, W. A., Clare, D. K., and Horwich, A. L. (2013). Struktur och allosteri hos chaperonin GroEL. J. Mol. Biol. 425, 1476-1487. doi: 10.1016/j.jmb.2012.11.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Sameshima, T., Ueno, T., Iizuka, R., Ishii, N., Terada, N., Okabe, K., et al. (2008). Fotbolls- och kulaformade GroEL-GroES-komplex samexisterar under reaktionscykeln. J. Biol. Chem. 283, 23765-23773. doi: 10.1074/jbc.M802541200
PubMed Abstract | CrossRef Full Text | Google Scholar
Sato, S., Ikeuchi, M. och Nakamoto, H. (2008). Uttryck och funktion av en groEL-paralog i den termofila cyanobakterien Thermosynechococcus elongatus under värme- och köldstress. FEBS Lett. 582, 3389-3395. doi: 10.1016/j.febslet.2008.08.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Schirmer, E. C., Glover, J. R., Singer, M. A. och Lindquist, S. (1996). HSP100/Clp-proteiner: en gemensam mekanism förklarar olika funktioner. Trends Biochem. Sci. 21, 289-296. doi: 10.1016/S0968-0004(96)10038-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharkia, R., Bonshtien, A. L., Mizrahi, I., Weiss, C., Niv, A., Lustig, A., et al. (2003). Om det oligomeriska tillståndet hos kloroplastchaperonin 10 och chaperonin 20. Biochim. Biophys. Acta 1651, 76-84. doi: 10.1016/S1570-9639(03)00237-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharma, A., Rustad, T., Mahajan, G., Kumar, A., Rao, K. V., Banerjee, S., et al. (2016). Mot en förståelse av den biologiska funktionen hos den ovanliga chaperonin Cpn60.1 (GroEL1) från Mycobacterium tuberculosis. Tuberc. Edinb. Scotl. 97, 137-146. doi: 10.1016/j.tube.2015.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Tang, Y. C., Chang, H. C., Roeben, A., Wischnewski, D., Wischnewski, N., Kerner, M. J., et al. (2006). Strukturella egenskaper hos GroEL-GroES-nanoburen som krävs för snabb veckning av det inkapslade proteinet. Cell 125, 903-914. doi: 10.1016/j.cell.2006.04.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Techtmann, S. M., and Robb, F. T. (2010). Archaeal-liknande chaperoniner i bakterier. Proc. Natl. Acad. Sci. U.S.A. 107, 20269-20274. doi: 10.1073/pnas.1004783107
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsai, Y. C., Mueller-Cajar, O., Saschenbrecker, S., Hartl, F. U., and Hayer-Hartl, M. (2012). Chaperoninkofaktorer, Cpn10 och Cpn20, från gröna alger och växter fungerar som hetero-oligomeriska ringkomplex. J. Biol. Chem. 287, 20471-20481. doi: 10.1074/jbc.M112.365411
PubMed Abstract | CrossRef Full Text | Google Scholar
Viitanen, P. V., Lorimer, G. H., Seetharam, R., Gupta, R. S., Oppenheim, J., Thomas, J. O., et al. (1992). Däggdjurens mitokondriella chaperonin 60 fungerar som en enda toroidal ring. J. Biol. Chem. 267, 695-698.
PubMed Abstract | Google Scholar
Wang, Y., Zhang, W. Y., Zhang, Z., Z., Li, J., Li, Z. F., Tan, Z. G., et al. (2013). Mekanismer som är involverade i den funktionella divergensen av duplicerade GroEL-chaperoniner i Myxococcus xanthus DK1622. PLoS Genet. 9:e1003306. doi: 10.1371/journal.pgen.1003306
PubMed Abstract | CrossRef Full Text | Google Scholar
Ye, X., and Lorimer, G. H. (2013). Substratprotein växlar GroE-chaperoniner från asymmetrisk till symmetrisk cykling genom att katalysera nukleotidutbyte. Proc. Natl. Acad. Sci. U.S.A. 110, E4289-E4297. doi: 10.1073/pnas.1317702110
PubMed Abstract | CrossRef Full Text | Google Scholar