Introduktion
Charofyter eller basala streptofyter; (Becker och Marin, 2009; Leliaert et al.., 2012) utgör ett varierat taxonomiskt sortiment av existerande grönalger i sötvatten och på land som uppvisar ett brett spektrum av encelliga, filamentösa och ”parenkymatösa” former (Graham, 1993; Lewis och McCourt, 2004). En stamtavla av charofyter uppstod och koloniserade land för 450-500 miljoner år sedan. Dessa organismer anpassade sig till terrestra förhållanden, blev kapabla att överleva och föröka sig när de var helt exponerade för atmosfären, och vissa medlemmar utvecklades slutligen till landväxter (Zhong et al., 2013; Delwiche och Cooper, 2015). Denna ”terrestrialisering” av gröna växter utgjorde en viktig biologisk händelse som för alltid förändrade planetens biogeokemi och naturhistoria. Den efterföljande spridningen av landväxter förändrade atmosfäriska och ytterligare förändrade markförhållanden och möjliggjorde uppkomsten av andra olika livsformer på land. Utvecklingen av landväxter förändrade också mänsklighetens historia, framför allt genom jordbrukets innovation och den moderna mänskliga civilisationens skapande som en följd av detta. Delvis på grund av deras evolutionära betydelse har charofyter fått stor uppmärksamhet av växtbiologer under de senaste decennierna (Pickett-Heaps och Marchant, 1972; Pickett-Heaps, 1975; Mattox och Stewart, 1984; Becker och Marin, 2009; Harholt et al., 2016). I takt med att ytterligare nya uppgifter har samlats in om dessa algers biologi har de dock blivit viktiga modeller för att förstå grundläggande fenomen inom biokemi, cellbiologi, utvecklingsbiologi, ekologi och i allt högre grad molekylärbiologi (Delwiche och Cooper, 2015; Lemieux et al., 2016). Serien Frontiers in Plant Science om ”Charophytes” illustrerar betydelsen av dessa organismer inom flera specifika områden av växtbiologisk forskning. Den här minirecensionen lyfter fram charofyternas egenskaper som modellorganismer inom olika forskningsområden. Den kommer också förhoppningsvis att uppmuntra en ny generation forskare att utöka användningen av dessa alger i grundforskningen och att inleda screening av andra taxa som i sin tur kan leda till identifiering och användning av nya modellcharofyter.
The ”Line-Up” of Charophytes
Under 1970- och 1980-talen har ultrastrukturella (t.ex, celldelningsmekanism, flagellapparatens understruktur) och biokemiska data (t.ex. enzymprofiler) var de viktigaste kriterierna för att inkludera en grönalg i charofytlinjen (Mattox och Stewart, 1984; Lewis och McCourt, 2004; Leliaert et al., 2012). Från 1990-talet till idag har studier med fokus på molekylära analyser av kloroplast- och kärngenom och transkriptom bekräftat och förfinat tidigare taxonomiska och fylogenetiska scheman (Timme et al., 2012; Delwiche och Cooper, 2015). Detta har ytterligare kompletterats av detaljerade biokemiska, immunologiska och cellbiologiskt baserade analyser av charofytens cellväggar och hormonbiosyntetiska och signalvägar (Popper och Fry, 2003; Popper, 2008; Sørensen et al., 2010, 2011, 2012; Zhang och van Duijn, 2014; Ju et al., 2015; O’Rourke et al., 2015). Existerande charofyter uppvisar en relativt låg procentuell mångfald i jämförelse med andra grönalgtaxa och omfattar 13 familjer och 122 släkten (Becker och Marin, 2009; Leliaert et al., 2012). Enligt nuvarande fylogenetiska uppfattning placeras charofyterna i sex klasser (figur 1; Delwiche och Cooper, 2015). Den basala klassen, Mesostigmatophyceae, representeras av ett enda känt släkte, Mesostigma. Denna alg är en encellig biflagellat med en unik asymmetrisk form (dvs. som en tillplattad livbåt) och är täckt av lager av ornamentalt utformade fjäll (Manton och Ettl, 1965; Becker et al., 1991; Domozych et al., 1991, 1992). Den andra klassen, Chlorokybophyceae, består också av en enda känd typ, Chlorokybus atmophyticus. Denna sällsynta alg bildar ett sarkinoid paket av celler som omges av ett tjockt gelliknande hölje (Rogers et al., 1980). Det bör noteras att alternativa fylogenier placerar Mesostigma och Chlorokybus som systerlinjer som tillsammans är syster till alla andra streptofyter (Rodríguez-Ezpeleta et al., 2007). I den sexklassiga fylogenin består den tredje klassen, Klebsormidiophyceae, av tre släkten som bildar enkla oförgrenade trådar (Sluiman et al., 2008) som ofta ingår i ”biologiska skorpor” som växer på ytor i olika landmiljöer. Flera arter i denna klass kan till och med motstå betydande uttorkningsstress när de ingår i ökenskorpor (Mikhailyuk et al., 2008, 2014; Holzinger och Karsten, 2013); andra är toleranta mot uttorkningsstress som är förknippad med miljöer med låga temperaturer (Stamenkovic et al., 2014; Herburger och Holzinger, 2015). Dessa tre första klasser utgör de ”tidigt divergerande” charofyterna. Den ”sent divergerande” linjen omfattar också tre klasser. Charophyceae, eller stenväxter, är vanligt förekommande i sötvattensekosystem och har makroskopiska flercelliga taljor som består av aggregationer av förgrenade filament som består av exceptionellt långsträckta celler (Lewis och McCourt, 2004). Medlemmar av denna grupp uppvisar oogamy-baserad sexuell reproduktion som innefattar rörliga spermier och icke-rörliga ägg som båda produceras i flercelliga gametangier. Coleochaetophyceae består av taxa som har flercelliga taljor gjorda av förgrenade filamentösa eller parenkymliknande taljor (Graham, 1993; Delwiche et al., 2002). Dessa organismer uppvisar också en distinkt oogamy-baserad sexuell reproduktion. Coleochaetophyceae finns vanligtvis i gränssnittet mellan sötvatten och terrestra livsmiljöer, ofta som epifyter. Slutligen består den största och mest diversifierade gruppen av charofyter, Zygnematophyceae, av encelliga och oförgrenade filament (Gontcharov et al., 2003; Guiry, 2013). Det utmärkande för denna grupp är förekomsten av konjugationsbaserad sexuell reproduktion som kräver komplex cell-cell-signalering och adhesion (Abe et al., 2016). De zygnematofyceana algerna är vanliga invånare i sötvattensmiljöer, som ibland förekommer i spektakulära efemära blomningar, samt i fuktiga terrestra substrat.

FIGUR 1. Förekommande charofyter. Existerande charofyter delas in i tidiga och sent divergerande taxa. De tidigt divergerande taxa inkluderar Mesostigmatophyceae, Chlorokybophyceae och Klebsormidiophyceae och de sent divergerande taxa inkluderar Charophyceae, Coleochaetophyceae och Zygnematophyceae. Representanter för varje grupp är Mesostigma (Mesostigmatophyceae), Chlorokybus atmophyticus (Chlorokybophyceae), Klebsormidium flaccidum (Klebsormidiophyceae), Chara (Charophyceae), Coleochaete scutata (Coleochaetophyceae) och Micrasterias (Zygnematophyceae).
Charofyter som modellorganismer
Vissa charofyter har använts i stor utsträckning som modellorganismer vid studier av grundläggande biologiska processer. Deras små och enkla taljor (dvs. jämfört med landväxter) och lätthet vid experimentell manipulation är bara två av de egenskaper som gör dem till attraktiva modellorganismer. Nya bevis har också visat att många charofyter har flera anmärkningsvärt liknande egenskaper som landväxter, inklusive förekomsten av biosyntetiska vägar för många tillväxtregulatorer (figur 2; Boot et al., 2012; Hori et al., 2014; Wang et al., 2014, 2015; Holzinger och Becker, 2015; Ju et al., 2015) och flera cellväggspolymerer (Popper, 2008; Sørensen et al., 2010, 2011, 2012; Mikkelsen et al., 2014). Dessa två egenskaper har gjort charofyter effektiva inom sådana studieområden som växternas molekylära utveckling och stressfysiologi. Även om många charofyter har använts i ett brett spektrum av biologiska studier är följande taxa mest anmärkningsvärda för sin omfattande användning som modeller inom flera studieområden:
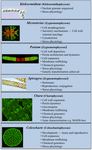
FIGUR 2. Nuvarande modell Charophytes. Flera charofyter, däribland Klebsormidium, Micrasterias, Penium, Spirogyra, Chara och Coleochaete, används som modeller; var och en av dem har specifika egenskaper som gör den till en särskilt lämplig modell för specifika fysiologiska och biokemiska processer.
Desmider: De symmetriska modellerna
Zygnematophyceae har nyligen visat sig vara de troligaste levande förfäderna till landväxter (Wodniok et al, 2011; Delwiche och Cooper, 2015). Encelliga medlemmar av den inkluderande placoderm desmidgruppen har blivit viktiga modeller för att belysa många grundläggande principer för växternas cellbiologi och utveckling. Stor cellstorlek, anmärkningsvärd symmetri/form, distinkt cellväggsarkitektur och utarbetade endomembran-/cytoskelettsystem är bara några av de egenskaper som gör dem till utmärkta cellsystem för att studera cellfysiologi och utveckling. Den senaste tidens etablering av stabila transformerade linjer och de snart sekvenserade genomerna/transkriptomerna av utvalda desmider har ytterligare ökat deras värde för botaniska studier. Två taxa, Micrasterias och Penium, har framstått som de mest välstuderade av desmiderna.
Micrasterias har varit den mest populära desmiden för cellbiologisk forskning under de senaste 50 åren på grund av sina unika egenskaper (Meindl, 1993; Lutz-Meindl, 2016). Micrasterias-cellen uppvisar en bilateral symmetri som ofta framhävs av en spektakulärt dissekerad (dvs. multilobad) periferi. Nya dotterhalvceller som produceras genom celldelning har inte denna komplexa morfologi utan är snarare sfäriska till formen. Ett komplext postcytokinetiskt utvecklingsprogram som använder sig av flera uppsättningar mycket samordnade subcellulära mekanismer genererar därefter den multilobiga fenotypen under dotterhalvcellsexpansionen. Detta program är också ansvarigt för att polymerer avsätts för att producera både en primär och en sekundär cellvägg. Dessa händelser är centrerade kring ett stort nätverk av Golgikroppar och tillhörande vesiklar som ger en komplex sekretorisk mekanism. Denna process är i sin tur inriktad på specifika platser på cellytan som genererar en multipolär celexpansion och den samtidiga utsöndringen av cellväggsmakromolekyler och extracellulärt slem (Kim et al., 1996; Lutz-Meindl och Brosch-Salomon, 2000; Oertel et al., 2004; Aichinger och Lutz-Meindl, 2005). Leveransen av sekretoriska komponenter till exakta cellytelokaler kräver ett utarbetat aktinomyosinbaserat cytomotilsystem och styrs av flera signaltransduktionskaskader (Meindl et al., 1994; Oertel et al., 2003). Dessutom är cellmorfogenesen mycket känslig för extern stress (t.ex. oxidativ stress, salthalt, tungmetaller) som leder till stora förändringar i celldifferentieringen (Darehshouri et al., 2008; Affenzeller et al., 2009; Andosch et al., 2012). Micrasterias är en enastående organism för att analysera dessa subcellulära egenskaper eftersom den är lätt att underhålla och manipulera i laboratoriet och den lämpar sig särskilt väl för förvärv av högupplösta bilder med hjälp av ljus- och elektronmikroskopi, inklusive immunocytokemi, FIB-SEM (Focused Ion Beam-Scanning Electron Microscopy) och EELS (Electron Energy Loss Spectroscopy) bildframställning (Lutz-Meindl, 2007; Eder och Lutz-Meindl, 2008, 2010; Wanner et al., 2013; Lutz-Meindl et al., 2015). Dessutom har inledande molekylära analyser, inklusive produktion av transformerade cellinjer, ytterligare förbättrat användningen av Micrasterias, särskilt när det gäller den molekylära dynamiken för cellväggsbearbetning (Vannerum et al., 2010, 2011, 2012).
Under det senaste decenniet har desmiden Penium margaritaceum också blivit en värdefull modellorganism (Domozych et al., 2009, 2014; Sørensen et al., 2014; Rydahl et al., 2015; Worden et al., 2015). Till skillnad från Micrasterias har Penium en enkel cylindrisk form, har endast en primär cellvägg och deponerar väggpolymerer på två specifika platser på cellytan under expansionen (Domozych et al., 2011). Denna relativa enkelhet är mycket attraktiv för att belysa grundläggande principer för växternas cellutveckling, inklusive cellväggsutveckling, celexpansion och sekretionsdynamik (Domozych et al., 2005, 2014; Ochs et al., 2014). En av dess viktigaste egenskaper är att den har väggpolymerer som liknar dem som finns i många landväxter (t.ex. cellulosa, pektiner, hemicelluloser) och att dessa polymerer kan märkas med monoklonala antikroppar. Efter märkning av levande celler kan dessa återföras till kultur där efterföljande celexpansion och väggavlagringshändelser kan övervakas (Domozych et al., 2009; Rydahl et al., 2015). Penium är också lätt att upprätthålla i laboratoriet och dess snabba tillväxthastighet under exakt kontrollerade förhållanden gör den till ett utmärkt prov för storskaliga samtidiga mikroarray-screeningar av många kemiska agenser (genom tillväxt i flerbrunnsplattor) och för bedömning av deras specifika effekter på expansion/väggutveckling (Worden et al., 2015). Detta underlättar avsevärt för att avslöja rollen för specifika subcellulära komponenter och processer i expansionen/differentieringen. Nyligen har isoleringen av stabila transformerade linjer (Sørensen et al., 2014) ytterligare ökat potentialen hos denna alg i framtida växtcellsstudier.
Chara och Nitella: Cellulära jättar för växtfysiologi
Arter av Chara och Nitella (Charophyceae) har länge använts som exemplar för en rad olika biologiska undersökningar, särskilt de som handlar om celldynamik, expansion och cytoplasmatisk strömning (Green, 1954; Probine och Preston, 1962). Deras makroskopiska thalli kännetecknas av noder, där grenar och gametangier uppstår, och internodala regioner som består av exceptionellt långsträckta celler. Internodala celler uppvisar en tydligt märkbar skiktning av subcellulära komponenter där spiralformade kloroplaster definierar en stationär cortex som omger en endoplasma där den snabbast registrerade aktinomyosin-genererade cytoplasmiska strömningen sker. Cytoplasman innehåller olika endomembrankomponenter som deltar i dynamiska nätverk för membrantrafik (t.ex. endocytos och exocytos) som styrs av komplexa signaltransduktionskaskader (Foissner och Wastenys, 2000, 2012, 2014; Sommer et al., 2015; Foissner et al., 2016). De internodala cellerna har cellväggar som är rika på cellulosa och pektinet homogalacturonan (HG). Turgor är den huvudsakliga drivkraften för expansion och pektin är sannolikt den lastbärande komponent som kontrollerar väggens expansion. Cyklisk, icke-enzymatisk modulering och samtidig kalciumkomplexering av HG är den mekanism som ansvarar för att kontrollera väggmodulationer som leder till celexpansion (Proseus och Boyer, 2007, 2008, 2012; Boyer, 2016). En av de tekniska fördelarna med Chara och Nitella i cellulär forskning är att internodala celler kan avlägsnas individuellt; endoplasma och cellväggar kan ”dissekeras ut” och sedan användas som acellulära system för experimentell manipulation.
Andra thalluskomponenter som rhizoider har en organiserad polär organisation av cytoplasman. Dessa celler innehåller sedimenterbara, mineralrika statoliter belägna vid spetsen som fungerar i gravitationsuppfattningen (Hodick et al., 1998; Braun, 2002; Braun och Limbach, 2006). Denna egenskap har gjort Chara till den första charofyten i rymden. Under TEXUS-raketens paraboliska flygningar visade det sig att statoliterna utövar spänningskrafter på aktinfilamenten. En balans av krafter (dvs. gravitationen och den motverkande kraften från aktinfilamenten) är ansvarig för att statoliterna är korrekt placerade i rhizoiden, vilket i sin tur garanterar förmågan att reagera på gravitationsvektorn (Braun och Limbach, 2006). Användningen av laserpincetter och mikroskopi med långsamt roterande centrifuger har visat att sedimentering av statoliter inte är tillräcklig för att orsaka gravitropisk böjning av rhizoidspetsen. Snarare måste de mineralrika statoliterna sätta sig på specifika områden av plasmamembranet för att gravitropiska morfologiska effekter ska kunna fortsätta (Braun, 2002). Chara har också använts för att studera andra fenomen, bland annat elektrofysiologi och hormoners roll och rörelse (Belby, 2016).
Coleochaete för utvecklingsstudier och mönsterutveckling
För att bilda ett flercelligt thallus (dvs. vävnad, organ) hos en växt krävs exakta, rumsligt reglerade celldelningsplaner som styrs av flera uppsättningar av gener som uttrycks vid specifika punkter under utvecklingen (Besson och Dumais, 2011; Umen, 2014). Thallus morfogenes, som styrs både i tredimensionellt rum och tid, moduleras också som svar på externa stressfaktorer. I växter görs dessa utvecklingsprogram ännu mer komplexa genom förekomsten av cellväggar som inte tillåter cellmigration eller vävnadsflexibilitet. Det är ofta svårt att klarlägga vilka specifika händelser som är centrala för manifestationen av thallusform och storlek i landväxter där upplösningen av specifika cellbeteenden ofta är dåligt upplösta när de är inbäddade i mycket komplexa och expansiva vävnader/organismer. Det har varit fördelaktigt att använda organismer med enklare thallusdesign för att förstå grundläggande utvecklingsfenomen, och charofytsläktet Coleochaete är ett sådant exempel. Vissa arter (t.ex. C. orbicularis, C. scutatum) producerar en parenkymatös discoid thallus som växer utåt genom en kombination av anti- eller peri-klinala celldelningar och efterföljande expansion av de yttersta cellerna (Brown et al., 1994; Cook, 2004). Divisionsplanet för varje cell följer enkla regler som baseras på cellstorlek, cellform och geografiskt läge i thallus (Dupuy et al., 2010; Besson och Dumais, 2011). Denna egenskap gör det möjligt att konstruera matematiska modeller som sedan kan användas för att tolka flercellig morfogenes (Domozych och Domozych, 2014; Umen, 2014) och ge kritisk insikt i evolutionen, biomekaniken och fysiologin hos organ och hela organismer. Dessutom har vissa Coleochaete-arter studerats ingående för att fastställa de strukturella och funktionella modulationer som sker i ett thallus under uttorkningsförhållanden (Graham et al., 2012), dvs. viktiga funktioner för att förstå den tidiga utvecklingen av landväxter och växternas tillväxtdynamik under torka.
Insikter från genom- och genstudier
I likhet med många andra tekniker har molekylära verktyg förmågan att förmedla ny information som är av betydelse för många forskningsområden, inklusive fysiologi och utveckling. Till exempel har medlemmar av MADS-box-genfamiljen isolerats och karakteriserats från tre charofyter, Chara globularis, Coleochaete scutata och Closterium peracerosum-strigosum-littorale (Tanabe et al., 2005). Uttrycksmönstret för MADS-box-generna i charofyterna tyder på att de spelar en roll i haploid utveckling och reproduktion (Tanabe et al., 2005). Man tror att de har rekryterats till den diploida generationen, och att deras roller i utvecklingen har diversifierats ytterligare, under landväxternas evolution (Tanabe et al., 2005). Hittills är Klebsormidium flaccidum den enda charofyt för vilken ett nästan komplett kärngenom finns tillgängligt (Hori et al., 2014); även om kloroplast- och mitokondriegenom har sekvenserats för representanter för var och en av de sex klasserna av charofyter och EST:er (exprimenterade sekvenstaggar) finns tillgängliga för vissa charofyter (Delwiche, 2016). Klebsormidiums genom har redan avslöjat förekomsten av gener för syntesen av flera växthormoner och signal intermediärer, mekanismer för skydd mot hög ljusintensitet (Hori et al., 2014) och förekomsten av WRKY-transkriptionsfaktorer i grupp IIb som man tidigare trodde att de först dök upp hos mossor (Rinerson et al., 2015). Flera projekt för sekvensering av charofyters genom pågår för närvarande (Delwiche, 2016) och kommer att möjliggöra mer detaljerade jämförande analyser som inkluderar ett större antal charofyter och potentiellt ge nya insikter i de evolutionära relationerna mellan arter och gener. Charofyternas unika position som den tidigast divergerande gruppen av Streptofyter gör dem till ett särskilt kraftfullt verktyg för evolutionär-utvecklingsstudier och nya tekniker som den nyligen uppnådda stabila transformationen hos Penium (Sørensen et al, 2014) kommer att göra det möjligt att utforska funktionen hos specifika gener.
Framtida användning av charofyter som modellorganismer
Ett kritiskt nästa steg i forskningen om charofyter är analysen av arvsmassan hos inkluderande taxa och jämförande studier med dem hos landväxter. Detta arbete kommer inte bara att ge viktiga insikter om de anpassningsmekanismer som charofyter utvecklat när de dyker upp och framgångsrikt koloniserar landmiljöer, utan det kommer också att ytterligare förfina och utvidga användningen av de nuvarande modellorganismerna i grundläggande växtforskning. Även om molekylära studier kommer att stödja många forskningsområden kommer två områden som omedelbart kommer att gynnas att vara cellväggsbiologi och dynamiken hos tillväxtregulatorer i tillväxt och utveckling. På det förstnämnda området kan charofyter ge klarhet i många grundläggande men ännu dåligt lösta fenomen, bland annat pektin- och cellväggsproteinbiosyntesen, den kontrollerade utsöndringen, deponeringen och modifieringen av väggpolymerer efter utsöndringen samt de specifika, interaktiva nätverken för membrantrafik i växtceller. När det gäller det sistnämnda skulle modeller av charofyter kunna hjälpa till att förstå den molekylära signaleringen, cellbiologin och utvecklingsdynamiken för tillväxt och utveckling i samband med hormoner som etylen och auxin. Nya ekofysiologiska studier med charofyter erbjuder också en potentiell bonanza av kritiska data för att fastställa hur växtceller anpassar sig till stress, inklusive uttorkning och salttolerans (Holzinger och Karsten, 2013; Pichrtová et al., 2014; Herburger et al., 2015; Holzinger och Becker, 2015; Holzinger och Pichrtová, 2016; Kondo et al., 2016). Framtiden för charofytforskningen är verkligen mycket ljus och kommer följaktligen att bli en välsignelse för hela växtbiologin.
Författarbidrag
Alla författare som anges har gjort ett väsentligt, direkt och intellektuellt bidrag till arbetet och godkänt det för publicering.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgment
Detta arbete stöddes av NSF (USA) MCB collaborative grants 1517345 och 1517546.
Belby, M. J. (2016). Multiskaligt experimentellt system för salamander: från elektrofysiologi av membrantransportörer till konnektivitet från cell till cell, cytoplasmatisk strömning och auxinmetabolism. Front. Plant Sci. 7:1052. doi: 10.3389/fpls.2016.01052
CrossRef Full Text | Google Scholar
Braun, M. (2002). Gravitationsuppfattning kräver statoliter som sätter sig på specifika plasmamembranområden i rhizoider och protonemata från salamander. Protoplasma 219, 150-159. doi: 10.1007/s007090200016
CrossRef Full Text | Google Scholar
Braun, M., and Limbach, C. (2006). Rhizoider och protonemata av salamanderalger: modellceller för forskning om polariserad tillväxt och växters gravitationsavkänning. Protoplasma 229, 133-142. doi: 10.1007/s00709-006-0208-9
CrossRef Full Text | Google Scholar
Graham, L. E. (1993). Landväxternas ursprung. New York, NY: John Wiley & Sons, 287.
Google Scholar
Herburger, K. och Holzinger, A. (2015). Lokalisering och kvantifiering av callose i de streptofytiska grönalgerna Zygnema och Klebsormidium: korrelation med uttorkningstolerans. Plant Cell Physiol. 56, 2259-2270. doi: 10.1093/pcp/pcv139
CrossRef Full Text | Google Scholar
Lemieux, C., Otis, C. och Turmel, M. (2016). Jämförande kloroplastgenomanalyser av streptofytiska grönalger avslöjar stora strukturella förändringar i Klebsormidiophyceae, Coleochaetophyceae och Zygnematophyceae. Front. Plant Sci. 7:697. doi: 10.3389/fpls.2016.00697
CrossRef Full Text | Google Scholar
Lutz-Meindl, U. (2007). Användning av energifiltrerande transmissionselektronmikroskopi för bildgenerering och elementanalys i växtorganismer. Micron 38, 181-196. doi: 10.1016/j.micron.2006.03.017
CrossRef Full Text | Google Scholar
Meindl, U. (1993). Micrasterias celler som ett modellsystem för forskning om morfogenes. Microbiol. Rev. 57, 415-433.
Google Scholar
Pichrtová, M., Kulichova, J. och Holzinger, A. (2014). Kvävebegränsning och långsam torkning inducerar uttorkningstolerans hos konjugerande grönalger (Zygnematophyceae, Streptophyta) från polära habitat. PLoS ONE 9:e113137. doi: 10.1371/journal.pone.0113137
CrossRef Full Text | Google Scholar
Pickett-Heaps, J. D., and Marchant, H. J. (1972). Grönalgernas fylogeni: ett nytt förslag. Cytobios 6, 255-264.
Google Scholar
Stamenkovic, M., Woelken, E. och Hanelt, D. (2014). Ultrastruktur av Cosmarium-stammar (Zygnematophyceae, Streptiophyta) som samlats in från olika geografiska platser visar artspecifika skillnader både vid optimala temperaturer och stress-temperaturer. Protoplasma 251, 1491-1509.
Google Scholar