Lewisstruktur för oxalatjonen ritas steg för steg i denna handledning. Begreppet totala valenselektroner används för att rita lewisstrukturen för C2O42-. Efter att ha slutfört lewisstrukturen av C2O42- bör det finnas en -2 laddning och en stabilitet. Du kommer att lära dig om dessa saker i den här handledningen.
Oxalatjon | C2O42-
Carbonatjonen har en -2 laddning. Det finns två kolatomer i oxalatjonen.
C2O42- Lewisstruktur
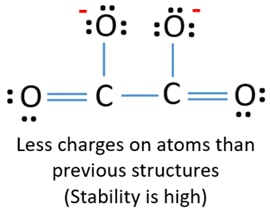
Två kolatomer är fogade till en kolatom. På samma sätt är de andra två syreatomerna förenade med andra kolatomer. I C2O42-jonens lewisstruktur är jonen symmetrisk runt C-C-bindningen.
Steg för att rita lewisstrukturen för C2O42-
Följande steg krävs för att rita C2O42- lewisstrukturen och de förklaras i detalj i den här handledningen.
- Hittar totalt antal elektroner i kol- och syreatomernas valansskal. Detta används för att bestämma antalet bindningar, ensamstående par runt atomer.
- Total elektronpar runt atomer
- Centeratomval enligt maximal valens
- Sätt ensamstående par på atomer
- Kontrollera stabiliteten och minimera laddningar på atomer för att bygga upp den mest stabila strukturen genom att omvandla ensamstående par till bindningar.
Som dessa steg är följande fakta viktiga för att rita lewisstrukturen.
Syran bör hålla negativa laddningar i lewisstrukturen eftersom syran gillar att behålla elektroner än kolatomen.
Syrans elektronegativitet är högre än kolets.
Det är viktigt att rita korrekt lewisstruktur för att rita resonansstrukturer av CO32- korrekt.
Totalt antal elektroner i valanceskalen av C2O42-
Kol är placerat i grupp 4 i det periodiska systemet. Kol har alltså fyra elektroner i sitt valensskal. Syre befinner sig i den sjätte gruppen. Den har sex elektroner i valensskalet.
- Totala valenselektroner givna av kolatom = 4 * 2 = 8
Det finns fyra syreatomer i C2O42-jonen, Därför
- Totala valenselektroner givna av syreatomer = 6 *4 = 24
Det finns -2 laddning på C2O42-jonen. Därför finns det ytterligare två elektroner som bidrar till valenceelektronerna.
- Totala valenceelektroner = 8 + 24 + 2 = 34
Totala valenceelektronpar
Totala valenceelektronpar = σ-bindningar + π-bindningar + ensamma elektronpar vid valensskal
Totala elektronpar bestäms genom att dividera antalet totala valenceelektroner med två. För C2O42-jonen är det totala antalet elektronpar 17.
Centeratom i C2O42-jonen
För att vara centeratom är det viktigt att ha högre valens. Kol har större chans att vara centrumatom (se figuren) eftersom kolet kan uppvisa en valens på 4. Syreets högsta valens är 2. Så nu kan vi bygga en skiss av C2O42-jonen.
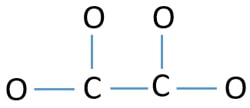
Ett par på atomerna
- Det finns fyra C-O- bindningar och en C-C- bindning i skissen ovan vilket gör att det finns fem bindningar. Därför återstår endast tolv (17-5 = 12) valenceelektronpar.
- Markera först dessa tolv valenceelektronpar som ensamma par i atomer utanför (på syreatomer). En syreatom kommer att ta tre ensamma par enligt oktalregeln (syreatomen kan inte behålla mer än åtta elektroner i sitt valensskal).
- För fyra syreatomer är tolv elektronpar förbrukade. Nu finns det inga fler ensamma par att markera på kolatomer efter att ha markerat ensamma par på syreatomer (utanför atomer).
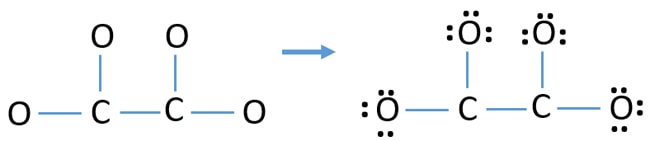
Laddningar på atomer
Efter att ha markerat elektronpar på atomer (i det här fallet bara på syreatomer) bör vi markera laddningar på varje atom om det finns en laddning. Markeringen av laddningar är viktig eftersom den används för att bestämma den bästa lewisstrukturen för jonen. Efter att ha markerat laddningar kommer du att se att varje syreatom får en -1-laddning och båda kolatomerna får en +1-laddning.
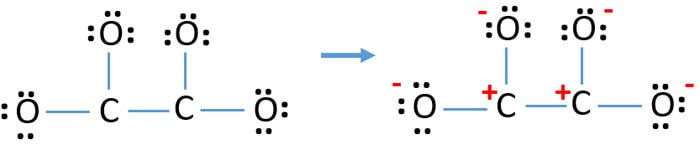
Denna struktur är mycket instabil eftersom det finns laddningar överallt i jonen.
Kontrollera stabiliteten och minimera laddningar på atomer genom att omvandla ensamstående par till bindningar
- Syreatomer bör ha negativa laddningar eftersom syreatomens elektronegativitet är högre än kolatomens. Annars kan vi säga att förmågan att hålla negativa laddningar är större hos syreatomer än hos kolatomer.
- Den ritade strukturen är inte stabil eftersom alla atomer har en laddning (Lewisstrukturen borde vara stabil med färre laddningar).
- Nu bör vi försöka minimera laddningarna genom att omvandla ensamma par eller par till bindningar. Så omvandla ett lone pair av en syreatom till en C-O-bindning.
- Nu finns det en dubbelbindning mellan en kolatom och en syreatom (en C=O-bindning). Nu finns det tre enkelbindningar mellan kolatomen och de andra tre syreatomerna (två C-O-bindningar).
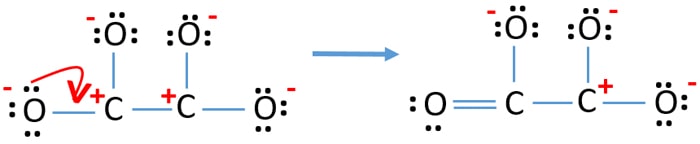
I den nya strukturen är atomernas laddningar reducerade jämfört med den tidigare strukturen. Nu finns det ingen laddning på en syreatom och en kolatom. Men det finns fortfarande laddningar på tre syreatomer (har -1 negativ laddning) och den andra kolatomen. Nu förstår du att denna struktur av C2O42- är stabilare än den tidigare strukturen. Men vi försöker minska laddningarna så mycket som möjligt.
Reducera laddningarna ytterligare
Du kan omvandla det ensamma paret på en annan syreatom till en C-O-bindning enligt nedan.
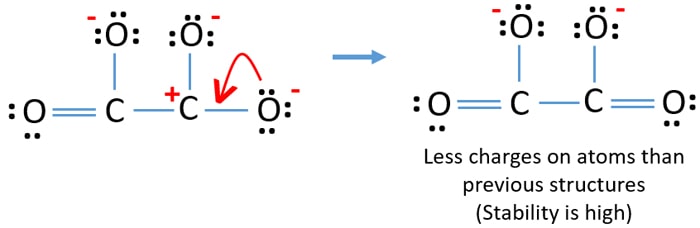
Lewisstruktur för C2O42- (karbonat)-jonen
Frågor
Ställ dina kemifrågor och få svaren
Relaterade övningar
.