INLEDNING
Trots framsteg i diagnostiska och kirurgiska tekniker och postoperativ vård fortsätter akut aortadissektion av typ A att vara förknippad med hög morbiditet och mortalitet på kort och lång sikt. Den nuvarande sjukhusdödligheten har uppskattats till mellan 15 % och 35 %, med en 5-årsöverlevnad på 65 %-75 %.1-7
Den höga incidensen av postoperativ stroke hos dessa patienter (10 %-20 %)3,5,7,8 har förknippats med otillräckligt cerebralt skydd under cirkulationsstillestånd, emboliska händelser eller malperfusion på grund av föredraget flöde genom det falska lumenet under perfusion med hjälp av femoralarterien.9,10 På senare år har införandet av nya tekniker för cerebralt skydd, t.ex. selektiv antegrad cerebral perfusion och kanylering av arteria axillaris, avsevärt minskat förekomsten av denna komplikation10-17.
Syftet med denna retrospektiva studie är att beskriva vår erfarenhet av akut aortadissektionskirurgi av typ A – i förhållande till sjukhusdödlighet, förekomsten av återingrepp och långtidsöverlevnad – och att analysera hur cerebralt skydd påverkar våra resultat.
METODER
Mellan mars 1990 och oktober 2007 genomgick 98 konsekutiva patienter (79 män och 19 kvinnor) kirurgi för akut aortadissektion av typ A på vårt sjukhus. Av de patienter som diagnostiserats och remitterats för operation (103) under denna period exkluderades 5; 2 patienter på grund av att de var över 85 år och de övriga på grund av att de uppvisade irreversibla cerebrala eller viscerala lesioner.
Medianåldern var 59 år. Det vanligaste symtomet vid presentationen var akut bröstsmärta. Diagnosen bekräftades genom aortografi under den inledande perioden (18 %), transthorakal ekokardiografi (76 %), transesofageal ekokardiografi (66 %) och thorakoabdominell datortomografi (CT) (65 %). Med undantag för 11 patienter, där ett enda diagnostiskt test utfördes, diagnostiserades alla patienter med hjälp av 2 eller 3 av dessa bildbehandlingstekniker i kombination (för närvarande är det diagnostiska system som används thorako-abdominell CT med eller utan transtorakal ekokardiografi och intraoperativ transesofageal ekokardiografi).
Totalt 91 (93 %) patienter genomgick akut kirurgi (inom 24 timmar) och de övriga genomgick akut kirurgi (inom 72 timmar efter diagnosen).
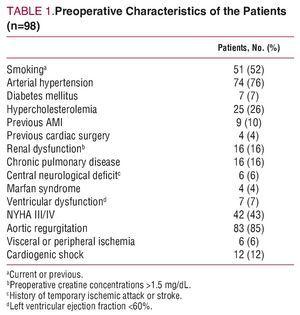
Bilddiagnostikerna påvisade aortisk regurgitation hos 83 patienter (55 % med svår regurgitation). De preoperativa kliniska och demografiska egenskaperna visas i tabell 1.
Kirurgisk teknik
De grundläggande koncepten för det kirurgiska ingreppet innebär att man byter ut den ascenderande aortan eller aortabågen, resektion av den primära revan och förberedelse av den distala anastomosen under cirkulationsstopp. Under denna 18-årsperiod har det skett en progressiv utveckling av den kirurgiska strategi som används för denna patologi. Till en början var det endast den stigande aorta som resecerades med aortaklämning utan cirkulationsstillestånd. År 1994 infördes distal anastomos med cirkulationsstillestånd, vilket är den teknik som för närvarande används för alla patienter, samtidigt som olika metoder för cerebralt skydd tillämpas. Selektiv antegrad cerebral perfusion via axillarartären introducerades nyligen som en metod för cerebralt skydd under cirkulationsstillestånd (figur 1).
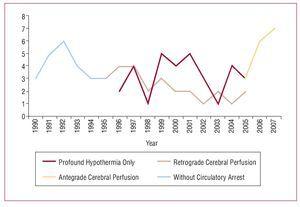
Figur 1. Utveckling av den kirurgiska strategin.
Detta utfördes via median sternotomi, kanulering av femoralartären (82 %), kanulering av axillarartären (16 %) eller kanulering av aortabågen (2 %), med venöst återflöde via höger förmak (85 %) eller femoralvenen (15 %) och kardiopulmonär bypass. Kroppstemperaturen övervakades via matstrupen och blåsan, och djup hypotermi uppnåddes när blåsans temperatur nådde 18oC.
Efter aortaklämning öppnades den ascenderande aortan i längsled och suprakoronar transektion utfördes för att lokalisera intimal reva, om det fanns någon, och för att undersöka aortaklaffens morfologi och funktion. Under djup hypotermi och cirkulationsstillestånd avklämdes sedan den stigande aorta och hela aortabågen undersöktes. Hos 27 % av patienterna lades retrograd cerebral perfusion till via den övre vena cava (200-300 mL/min). Hos de 16 patienter där antegrad cerebral protektion utfördes användes den högra axillarartären (10-15 mL/kg/min) och selektiv perfusion utfördes via den vänstra halspulsådern hos alla patienter.
Den primära revan identifierades hos 83 patienter; den var lokaliserad i aortaroten hos 14 %, i den uppstigande aorta hos 67 % och i aortabågen hos 19 % av patienterna. Det aortasegment som påverkades av den primära revan resekterades och ersattes med ett Hemashield dacrontransplantat (Boston Scientific, Massachusetts, USA) som anastomiserades med kontinuerlig 4/0 monofilamentsutur som stöddes av en heterolog perikardialremsa och som förstärkte den proximala och distala nativa aortan med gelatin-resorcin-formaldehyd (GRF, biologiskt lim; Cardial Laboratories, Saint-Etienne, Frankrike). Under vår tidiga erfarenhet utfördes ersättning av aortasegmentet med hjälp av inklusionstekniken (täckande av protesröret med den resecerade inhemska aortan) hos 21 patienter. För närvarande används tekniken för interposition av transplantat (ersättning med tubulär protes med fullständig resektion av den ursprungliga aorta).
Ersättning av endast den stigande aorta utfördes hos 61 (63 %) patienter, utvidgades till halvbågen hos 24 (24 %) och till hela aortabågen hos 13 (13 %). Med hemiark avser vi de fall med partiell resektion av bågen, med endast en distal anastomos, utan behov av reimplantation av den supra-aortala stammen. En elefantstam användes hos 6 patienter (vid total ersättning av aortabågen förblir ett fritt segment av protesröret i den distala anastomosen hängande i den nedåtgående thorakala aorta, vilket underlättar eventuella ingrepp i detta område). Aortaklaffen skonades genom att kommissurerna åter sattes upp med 4/0 monofilamentsuturer med stöd av ett teflonplåster hos 46 patienter (47 %), ersattes hos 34 (35 %) och reimplanterades hos 1 (1 %). När aortaklaffen behövde ersättas gjordes detta hos 73 % av patienterna med hjälp av ett klafftransplantat med reimplantation av kranskärlen med Bentall-teknik. Aortaklaffens preoperativa tillstånd beskrivs i tabell 2. Efter operationen, i fall av resuspension, objektifierades klaffkompetens genom intraoperativ transesofageal ekokardiografi hos 84 % av patienterna, mild regurgitation hos 13 % och måttlig regurgitation (II/IV) hos de återstående patienterna.

Den genomsnittliga kardiopulmonella bypasstiden var 183 (58) min, ischemitiden 113 (39) min och tiden för cirkulationsstillestånd 3 (23) min.
Totalt 24 % av patienterna, som omfattade den första erfarenheten, genomgick inte cirkulationsstillestånd. Hos de återstående patienterna var den cerebrala skyddsmetoden som användes djup hypotermi hos endast 32 (33 %) patienter, retrograd cerebral perfusion lades till hos 26 (27 %) patienter och antegrad perfusion hos de övriga 16 (16 %).
Uppföljning
Alla överlevande patienter genomgick årliga kliniska och ekkokardiografiska kontroller, samt seriella datortomografiundersökningar för att utvärdera den distala aortan. Kliniska data inhämtades genom personliga intervjuer och telefonintervjuer med patienterna, familjemedlemmar och primärvårdsläkare. En uppföljningsfrekvens på 95 % uppnåddes (79 patienter).
Statistisk analys
Det statistiska programmet SPSS (version 14.0 för Windows) användes i alla analyser. En univariat analys utfördes på de perioperativa variablerna för att fastställa de statistiskt signifikanta riskfaktorerna (P
RESULTAT
Sjukhusdödlighet
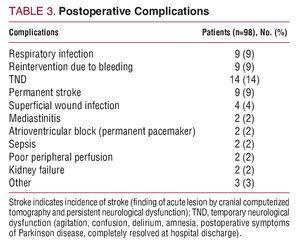
Sjukhusdödligheten var 15 % (15/98): 6 patienter avled på grund av intraoperativ blödning, 3, lågt hjärtminutvolym, 2, neurologisk skada, 2, sepsis och 2 på grund av postoperativt multiorganfel. Tabell 3 visar de postoperativa komplikationerna.
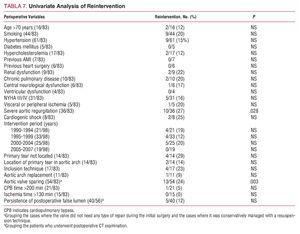
Den univariata analysen visade att hög ålder, vänsterkammardysfunktion, kardiogen chock, kardiopulmonell bypasstid >200 min, aortaklämningstid >130 min och postoperativ stroke var riskfaktorer för sjukhusdödlighet (tabell 4). Dessa variabler genomgick multivariat analys som visade att hög ålder (≥70 år) (RR=2,85; P=.04) och preoperativ kardiogen chock (RR=2,6; P=.025) identifierades som oberoende prediktorer för sjukhusdödlighet.

Preoperativ neurologisk dysfunktion och de första erfarenhetsåren (1990-1994) var de enda variablerna som var förknippade med postoperativa neurologiska komplikationer (tabell 4) i den univariata analysen, men dessa uppnådde inte statistisk signifikans i den multivariata analysen.
Dödligheten och specifika postoperativa neurologiska komplikationer (permanent stroke och tillfällig neurologisk dysfunktion ) mättes bland de patienter som genomgick cirkulationsstillestånd och de som inte genomgick cirkulationsstillestånd och stratifierades enligt den metod för cerebralt skydd som användes (djup hypotermi enbart eller i kombination med retrograd eller antegrad perfusion) (tabell 5). Inga statistiskt signifikanta skillnader hittades mellan dem.

Uppföljning
En uppföljningsfrekvens på 95 % (79 patienter) uppnåddes, med en median på 61 (intervall, 1-204) månader. Efter sjukhusutskrivning genomgick alla patienter ekokardiografisk undersökning vid 2 månader och därefter årligen. Totalt 67 % (56/83) av patienterna genomgick minst en CT-undersökning. Av de 27 överlevande patienterna som inte genomgick CT, vägrade 17 att göra provet eller deltog inte, 4 förlorades i studien och 6 avled under uppföljningen, varav 1 på grund av en känd aortaorsak (rupturerat abdominellt aortaaneurysm).
Computertomografi visade persisterande patenterat falskt lumen i den distala aorta hos 71 % av patienterna, varav 17 % uppvisade progressiv dilatation av thorakal aorta och bukaorta.
Reintervention
Totalt genomgick 13 (16 %) patienter en reintervention under uppföljningen. Orsakerna var följande: svår aortisk regurgitation och dilatation av aortikarot hos 5 patienter, svår aortisk regurgitation och redissektion av aortikarot hos 3 patienter, enbart svår aortisk regurgitation hos 1 patient, svår aorta- och mitralregurgitation hos 1 patient, endokardit i mitral- och aortaklaffen hos 1 patient, pseudoaneurysm i aortotrakeal hos 1 patient och fistel mellan aortikarot och höger förmak hos 1 patient. Ingen patient genomgick ett nytt ingrepp på grund av sjukdom i den nedåtgående aorta. De kirurgiska ingrepp som tillämpades visas i tabell 6. Sjukhusmortaliteten var 23 % (3/13), 2 patienter dog på grund av intraoperativ blödning och 1 på grund av låg hjärtminutvolym.
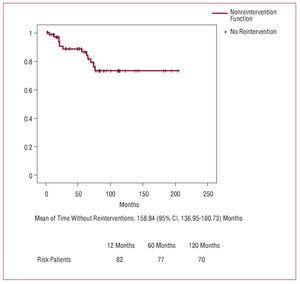
Figur 2. Kurva för icke-intervention
Långsiktig överlevnad
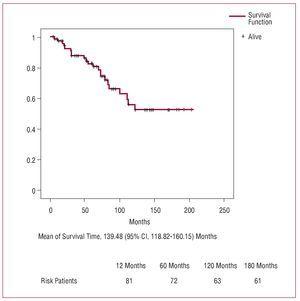
Figur 3. Överlevnadskurva under uppföljning (Kaplan-Meier).

Den univariata analysen visade hög ålder (≥70 år), inklusionstekniken, postoperativ TND och tillämpning av icke-antegradiga metoder för cerebralt skydd (tabell 9) som prediktorer för mortalitet under uppföljning. I den multivariata analysen var den enda statistiskt signifikanta oberoende prediktor för mortalitet under uppföljningen att inte använda antegrad cerebral protektion (RR=3,1; P=.02).

DISKUSSION
Akut aortadissektion av typ A är en kritisk situation som i de flesta fall kräver omedelbar klinisk respons och akut kirurgiskt ingrepp.
Siegal et al18 uppskattade att hos obehandlade patienter ökar risken för dödlighet med 1 % per timme under de första 48 timmarna och når 70 % efter en vecka. Enligt uppgifter från International Registry of Acute Aortic Syndrome (IRAD)1 är mortaliteten bland patienter som behandlas konservativt 58 %, medan den totala kirurgiska mortaliteten är 24 %.
Och även om det under de senaste åren har gjorts stora framsteg när det gäller diagnostiska och kirurgiska tekniker och postoperativ vård, finns det en avsevärd variation när det gäller sjukhusdödligheten, som ligger mellan 15 och 30 %.2,3,19-21 Enligt vår erfarenhet var sjukhusdödligheten 15 %, vilket är jämförbart med de bästa resultaten i aktuella serier.4,22
Prediktorerna för sjukhusdödlighet sammanfaller med dem i de flesta publicerade serier.2-4,21 Enligt uppgifter från IRAD1 är de oberoende variablerna för dödlighet hög ålder, hypotoni/chock, tidigare hjärtsjukdom och preoperativ njur-, mesenteri- eller myokardiell ischemi. Dessa resultat visar att sjukhusdödligheten vanligtvis är förknippad med patienternas preoperativa kliniska egenskaper och som är svåra att ändra. Rampoldi et al1 har visat att instabila patienter har en kirurgisk dödlighet som är minst dubbelt så hög som hos stabila patienter (31,4 % jämfört med 16,7 %). Dessa resultat avslöjar vikten av preoperativ hemodynamisk stabilitet och understryker behovet av akut kirurgi innan den hemodynamiska försämringen börjar.
I vår serie var de enda oberoende prediktorerna för sjukhusdödlighet hög ålder (≥70 år) och preoperativ kardiogen chock.
Den kirurgiska resektionens omfattning identifierades inte som en oberoende riskfaktor för sjukhusdödlighet; mer omfattande resektioner med ersättning av aortabågen påverkade inte de tidiga eller sena resultaten. Andra författare har å andra sidan föreslagit uteslutande resektion av den stigande aorta, med argumentet att risken med mer omfattande resektioner uppväger den potentiella nyttan och att huvudsyftet med operationen är patientens överlevnad.5
Orsaken till neurologisk skada under kirurgi för aortadissektion är multifaktoriell och kan leda till långvarigt cirkulationsstillestånd, emboliska händelser och dålig cerebral perfusion på grund av preferentiellt flöde genom det falska lumenet.
Postoperativa neurologiska komplikationer är en frekvent orsak till sjuklighet och dödlighet vid kirurgi för aortadissektion, med en uppskattad incidens på 10-20 %.3,5,7,8
Ergin et al9 och Hagl et al10 påpekar att postoperativ stroke huvudsakligen orsakar emboliska händelser i ett möjligt samband med retrograd perfusion från femoralartären, men inte direkt med den använda metoden för cerebralt skydd, medan TND skulle vara förknippat med otillräckligt cerebralt skydd. Antegrad cerebral perfusion har förknippats med en betydande minskning av TND i nyligen publicerade serier,10,11,23,24 även om dess roll är mindre tydlig när det gäller att minska stroke.
Antegrad cerebral perfusion har modifierat begreppet cirkulationsstillestånd hos dessa patienter, eftersom ett totalt cirkulationsstillestånd strängt taget inte utförs, med tanke på att den kontinuerliga cerebrala perfusionen upprätthålls mellan 500 mL/min och 1000 mL/min. Dessutom har flera författare föreslagit att måttlig hypotermi (25oC) skulle vara tillräcklig för att skydda hjärnan och undvika de skadliga effekterna av djup hypotermi.17,25,26 Vår grupp tillämpade dock djup hypotermi eftersom dessa reparationer är komplexa, förväntas vara långvariga och eftersom denna metod för nedkylning har visat sig vara mycket effektiv när det gäller att skydda hjärnan såväl som de andra organen.17,27,28
Axillary artery cannulation, istället för femoral, minskar risken för dålig visceral och cerebral perfusion, remobilisering av tromber från buk- och thorax aorta mot hjärnan och omdirigerar dessutom flödet till det sanna lumenet, minskar risken för överdriven tryckuppbyggnad när man klämmer av aortan och underlättar återställandet av antegrad distal perfusion12-16 . Alla dessa fördelar verkar tyda på att antegrad cerebral perfusion via axillarartären, utom när denna är påverkad av allvarlig ateroskleros, är den bästa metoden för cerebralt skydd.10,11,17
I vår serie minskade antegrad cerebral perfusion med hjälp av axillarartären incidensen av TND till 6 % och sjukhusmortaliteten till 6 % hos de sista 16 patienterna som genomgick kirurgi, vilket tyder på, men inte påvisar, dess roll för att skydda mot de neurologiska komplikationerna och deras samtidiga sjuklighet och mortalitet. Möjligen beror denna brist på statistisk signifikans på det låga antalet ingrepp med antegrad perfusion via axillarartären. Med tanke på att detta ingrepp är sällsynt (
Efter 10 år hade 73,3 % av patienterna inte genomgått något nytt ingrepp, och detta resultat liknar de resultat som publicerats.3,4,6,29,30 Aortaklaffen skonades när det var möjligt och endast i fall av klaffdegeneration, annuloaortisk ektasi eller tidigare klaffsjukdom beslutades att utföra klaffbyte enbart eller med aortikarotbyte (Bentall-teknik), ett förfarande som inte ändrade sjukhusmortaliteten.
I vår serie krävde 77 % av de patienter som genomgick återintervention (13/78) detta på grund av allvarlig aortaklaffregurgitation som tidigare hade uppvisats och behandlats konservativt genom resuspension av klaffen under det första ingreppet. Preoperativ akut aortisk regurgitation och sparande av aortaklaffen var just de faktorer som avgjorde sen aortisk reintervention, och detta skulle motivera en aggressiv behandling av aortaklaffen under det första ingreppet.6,29 Hagl et al31 rekommenderade ett systematiskt byte av roten och aortaklaffen (Bentall-tekniken). Å andra sidan rapporterade Estrera et al32 en acceptabel hållbarhet efter att ha skonat aortaklaffen; de påpekade att en eventuell återintervention inte bör diktera det initiala ingreppet och rekommenderade att skona aortaklaffen för att undvika kronisk antikoagulantiabehandling och dess eventuella roll i avsaknaden av trombos i det falska lumenet.33
Vi anser att den initiala presentationen av allvarlig aortakörtelregurgitation avgör hur allvarlig dissektionen är, vars ursprung eller utbredning innefattar aortakroppen, och att aggressiv behandling med resektion av aortakroppen och aortaklaffen och inplantering av en klafftransplantation (Bentall-teknik) därför bör vara det lämpligaste förfarandet.4,6,29,31 I dessa fall lämnar resuspensionen av klaffen, genom att skona aortakroppen, efter sig ett i och för sig sjukdomsdrabbat segment av aortan som innebär en större risk för redissektion och efterföljande komplikationer. De resultat som publicerats om tekniken för aortikarotbyte med reimplantation av aortaklaffen (David-tekniken) är lovande, och även om det behövs en långtidsbedömning kan den bli ett intressant alternativ33,34 .
Av de 56 patienter som överlevde sjukhusutskrivningen och som genomgick datortomografi under uppföljningen var det endast hos 6 (11 %) som en progressiv dilatation i andra delar av aorta var uppenbar med kirurgisk indikation: 2 patienter med aneurysm i bukaorta, 2 med aneurysm i thorako-abdominal aorta och 2 med aneurysm i nedåtgående thorakal aorta. Av dessa patienter vägrade 2 att återintervjua och de andra hade någon komorbiditet (hög ålder, allvarlig neurologisk brist etc.) som omöjliggjorde ingreppet.
Den låga andelen återinterventioner i den distala aortan beror troligen på den höga procentandelen primära intima revor som lokaliserades under ingreppet och vårt beslut att resektera dem i alla fall. Faktum är att av de 15 patienter där intimal reva inte hittades tillhörde 60 % (9 patienter) den grupp som inte genomgick cirkulationsstillestånd (vilket förhindrar undersökning av aortabågen och utesluter intimal reva på den nivån) och som uppvisade en ökad risk för återintervention nära gränsen för statistisk signifikans (P = 0,06). Flera författare beskriver således bristen på resektion av intimalrupturen under den första operationen som den viktigaste faktorn för sena reinterventioner vid dilatation av bröst- eller bukaorta.6,30
Och även om vår grupp inte har någon erfarenhet av detta påpekar vissa författare att i vissa fall kan implantering av en stent i den nedåtgående thorakala aorta under det första eller andra ingreppet förbättra resultaten genom att minska incidensen av reintervention och uppkomsten av komplikationer på grund av att sjukdomen fortskrider till den distala aortan.35,36
Den aktuariella överlevnadskurvan efter utskrivning från sjukhus visar på vissa procentsatser som är jämförbara med dem som beskrivits av andra författare.2,3,5,6 Hög ålder är en av de oberoende riskfaktorerna för dödlighet under uppföljningen i de flesta serier, delvis på grund av den låga förväntade livslängden i denna patientgrupp.2 Generellt sett finns det en stor variation när det gäller att fastställa de oberoende prediktorerna för långtidsöverlevnad. Chiappini et al2 beskrev en serie på 487 patienter som genomgick intervention för aortadissektion av typ A och fann att den enda riskfaktorn var preoperativ diabetes. Erwin et al,3 i en grupp med 315 patienter identifierade hög ålder och postoperativ dialys som prediktorer för mortalitet under uppföljningen.
I vår serie fann vi att det faktum att man inte använde antegrad cerebral protektion var en prediktor för sen mortalitet, vilket indikerar att även om antegrad perfusion inte signifikant förändrade de initiala postoperativa resultaten, så har den stor betydelse när det gäller den sena överlevnaden.
Ergin et al9 associerade postoperativ TND med långsiktig försämring av den cerebrala funktionen. Pompilio et al37 bedömde inflytandet av perioperativa neurologiska händelser på den sena mortaliteten, det vill säga de patienter som överlevde sjukhusvistelsen på grund av neurologisk skada hade sämre långtidsöverlevnad. Detta faktum kan förklaras av den höga risken för bronkopneumoni, nya neurologiska händelser och andra komplikationer relaterade till dessa patienters minskade funktionsförmåga.4
Begränsningar
Denna artikel delar alla de begränsningar som är förknippade med retrospektiva icke-randomiserade studier. Den låga incidensen av denna sjukdom innebär att få patienter genomgick ett ingrepp, vilket begränsar resultatens statistiska styrka.
Då denna översikt omfattar en lång erfarenhetsperiod var de första patienterna, som hanterades utan cirkulationsstillestånd, och de senare patienterna, som hanterades med antegrad cerebral perfusion, inte samtida med de andra cerebrala skyddsmetoderna som nämndes. Den sista metoden (antegrad cerebral perfusion) tillämpades på ett litet urval (16 patienter), vilket begränsar resultatens statistiska betydelse.
KONKLUSIONER
Akut aortadissektionskirurgi ger acceptabla resultat på kort och lång sikt och akut ingripande bör vara indicerat hos de flesta patienter.
Svår aortisk regurgitation är förknippad med en hög risk för tidig reintervention och detta skulle motivera en aggressiv hantering av aortaklaffen under den initiala operationen.
Antegrad cerebral perfusion har modifierat begreppet cirkulationsstillestånd och har förbättrat långtidsprognosen bland dessa patienter. Vi anser att även om det krävs erfarenhet av mer omfattande serier, kan tillämpningen av antegrad cerebral perfusion vid akut aortadissektionskirurgi förbättra prognosen bland dessa patienter.
ABBREVIATIONS
CT: datortomografi
TND: tillfällig neurologisk dysfunktion
.