DOI: 10.17235/reed.2016.4095/2016
ORIGINALPAPPER
Samband mellan lokaliseringen av kolonpolyper vid baslinjen och övervakningskoloskopi – en retrospektiv studie
Ana Oliveira, Paulo Freire, Paulo Souto, Manuela Ferreira, Sofia Mendes, Clotilde Lérias, Pedro Amaro, Francisco Portela och Carlos Sofia
Avdelningen för gastroenterologi. Centro Hospitalar e Universitário de Coimbra. Coimbra, Portugal.
Korrespondens
ABSTRACT
Introduktion: Flera faktorer används för att stratifiera sannolikheten för polypåterfall. Det finns dock inga studier som korrelerar lokaliseringen av de initiala polyperna och de återkommande polyperna. Syftet med den här studien var att verifiera om polypsläget vid övervakningskoloskopin var korrelerat med läget för de tidigare exciderade polyperna vid baskoloskopin.
Metoder: En retrospektiv studie av patienter som genomgått koloskopi med närvaro och excision av alla polyper, följt av en övervakningskoloskopi. Polypernas placering delades upp i proximal/distal till splenic flexure och rektum. Egenskaper och återfallsfrekvenser på samma plats i tjocktarmen utvärderades också.
Resultat: Av de 346 patienter som genomgick upprepad koloskopi hade 268 (77,4 %) minst 1 polyp upptäckts. För alla segment fanns det en ökad risk för återkommande polyper på samma plats och den var ungefär fyra gånger högre i proximala (OR 3,5; CI 2,1-6,0) och distala kolon-segment (OR 3,8; CI 2,1-6,8), följt av tre gånger högre i rektum (OR 2,6; CI 1,5-4,6). Ingen skillnad hittades mellan återfallsfrekvenserna i samma segment, med hänsyn till polypens morfologi, storlek, den använda polypektomitekniken och den histologiska klassificeringen.
Slutsats: Det verkar finnas ett signifikant samband mellan polypens placering vid baslinjen och övervakningskoloskopi.
Nyckelord:
Nyckelord: Det finns ett samband mellan polypens placering vid baslinjen och övervakningskoloskopi: Colon. Polyp. Placering. Recidiv.
Introduktion
Adenom i tjock- och ändtarmen är vanliga godartade neoplastiska lesioner som upptäcks hos cirka 25 % av de patienter som genomgår koloskopi (1). Kolorektalcancer (CRC) är den tredje vanligaste cancerformen och den fjärde dödsorsaken till följd av cancer i världen (2). Koloskopi och endoskopisk upptäckt och resektion av precancerösa lesioner leder till en minskning av incidensen och dödligheten orsakad av CRC (3). Denna riskminskning verkar vara starkare för den distala tjocktarmen. Trots detta har en minskning av incidensen med 77 % och en minskning av CRC-relaterade dödsfall med 29-37 % observerats med hjälp av koloskopi (4,5). Övervakningskoloskopi rekommenderas hos patienter med tidigare adenomatösa polyper, på grund av risken för metakrona, återkommande och nya lesioner (6). Risken att hitta adenom vid övervakningskoloskopi är beroende av fynden vid den första koloskopin. Frekvensen är högre hos patienter med avancerade adenom, medelhög hos icke avancerade adenom och lägre hos patienter utan adenom (7). Trots betydelsen av koloskopi hittas intervallkoloncancer efter en tidigare koloskopi med polypektomi eller negativa fynd (3,8). Detta kan bero på flera faktorer, t.ex. missade lesioner, återfall av ofullständigt avlägsnade polyper eller nya lesioner som har utvecklats sedan föregående koloskopi (9). Det finns flera faktorer som används för att stratifiera sannolikheten för återkomst av polyper, bland annat histologi, storlek och antal. Vissa studier gynnar också den proximala kolonin som en markör för framtida adenomrecidiv (10), eller till och med ett visst samband mellan proximal eller distal recidiv (7,11). Syftet med den här studien var därför att verifiera om polypernas placering vid övervakningskoloskopin var associerad med placeringen av de tidigare borttagna polyperna vid baslinjekoloskopin.
Material och metoder
Vi genomförde en retrospektiv studie av patienter som genomgått två koloskopier: en indexkoloskopi med polyper och en övervakningskoloskopi med eller utan polyper. Vi definierade ett positivt samband i polypåterfall på samma plats om minst en metakron polyp vid övervakningskoloskopi fanns i samma kolon-segment, som en eller flera av indexkoloskopin.
Patienterna rekryterades från Gastroenterologiavdelningen från januari 2004 till december 2014. Inklusionskriterierna omfattade patienter över 18 år med två högkvalitativa koloskopier med minst ett års mellanrum mellan dem och excision av alla polyper som upptäcktes vid baskoloskopin. Kriterierna för högkvalitativa koloskopier innebar att de utfördes av en erfaren koloskopist, att graden av tarmrengöring bedömd med Ottawa Bowel Preparation Scale (OBPS) var utmärkt eller bra och att cecalintubation uppnåddes. Patienternas medicinska journaler analyserades. Vi samlade in patienternas demografiska data, inklusive kön och ålder. Data från koloskopirapporter registrerades, inklusive antalet polyper, deras storlek, morfologi och läge samt resektionsteknik. Lesionerna klassificerades enligt Paris-klassificeringen (12). Typ-0 icke-polypoida lesioner och polyper som var större än 20 mm exkluderades. Vi kategoriserade polypernas placering i proximal eller distal till mjältflexur och rektum. Resektionstekniken delades in i resektion med kall biopsitång, standard snare excision och submucosal injektion följt av resektion. Dessa uppgifter samlades in från båda koloskopierna. Den histologiska rapporten erhölls från alla avlägsnade och återställda polyper från båda koloskopierna. Den histopatologiska diagnosen klassificerades enligt den reviderade Wien-klassifikationen (13). Polyperna kategoriserades också i förhållande till deras körtelarkitektur i tubulär, tubulovillös, villös och serrerad. Dessa uppgifter användes sedan för att stratifiera adenomerna i avancerade och icke avancerade adenom. Ett avancerat adenom ansågs således vara ett adenom när det var 1 cm eller större och uppvisade villös histologi eller höggradig dysplasi (6). Histologiska analyser av resektionsmarginaler klassificerades som: fullständig resektion (R0), resektionsmarginaler kunde inte utvärderas fullständigt (Rx) eller kvarvarande lesion fanns (R1). Exklusionskriterierna omfattade patienter som genomgått tjocktarmsoperation eller med anamnes på CRC före baslinjekolonoskopin, inflammatorisk tarmsjukdom eller polyposis syndrom.
Den etiska kommittén godkände studien. Alla författare har fått tillgång till data och har granskat och godkänt det slutliga manuskriptet.
Statistiska analyser
Våra preliminära data tyder på att polyper som upptäcks under övervakningskoloskopi kommer att visas på samma plats som de som observerades vid baslinjen i minst 20 % av fallen. Genom att sätta α till 0,05, power till 80 % och fall-kontrollförhållandet till 1:2 uppskattade vi att 195 patienter skulle behövas.
Kategoriska variabler uttrycktes som frekvens och procent. Kontinuerliga variabler uttrycktes som medelvärde (standardavledning, SD). Kolmogorov-Smirnov-testet användes för att bedöma normaliteten. Kategoriska variabler jämfördes med Chi-kvadrat-testet och kontinuerliga variabler jämfördes med studentens t-test för normalfördelade data eller Mann-Whitney U-test om data inte uppvisade en normalfördelning. För att fastställa överensstämmelsen mellan resultaten av de två koloskopierna användes Cohens Kappa-test. Odds ratio (OR) beräknades med 95 % konfidensintervall (CI); ett CI som inte innefattade 1,0 indikerade att det fanns ett signifikant samband mellan variablerna. Skillnader mellan data ansågs vara statistiskt signifikanta när det tvåsidiga p-värdet var mindre än 0,05.
Först analyserades resultaten från båda koloskopierna. Därefter beräknades överensstämmelsen mellan återfallsfrekvenserna för samma plats i baslinjen och i övervakningskoloskopin. Vi utvärderade vidare möjliga faktorer som kan bidra till polypåterfall på samma plats, till exempel polypegenskaper eller histologiska egenskaper.
Dataanalysen utfördes med hjälp av Statistical Package for Social Sciences-SPSS (SPSS Inc. USA), IBM®, datorprogramvara för Mac OS X (version 21).
Resultat
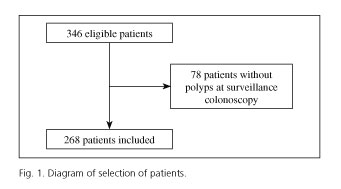
Av de 346 patienter som genomgick två högkvalitativa koloskopier med polyper vid indexkoloskopin hade 78 inga polyper vid övervakningskoloskopin. Därför deltog totalt 268 patienter i studien (fig. 1). Patienterna hade en medelålder på 64 (SD 10) år, med ett spann från 29 till 82 år, med en övervikt av män (64,9 %).
Den genomsnittliga intervallperioden mellan de båda koloskopierna var 37 (SD 20) månader.
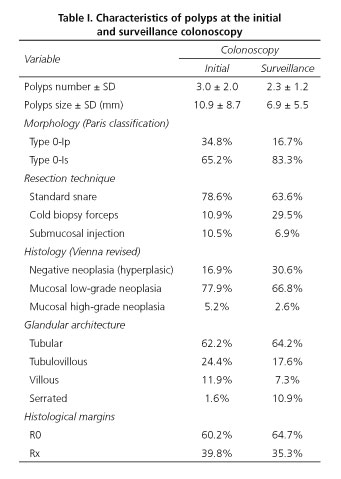
Karaktärsdragen hos de polyper som hittades vid den initiala koloskopin och övervakningskoloskopin beskrivs i tabell I. Vid den första koloskopin var det genomsnittliga antalet upptäckta och resecerade polyper 3,0 (SD 2,0), och vid övervakningskoloskopin var detta antal mindre än 2,3 (SD 1,2). När det gäller polypernas egenskaper var den genomsnittliga storleken vid den första koloskopin 10,9 mm (SD 8,7) och vid den andra koloskopin var polyperna mindre och mätte i genomsnitt 6,9 mm (SD 5,5). Initialt var morfologin typ 0-Ip i 34,8 % och typ 0-Is i 65,2 %; och vid den andra koloskopin fortsatte vi att observera att den fastsittande morfologin var dominerande men i en högre andel, med tanke på att procentandelen typ 0-Is-polyper var 83,3 %. Körtelarkitekturen var likartad i båda fallen, med undantag för den högre förekomsten av serrerade polyper vid övervakningskoloskopi (1,6 % jämfört med 10,9 %).
Vid den första koloskopin hade 42,5 % av patienterna polyper i proximala kolon, 75,0 % i distala kolon och 30,2 % i rektum. Vid övervakningskoloskopin var fördelningen liknande: 52,6 % i proximala kolon, 60,1 % i distala kolon och 25,0 % i rektum. Den totala överensstämmelsen när det gäller lokalisering av polyper mellan koloskopier var 44 %. Tabell II visar sannolikheten för återfall i samma kolonavsnitt. För alla segment av tjocktarmen finns det en ökad risk för återkommande polyper på samma plats. Denna risk är likartad för både proximala (OR 3,5; CI 2,1-6,0) och distala kolonavsnitt (OR 3,8; CI 2,1-6,8), följt av rektum (OR 2,6; CI 1,5-4,6), p < 0,001. Kappa-värdena var 0,29 (95 % CI; 0,19-0,41) och 0,27 (0,16-0,38) för det proximala respektive distala kolonet, vilket visar på en ganska god överensstämmelse, och 0,20 (CI 0,08-0,33) för rektum, vilket innebär en dålig överensstämmelse, p < 0.001 (tabell III).


Analysen av de olika faktorer som kan bidra till att polyper återkommer på samma plats visar inga statistiskt signifikanta skillnader (tabell IV). Det fanns dock en liten övervikt för högre recidiv vid samma segment när resektion utfördes med submucosal injektion (70,4 %), jämfört med biopsitång (68,3 %) och snara (61,4 %) och för hyperplastiska polyper (75,7 %), jämfört med polyper med låggradig (66,7 %) eller höggradig dysplasi (66,7 %). Det fanns ingen skillnad i de histologiska marginalerna, och även om Rx (68,1 %) var vanligare än fullständig resektion (53,3 %) hade detta ingen statistisk betydelse (p = 0,511). Det fanns inte heller någon skillnad i sannolikheten för återfall på samma plats efter stratifiering i avancerade adenom (70,8 %), icke avancerade adenom (61,9 %) och hyperplastiska adenom (75,7 %), p = 0,216. Tiden mellan koloskopierna hade inget samband med återfall av polyper på samma plats (36 vs 38 månader).

Diskussion
I vår studie fann vi ett signifikant samband mellan den initiala polyppositionen och den återkommande. För alla kolonavsnitt ger förekomsten av polyper vid basal koloskopi en signifikant risk för återfall på samma plats vid övervakningskoloskopi. Denna risk är ungefär fyra gånger högre i det distala kolonet, tätt följt av det proximala kolonet. Det finns flera möjliga förklaringar till denna höga grad av överenskommelse om lokalisering. För det första kan koloskopisten hos patienter med en historia av polypresektion öka uppmärksamheten på platser där tidigare polyper upptäckts. En annan orsak är relaterad till polypåterkomst på grund av ofullständigt avlägsnande. I syfte att minska ofullständig resektion som en återfallsfaktor exkluderade vi platta och större lesioner. I den här studien hade inte heller de histologiska marginalerna för resektion (fullständig respektive kvarvarande lesion) någon betydelse för återfallsfrekvensen. Missfrekvensen för polyper är cirka 20 % och den ökar i takt med att storleken på lesionerna minskar (14). Missade adenom kan också förklara de återkommande polyperna, även om vi försökte minska denna faktor genom att endast välja koloskopier av hög kvalitet. En annan möjlighet för denna höga grad av lokaliseringsöverensstämmelse är relaterad till utvecklingen av nya lesioner. Dessa nya lesioner kan bero på avsaknaden av en hämmande effekt efter polypborttagning (7) eller på lokala effekter som gynnar karcinogenes, t.ex. upprepad/permanent inflammation eller skada (9). Dessutom kan dessa nya lesioner vara förknippade med en annan och snabbare väg för karcinogenes. Det har visats att intervallcancer efter polypektomi uppträder oftare än förväntat i segmentet med tidigare polypektomi (9). Denna studie förstärker dessa tidigare resultat genom att visa att polyper också tenderar att återkomma på samma plats. När det gäller intervallcancer visar studier att 70-80 % främst beror på saknade lesioner snarare än nya lesioner (15,16).
Det är känt att återfallsfrekvensen för adenom uppskattas till cirka 30-40 %, 3-4 år efter den första koloskopin (8,17). Risken för återkommande adenom vid övervakningskoloskopin beror på fynden vid den föregående koloskopin. Risken är högre vid avancerade och/eller multipla adenom (7,10,18). Med detta antagande analyserade vi polypernas egenskaper (storlek, morfologi och histologi), resektionsmarginalerna (förekomst av hyperplasisk eller adenomatös vävnad) och den teknik som användes för att utföra polypektomin. Vi fann inga statistiskt signifikanta faktorer som kunde bidra till återfall på samma plats. Inte heller efter stratifiering av adenom i avancerade adenom fanns det någon recidivfaktor.
Det verkar inte finnas något samband mellan sannolikheten för upptäckt av adenom i övervakningskoloskopin efter en koloskopi med endast hyperplasiska polyper (19). I vår studie fann vi att det vid den andra koloskopin fanns ett ökat antal hyperplasiska polyper, även om den histologiska typen inte bidrog till recidiv på samma plats. Detta kan motiveras som en lokal reaktion som inducerar hyperproliferation av slemhinnan, eftersom hyperplastiska polyper består av normala cellkomponenter. Hyperplastiska lesioner kan få mutationer, särskilt K-ras, men även BRAF-mutationer, som kan omvandla dessa lesioner till cancer (20-22). Inte bara hyperplastiska polyper utan även serrerade polyper har CRC-potential (23). Serrerade polyper identifierades oftare vid den andra koloskopin (även om de inte bidrog som en recidivfaktor). Detta kan förklaras av skillnader vid den tidpunkt då patologerna gjorde sin analys. Serrerade polyper som vanligtvis klassificeras som hyperplastiska klassificeras nu i samma grupp som serrerade tumörer. Sessila serrerade polyper eller serrerade adenom är normalt små eller platta, de kan växa snabbare och de kan utvecklas genom en annan väg för karcinogenes. De är också förknippade med en högre grad av ofullständigt avlägsnande (24,25).
Det finns begränsningar i vår studie. Studiepopulationen omfattar ett litet urval, retrospektivt registrerad, och den utfördes på ett universitetssjukhus, så dessa resultat kanske inte är representativa för den allmänna befolkningen. I vår studie inkluderade vi varken potentiella riskfaktorer som är förknippade med utveckling av cancer/polyper såsom cigarettrökning (26), konsumtion av rött kött och högt kroppsmasseindex (27) eller skyddsfaktorer såsom acetylsalicylsyra eller icke-steroida antiinflammatoriska läkemedel (28) och fruktintag (29). Även om högutbildade koloskopister utförde alla koloskopier inkluderade teamet flera läkare som bytte från baslinjen till övervakningskoloskopin. Dessutom måste, som tidigare nämnts, möjligheten att missa adenom alltid beaktas.
Slutsatsen är att det tycks finnas ett signifikant samband i polypernas placering vid baseline- och övervakningskoloskopi. Detta kan få framtida konsekvenser när det gäller det tekniska utförandet och noggrannheten av koloskopierna, inklusive varning för en försiktig inspektion av de segment där polyper tidigare avlägsnats. Det skulle också vara intressant att undersöka om det finns en fälteffekt genom att jämföra de histologiska och molekylära egenskaperna hos slemhinnan nära de borttagna polyperna med den kvarvarande slemhinnan. Dessa resultat kräver ytterligare forskning, helst genom en prospektiv och multicenterstudie med en större studiepopulation.
1. Giacosa A, Frascio F, Munizzi F. Epidemiologi för kolorektala polyper. Tech Coloproctol 2004;2:s243-7. DOI: 10.1007/s10151-004-0169-y.
2. Ferlay J, Soerjomataram I, Dikshit R, et al. Cancerincidens och dödlighet i världen: Källor, metoder och viktiga mönster i GLOBOCAN 2012. Int J Cancer 2014;136(5):E359-86. DOI: 10.1002/ijc.29210.
3. Zauber AG, Winawer SJ, O’Brien MJ, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med 2012;366:687-696. DOI: 10.1056/NEJMoa1100370.
4. Brenner H, Chang-Claude J, Seiler CM, et al. Skydd mot kolorektal cancer efter koloskopi: En befolkningsbaserad fall-kontrollstudie. Ann Intern Med 2011;154:22-30. DOI: 10.7326/0003-4819-154-1-201101040-00004.
5. Baxter N, Goldwasser M, Paszat L, et al. Association of colonoscopy and death from colorectal cancer. Annals of Internal Medicine 2009;150:1-8. DOI: 10.7326/0003-4819-150-1-200901060-00306.
6. Lieberman DA, Rex DK, Sidney JW, et al. Riktlinjer för koloskopiövervakning efter cancerresektion: A consensus update by the American Cancer Society and the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2012;143:844-57. DOI: 10.1053/j.gastro.2012.06.001.
7. Pinsky P, Schoen R, Weissfeld J, et al. Utfallet av övervakningskoloskopi beroende på adenomhistoria och tid till undersökning. Clin Gastroenterol Hepatol 2009;7:86-92. DOI: 10.1016/j.cgh.2008.07.014.
8. Lieberman DA, Weiss DG, Harford WV, et al. Five year colon surveillance after screening colonoscopy. Gastroenterology 2007;133:1077-85. DOI: 10.1053/j.gastro.2007.07.006.
9. Brenner H, Chang-Claude J, Jansen L, et al. Colorectal cancers occurring after colonoscopy with polyp detection: Platser för polyper och platser för cancer. Int J Cancer 2013;133:1672-9. DOI: 10.1002/ijc.28166.
10. Martínez ME, Samplier R, Marshall JR, et all. Adenomegenskaper som riskfaktorer för återfall av avancerade adenom. Gastroenterology 2001;120:1077-83. DOI: 10.1053/gast.2001.23247.
11. Avidan B, Sonnenberg A, Schnell TG, et al. Ny förekomst och återkomst av neoplasmer inom 5 år efter en screeningkoloskopi. Am J Gastroenterol 2002;97:1524-9. DOI: 10.1111/j.1572-0241.2002.05801.x.
12. Deltagare i workshopen i Paris. Paris endoskopiska klassificering av ytliga neoplastiska lesioner: matstrupe, magsäck och tjocktarm: 30 november-1 december 2002. Gastrointest Endosc 2003;58:S3-S43.
13. Schlemper RJ, Riddell RH, Kato Y, et al. Wien-klassificeringen av gastrointestinal epitelial neoplasi. Gut 2000;47:251-5. DOI: 10.1136/gut.47.2.251.
14. Heresbach D, Barrioz T, Lapalus MG, et al. Miss rate for colorectal neoplastic polyps: a prospective multicenter study of back-to-back video colonoscopies. Endoscopy 2008;40:284-90. DOI: 10.1055/s-2007-995618.
15. Pohl H, Robertson D. Colorectal cancers detected after colonoscopy frequently result from missed lesions. Clin Gastroenterol Hepatol. 2010;8:858-64. DOI: 10.1016/j.cgh.2010.06.028.
16. Singh H, Nugent Z, Demers AA, et al. Rate and predictors of early/missed colorectal cancers after colonoscopy in Manitoba: a population-based study. Am J Gastroenterol 2010;105:2588-96. DOI: 10.1038/ajg.2010.390.
17. Schoen RE. Övervakning efter positiva och negativa koloskopiundersökningar: frågor, resultat och användning. Am J Gastroenterol 2003; 98:1237-46.
18. Huang Y, Gong W, Su B, et al. Recidiv och övervakning av kolorektala adenom efter polypektomi i en sydkinesisk befolkning. J Gastroenterol 2010;45:838-45. DOI: 10.1007/s00535-010-0227-3.
19. Laiyemo AO, Murphy G, Sansbury L, et al. Hyperplastic polyps and the risk of adenoma recurrence in the Polyp Prevention Trial. Clin Gastroenterol Hepatol 2009;7:192-7. DOI: 10.1016/j.cgh.2008.08.031.
20. Chan TL, Zhao W, Leung SY, et al. BRAF- och KRAS-mutationer i kolorektala hyperplastiska polyper och serrerade adenom. Cancer Res 2003;63:4878-81.
21. Spring KJ, Zhao ZZ, Karamatic R, et al. Hög prevalens av ojämn serrerade adenom med BRAF-mutationer: En prospektiv studie av patienter som genomgår koloskopi. Gastroenterology 2006;131:1400-7. DOI: 10.1053/j.gastro.2006.08.038.
22. Morimoto LM, Newcomb PA, Ulrich CM, et al. Riskfaktorer för hyperplastiska och adenomatösa polyper: Bevis för malign potential? Cancer Epidemiol Biomarkers Prev 2002;11:1012-8.
23. Snover DC. Uppdatering om den serrerade vägen till kolorektalcancer. Hum Pathol 2011;42:1-10. DOI: 10.1016/j.humpath.2010.06.002.
24. Pohl H, Srivastava A, Bensen SP, et al. Incomplete polyp resection during colonoscopy-Results of the complete adenoma resection (CARE) study. Gastroenterology 2013;144:74-80. DOI: 10.1053/j.gastro.2012.09.043.
25. Lazarus R1, Junttila OE, Karttunen TJ, et al. Risken för metakrona neoplasier hos patienter med serrerat adenom. Am J Clin Pathol 2005;123:349-59. DOI: 10.1309/VBAGV3BR96N2EQTR.
26. Botteri E, Iodice S, Bagnardi V, et al. Rökning och kolorektalcancer: En metaanalys. JAMA 2008;300:2765-78. DOI: 10.1001/jama.2008.839.
27. Song X, Pukkala E, Dyba T, et al. Body mass index and cancer incidence: FINRISK-studien. Eur J Epidemiol 2014;29:477-87. DOI: 10.1007/s10654-014-9934-z.
28. Din FV, Theodoratou E, Farrington SM, et al. Effekten av aspirin och NSAID på risk och överlevnad av kolorektalcancer. Gut 2010; 59:1670-9. DOI: 10.1136/gut.2009.203000.
29. Koushik A, Hunter DJ, Spiegelman D, et al. Frukt, grönsaker och risk för tjocktarmscancer i en poolad analys av 14 kohortstudier. J Natl Cancer Inst 2007;99:1471-83. DOI: 10.1093/jnci/djm155.