Abstract
Syftet med den här studien, som fokuserar på ett litet antal fall, är att behandla angiosarkom i bröstet, som representerar mindre än 1 % av alla mjukdelstumörer i bröstet, och slutligen dela med oss av våra erfarenheter. Som en följd av bröstbevarande terapi (BCT) som är standardbehandlingen nuförtiden har en ny typ av angiosarkom lyfts fram: Radiation-Induced Angiosarcoma (RIAS).
Här rapporteras en retrospektiv analys av RIAS-patienters karakteristiska egenskaper, tillsammans med en redogörelse för den integrerade behandlingen och utfallet av sex fall av RIAS som behandlades på vår institution från 2013 till 2018.
Bröstangiosarkom som en följd av kirurgi och radioterapi har sällan registrerats, men det är en dokumenterad komplikation till strålbehandling av bröstcancer, med hög recidivfrekvens och dåligt utfall.
Det förblir en utmaning kliniskt, radiologiskt och histologiskt, och därför krävs ett högt index av misstanke hos mottagliga patienter. Enkel mastektomi är det primära behandlingsalternativet, men ett ökande antal studier om användning av strålbehandling och kemoterapi, var och en med varierande grad av framgång, fokuseras. Återbestrålning kan övervägas för att öka den lokala kontrollen, medan kemoterapi kan övervägas för fall i ett mer avancerat stadium.
Abkortning
RIAS: Radiation-Induced Angiosarcoma; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: Magnetic Resonance Imaging; IMRT: Intensitetsmodulerad strålbehandling
Nyckelord
Bröstangiosarkom (AS), strålningsinducerat angiosarkom (RIAS), radikal mastektomi (RM), strålningsinducerade tumörer, adjuvant strålbehandling, Intensitetsmodulerad strålbehandling (IMRT)
Introduktion
I detta arbete diskuteras diagnos, hantering och resultat av RIAS hos ett litet antal patienter med bröstcancer.
Som en mycket sällsynt vaskulär tumör kan angiosarkom (AS) i bröstet delas in i primärt, om det uppstår utan en känd föregångare, eller sekundärt, om det uppstår på platsen för tidigare bestrålad hud, i vilket fall det är känt som ett strålningsinducerat angiosarkom (RIAS) i bröstet . Men det finns fortfarande inga evidensbaserade riktlinjer för den ideala behandlingen av angiosarkomer.
I de patienter som genomgår bröstbevarande kirurgi med adjuvant strålbehandling varierar den uppskattade incidensen av RIAS mellan 0,05 och 0,3 %, vilket motsvarar mindre än 1 % av brösttumörerna och ungefär 3 % av alla sarkom i mjukvävnaden.
Incidensen av RIAS tycks öka, vilket kanske återspeglar den långa latenstiden för utveckling av dessa tumörer efter det utbredda införandet av adjuvant strålbehandling för bröstcancer.
Diagnosen av RIAS i bröstet fördröjs ofta på grund av dess godartade utseende och svårigheten att särskilja den från ospecifika hudförändringar som inducerats av tidigare strålning eller från en annan sjukdom . De radiologiska fynden är också ofta ospecifika. Även om RIAS vanligtvis utvecklas 10 år efter strålbehandling för bröstcancer kan latenstiden variera från 6 månader till 20 år , vilket får vissa författare att tro att RIAS förmodligen underrapporteras och att den verkliga incidensen därför är högre. Eftersom förekomsten av bröstcancer ökar har användningen av bröstbevarande kirurgi följt av strålbehandling ersatt radikal mastektomi som standardbehandling. Den associerade incidensen av RIAS ökar också, med en beräknad kumulativ incidens på 0,9-3,2 per 1 000 bröstcancerfall . I en stor befolkningsbaserad kohortstudie var en historia av tidigare strålbehandling som behandling för bröstcancer förknippad med en 26-faldig ökning av risken att utveckla angiosarkom jämfört med icke-bestrålade kontrollgrupper . Prognosen för patienter med RIAS är fortfarande dålig, med en total femårsöverlevnad som varierar mellan 27 och 48 %. Trots att RIAS först beskrevs i början av 1920-talet är dess molekylära biologi fortfarande kontroversiell och det finns därför ingen riktad terapi tillgänglig.
För närvarande förespråkas ofta aggressiv kirurgisk resektion som den bästa behandlingen. Det saknas uppgifter som bevisar effekten av adjuvant kemoterapi .
Kirurgi, i form av bred excision eller mastektomi, är den viktigaste behandlingen vid lokaliserad sjukdom. Vissa studier har rapporterat ett samband mellan R0-marginaler och förbättrad överlevnad, även om det inte har visats vara oberoende av andra biologiska faktorer, t.ex. tumörstorlek . Det finns vissa bevis för att neoadjuvant kemoterapi kan förbättra resultaten vid behandling av angiosarkom, vars sällsynthet begränsar vår kunskap till fallrapporter eller små retrospektiva fallserier .
För att karaktärisera en population av patienter med RIAS, som behandlades på vårt sjukhus under en femårsperiod, har vi utfört en retrospektiv studie som analyserar användbarheten av mammografi, ultraljud och magnetisk resonanstomografi (MRI) för vår diagnos .
Vårt arbete har rapporterats i linje med SCARE-kriterierna .
Material och metoder
Vår fallserie gäller patienter med histologiskt bevisat angiosarkom i bröstet, utvecklat efter strålbehandling för bröstcancer, mellan 2013 och 2018, och analyserar behandlingsstrategier med ett multidisciplinärt tillvägagångssätt.
De drabbade patienterna, sex kvinnor med strålningsinducerat angiosarkom i bröstet, identifierades genom en omfattande sökning under den ovannämnda perioden i cancerregistret på vår institution, vid universitetssjukhuset i Catania. Medelåldern var 70 år, intervall: 59-79 år. Patienterna hade utfört den tidigare diagnostiska och terapeutiska hanteringen på olika institutioner, så att informationen inte är tillgänglig för alla. Beskrivning av patienternas egenskaper och behandlingsförfaranden som utförts efter RIAS-diagnosen beskrivs i tabell 1. Alla patienter hade genomgått bröstbevarande behandling vid tidpunkten för diagnosen, med adjuvant strålbehandling administrerad genom konventionell 3-dimensionell konform strålbehandling till en total dos på 50 Gy, med daglig fraktionering på 2 Gy, med eller utan en tumörbäddsförstärkning på 10 Gy. Tumörerna var högersidiga hos 3 patienter och vänstersidiga hos de övriga 3. Under den adjuvanta behandlingen fick fem av sex patienter antracyklinbaserad systemisk kemoterapi i enlighet med institutionella riktlinjer, medan alla patienter fick adjuvant hormonbehandling med tamoxifen/aromatashämmare. Ingen patient hade HER2-positiv cancer vid tidpunkten för diagnosen.
Under uppföljningen, efter en medianperiod på 7,6 år (intervall: 5-11 år), ställdes diagnosen ipsilateralt angiosarkom i bröstet: de vanligaste tecknen som patienterna uppvisade vid insjuknandet var röd-violettfärgade hudknölar, belägna i anslutning till bestrålningsfält, med en måttligt varierande tillväxthastighet från ett par veckor till 4-6 månader. Alla patienter fick en histologisk bekräftelse på sekundärt angiosarkom och en radikal mastektomi utfördes i samtliga fall. För att diagnostisera RIAS följdes kriterierna från Cahan och Arlen: sarkom som uppstår inom det tidigare bestrålade fältet, en latensperiod på minst tre år mellan strålbehandling och utvecklingen av sarkomet och en histologisk distinktion mellan det sekundära sarkomet och den primära neoplasmen. Alla sex patienterna fick en fullständig radiologisk undersökning med mammografi, ultraljud och MR (hos 4/6 patienter) i ett försök att bekräfta den kliniska misstanken om RIAS, men inga patognomoniska egenskaper identifierades. Det växande intresset i den vetenskapliga litteraturen för att identifiera specifika kännetecken för ”strålningssignatur” har ännu inte resulterat i konsoliderade uppgifter. Tre av de sex patienter som lyfts fram i vår fallserie var föremål för en immunohistokemisk studie för utvärdering av MYC-uttryck, som hade visat ett högt uttryck på sådana patienter. I tabell 1 redovisas även tumörernas histologiska egenskaper. Datum för RIAS-diagnosen definierades som den dag då den histologiska diagnosen ställdes. Latensperioden definierades som tiden från den första strålningssessionen och datumet för RIAS-diagnosen. Endast en patient uppvisade synkrona metastaser (i lungan) vid RIAS-diagnosen, medan övriga fem patienter endast uppvisade bröstsjukdom.
Tabell 1: Patienternas egenskaper och behandlingsförfaranden. Visa tabell 1
Alla patienter som genomgick kirurgi på vårt sjukhus diskuterades vid ett multidisciplinärt möte om sarkom i ett preoperativt skede. Patienterna klassificerades som patienter med resektabel sjukdom om den preoperativa bedömningen visade att en negativ marginal på 2 cm eller mer kunde uppnås genom kirurgi med eller utan plastikkirurgisk rekonstruktion i form av en enkel pedikulerad eller fri myokutan klaff. Om de önskade negativa marginalerna krävde en mer omfattande rekonstruktion, t.ex. med omfattande resurfacing genom stor hudtransplantation, skulle patienten klassificeras som oskadlig.
Snabbt progressiv sjukdom, där sjukdomsvolymen ökade under en tidsperiod på 2-3 veckor från att vara lämplig för enbart mastektomi eller i kombination med en pedikulerad klaff till att kräva mer omfattande rekonstruktion, bedömdes också som oskadlig i onkologiska termer.
Preoperativa biopsier utfördes för att bekräfta förekomsten av AS och utesluta andra sjukdomar.
Makroskopiskt fullständig resektion ansågs av den opererande kirurgen. Histologiskt klassificerades resektionen som R0 (mikroskopiskt negativ) om de negativa marginalerna var mer än 1 cm i omkrets eller R1 (mikroskopiskt positiv) om tumören sträckte sig till eller inom mindre än 1 cm från resektionsmarginalen.
Fyra patienter rekryterades för omedelbar återbestrålning, medan en patient behandlades efter 13 månader då ett parietalt återfall inträffade (hon hade vägrat omedelbar återbestrålning), den sista patienten uteslöts från återbestrålning eftersom han hade uppnått dosgränserna för hjärtat vid den tidigare behandlingen. Beslutet om administrering av adjuvant kemoterapi fattades från fall till fall, baserat på tillgängliga uppgifter om tidigare behandlingar och patienternas prestationsstatus. En patient fick fyra cykler av kemoterapi med epirubicin-ifosfamid, en patient fick enbart epirubicin i sex cykler, tre patienter uteslöts av medicinska skäl (ålder, komorbiditeter eller toleransdos av antracykliner som redan tidigare uppnåtts). En patient fick paclitaxel varje vecka i 12 cykler på grund av synkrona lungmetastaser.
Radioterapi administrerades med hänsyn till de doser som mottagits från friska vävnader vid tidigare bestrålning och tidigare administrering av antracykliner. Av dessa skäl valde vi att utföra återbestrålningen med hjälp av intensitetsmodulerad strålbehandling (IMRT, se figur 1), med en step-and-shoot-teknik, i enlighet med våra institutionella rutiner . Den stråldos och det fraktioneringsschema som användes varierade: två patienter fick konventionell fraktionering till 50 Gy, två patienter fick 40 Gy (eftersom tiden från den tidigare bestrålningen var kort och neoplasman var lokaliserad på vänster bröst), en patient 35 Gy i fraktioner om 5 Gy en gång i veckan (på grund av minskad klinisk följsamhet).
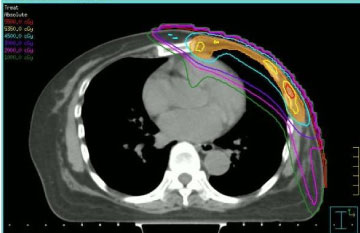 Figur 1: Tvärgående CT-bild med step-and-shot intensitetsmodulerad dosfördelning. Visa figur 1
Figur 1: Tvärgående CT-bild med step-and-shot intensitetsmodulerad dosfördelning. Visa figur 1
Resultat
Ingen positiva marginaler rapporterades hos de patienter som hade fått radikal mastektomi utförd av samma kirurgiska team.
Efter radikal mastektomi fick patienterna behandling som planerat, utan några avbrott, både för kemoterapi och strålbehandling. Vid en medianuppföljningstid på 22 år (intervall: 1,5-4 år) är tre patienter vid liv, utan tecken på återfall eller progressiv sjukdom. En patient med synkrona lungmetastaser vid diagnosen får fortfarande aktiv onkologisk behandling. En patient utvecklade lung- och benmetastaser, men hon är fortfarande vid liv vid tidpunkten för arbetets inlämnande. De två sista patienterna utvecklade lungmetastaser, varav en i samband med lokalt återfall, och avled efter 8-10 månader (fördelningen av patienternas egenskaper i förhållande till sjukdomspresentation och erhållen behandling beskrivs i tabell 1). Sammantaget var den sjukdomsfria överlevnaden 14 månader för fem patienter utan systemisk sjukdom vid diagnosen av RIAS, medan den progressionsfria överlevnaden för synkrona metastaserande patienter vid diagnosen var 12 månader.
Som vi kan förvänta oss noterades sämre överlevnadsresultat, som rapporterats i litteraturen, hos patienter som presenterade en lokalt avancerad sjukdom olämplig för kirurgisk behandling jämfört med fallen i vår serie. Dessa faktorer understryker vikten av tidig diagnos hos RIAS-patienter. Angiosarkomer presenterar sig ofta smygande med lila eller röda hudförändringar och kan lätt misstas för blåmärken eller godartade hudförändringar vilket leder till försenad utredning och diagnos. Tidig upptäckt och snabb remittering kan potentiellt minska antalet patienter som uppvisar oskadlig sjukdom och förbättra både lokal och avlägsen sjukdomskontroll.
Diskussion
Strålningsinducerade tumörer uppstår typiskt sett i sammanhanget eller i kanten av bestrålningsfältet där dosen inte är enhetlig och kan resultera i lägre än vad som är nödvändigt för att inducera celldestruktion, eller orsaka mutationer som kan leda till karcinogenesprocessen. Som en effekt av joniserande strålning ger kemiska och biokemiska förändringar i levande organismer upphov till funktionella och morfologiska förändringar av cellerna som orsakar biologisk skada. Varje cell som kan föröka sig kan bli potentiellt cancerframkallande; om de celler som uppvisar kromosomala modifieringar undgår normala cellkontroller kan karcinogenes uppstå.
Sannolikheten för att utveckla tumörer hos patienter som genomgår strålbehandling för att behandla bröstcancer är mycket låg och kan inte begränsa användningen av strålbehandling när den är indicerad. Stråldoser över 50 Gy inducerar celldöd och lägre doser (
Antaliga studier har föreslagit ett samband mellan uppkomsten av mjukdelssarkomer och de strålbehandlingar som utförts för att behandla brösttumörer. Strålbehandling ökar risken för att utveckla mjukdelssarkomer och i synnerhet för att utveckla angiosarkom . RIAS utgör ungefär mindre än 1 % av brösttumörerna. Radioinducerat angiosarkom har många kliniska manifestationer: Patienterna uppvisar ofta asymtomatiska hudförändringar som knappast kan särskiljas från de vanliga aktiniska förändringar som kan hittas efter strålbehandling av bröstet. Patienterna uppvisar ofta en palpabel svullnad, ett lilarött område som liknar ett hematom. Angiosarkom kan förväxlas med godartade manifestationer som angiom eller atypisk telangiektasi. Lila papler eller erytematösa knutor kan också förekomma.
Trots alla terapeutiska insatser varierar femårsöverlevnaden från 27 % till 62,8 % (2-3). Även om RIAS vanligtvis utvecklas 10 år efter strålbehandlingar för bröstcancer kan latenstiden variera från 6 månader till 20 år. Radioinducerat angiosarkom kan inte särskiljas från spontant angiosarkom men vissa skillnader kan bedömas: Lae, et al. jämförde c-myc-amplifieringen på kromosom 8q24.21 i 32 RASB-prover och 15 sporadiska angiosarkom-prover.
I vår serie upplevde patienterna ospecifika sjukdomstecken, men diagnosen ställdes snabbt i majoriteten av fallen. Latencyperioden var i enlighet med den som rapporterats i litteraturen, med en mediantid på 76 år.
RIAS är känt för att ha en hög recidivfrekvens. Lokalt återfall, antingen i tumörbädden eller längs det kirurgiska ärret, rapporteras upptäckas i en majoritet (96 %) av fallen av RIAS. Detta beror troligen på multifokal tillväxt av RIAS eller rester av malign vävnad efter operation, även med negativa operationsmarginaler. Metastatisk sjukdom, oftast till lungor och lever, kan förekomma samtidigt eller kort efter lokala återfall . Abbott, et al. granskade retrospektivt alla fall av RIAS som publicerats från och med 2017 och sammanfattade uppgifterna . Författarna fann att den lokala recidivfrekvensen var 59 % och att mediantiden till recidiv var 6 månader (intervall 1-78 månader). De fann också att metastatisk sjukdom vanligtvis föregicks av minst ett lokalt återfall och att de vanligaste platserna var lungorna, det kontralaterala bröstet och skelettet. Vidare tydde deras histologiska genomgång av 42 fall på att dåligt differentierad RIAS var förknippad med en hög risk för metastasering, medan väldifferentierade tumörer uppvisade en högre risk för lokalrecidiv snarare än för fjärrmetastaser.
Stålningsinducerat sarkom är en sällsynt men mycket aggressiv neoplasm. Dess hantering är en fråga om debatt, eftersom det inte finns några behandlingsriktlinjer, prognosen är dålig och 5-årsöverlevnaden varierar kraftigt, vilket rapporterats tidigare . Icke desto mindre förespråkas ofta aggressiv kirurgisk resektion som den bästa behandlingen.
Kirurgi, i form av mastektomi med eller utan plastisk rekonstruktion, är den bästa behandlingen för patienter som uppvisar en lokaliserad sjukdom. I de serier av patienter som behandlas är det möjligt att uppnå mikroskopiskt kompletta (R0) resektionsmarginaler hos mer än 80 %. RIAS uppträder vanligtvis som multifokala lesioner. Denna patologis tendens att skapa mikrosatellitdepåer kan bidra till svårigheten att uppnå lokal kontroll.
Vikten av att utföra en fullständig patologisk resektion har betonats i litteraturen, även om inga standardriktlinjer om rekommenderat röjningsavstånd har publicerats. I den aktuella serien visade det sig att de som utvecklade lokalt återfall hade närmare marginaler än de som inte gjorde det. Marginalstatus visade sig dock inte vara oberoende prognostisk för onkologiska resultat i denna serie. Detta skulle kunna tyda på att förmågan att uppnå större marginaler beror på andra biologiska tumörfaktorer som också bestämmer utfallet, t.ex. storleken. Det är troligt att tumörbiologin huvudsakligen är ansvarig för utfallet i RIAS, även om den initiala operationen bör syfta till makroskopisk rensning, bör man varna för att uppnå större negativa marginaler inte nödvändigtvis är liktydigt med förbättrade patientutfall.
Trots det ökande antalet studier som fokuserar på kemoterapi och radioterapi, oavsett om de är neoadjuvanta eller adjuvanta, är deras roll fortfarande oklar. Det saknas uppgifter som bevisar effekten av adjuvant kemoterapi, och nya uppgifter har visat att strålbehandling kan vara användbar för att förhindra återfall . Adjuvant strålbehandling efter kirurgi ger enligt Johnstone et al. bättre lokal kontroll. IMRT:s roll vid behandling av bröstväggen utvärderas för närvarande, eftersom den kan minska förekomsten av strålningstoxicitet genom att minska bestrålningen av riskorgan (OAR). I en jämförelsestudie av dosimetri rapporterar författarna att IMRT-planen för bröstväggen och målet, jämfört med konventionella behandlingar, gör det möjligt att sänka den maximala dosen och öka den minimala dosen, vilket resulterar i bättre överensstämmelse och jämnhet i målvolymen .
Kemoterapins roll och effektivitet har inte fastställts, eftersom de tillgängliga uppgifterna kommer från små provgrupper, varifrån inga definitiva slutsatser kan dras, men troligen skulle patienter med högre malignitetsgrad, G3 och med återfall kunna dra störst nytta av neo- eller adjuvant kemoterapi.
Användningen av neo/adjuvant kemoterapi visade sig också vara förknippad med förbättrad lokal sjukdomskontroll i en stor retrospektiv serie av patienter med strålningsinducerade sarkomer från alla områden, även om den inte var förknippad med förbättrad frekvens av systemiska återfall eller överlevnad . Adjuvant kemoterapi visade sig inte ge någon fördel när det gäller lokal kontroll eller total överlevnad i en studie av högrisk sarkomer i mjuka vävnader som behandlats med kirurgi och strålning . Det finns därför begränsade bevis för att neo/adjuvant kemoterapi ger en överlevnadsfördel vid RIAS, även om den säkerligen kan vara användbar som induktionsbehandling före kirurgi hos personer med lokalt avancerad sjukdom och dessutom kan ge patienterna en effektiv lindring av sjukdomen. Riktade terapier kan erbjuda en alternativ behandling hos patienter med progressiv sjukdom.
I vår serie har vi, som en följd av den höga tendensen till lokalt återfall av denna neoplasm, beslutat att föreslå alla patienter en andra bestrålning, utom en av dem på grund av de ovan nämnda dosimetriska problemen. En patient vägrade omedelbar återbestrålning och behandlingen genomfördes vid återfall. Det var inte möjligt att programmera en homogen strålbehandling för alla patienter på grund av att urvalet var heterogent när det gäller tidigare använda bestrålningsdoser, dålig klinisk följsamhet i ett fall och framför allt brist på tydliga indikationer i litteraturen och riktlinjerna. I vilket fall som helst beslutade vi att ge behandlingen med hjälp av en intensitetsmodulerad teknik för att möjliggöra en adekvat dosfördelning, en minskning av dosexponeringen av de omgivande friska vävnaderna, särskilt för den underliggande lungparenkymet och hjärtat.
Slutsatser
Radioterapi vid behandling av bröstcancer är förknippad med en ökad risk för efterföljande sarkom, men riskprocenten är mycket låg.
RIAS är en sällsynt, aggressiv mjukdelslesion med begränsade behandlingsalternativ och hög frekvens av både lokala och systemiska återfall.
Det krävs noggrann observation efter adjuvant strålbehandling. Standardbehandlingen omfattar kirurgi med enkel mastektomi och adjuvant strålbehandling. Kemoterapin kan ha en roll för att minska lokalt avancerad sjukdom även om den inte har någon bevisad effekt på överlevnaden.
Angiosarkom är betydligt vanligare i fall som behandlas med strålbehandling och förekommer särskilt i eller i anslutning till strålningsfältet. Den lilla skillnaden i risk för efterföljande sarkom för bröstcancerpatienter som får strålbehandling ersätter inte fördelen med strålbehandling.
Vår serie är dock för liten för att dra slutgiltiga slutsatser och detta är en begränsning av studien. Ytterligare utvärdering är nödvändig, även genom ett större antal fallstudier, för att få en bättre klassificering av patologin och möjliggöra en mer korrekt multidisciplinär hantering.
Intressekonflikter
Ingen av författarna har några intressekonflikter att avslöja.
Källor till finansiering
Ingen.
Ett etiskt godkännande
Godkännande har getts av Catanias universitetets etikkommitté.
Informerat samtycke
Ett skriftligt informerat samtycke har erhållits från patienten för publicering av denna fallbeskrivning och tillhörande bilder. En kopia av det skriftliga samtycket finns tillgänglig för granskning av chefredaktören för denna tidskrift på begäran.
Författarbidrag
Trovato Agata: Granskning och redigering av artikeln.
Registrering av forskningsstudier
Ingen.
Offentliggörande
Ingen av författarna har något att offentliggöra.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Primary and secondary angiosarcoma of the breast. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Långsiktiga resultat hos patienter med strålningsassocierade angiosarkom i bröstet efter kirurgi och strålbehandling för bröstcancer. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma: a large-scale single-institution review. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Cutaneous radiation-associated angiosarcoma of the breast: poor prognosis in a rare secondary malignancy. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Clinical management of secondary angiosarcoma after breast conservation therapy. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Radiation-induced sarcoma of the breast: a systematic review. Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Ökad risk för mjukdelssarkom efter strålbehandling hos kvinnor med bröstcancer. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Strålningsassocierat angiosarkom efter bröstcancer: hög återfallsfrekvens och dålig överlevnad trots kirurgisk behandling med R0-resektion. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Surgical management of radiation-induced angiosarcoma after breast conservation therapy. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Lokaliserade angiosarkom: identifiering av prognostiska faktorer och analys av behandlingens inverkan. A retrospective analysis from the French Sarcoma Group (GSF/GETO) Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Thalidomide combined with neoadjuvant chemotherapy in angiosarcoma of the breast with complete pathologic response: case report and review of literature. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Neoadjuvant kemoterapi för primärt angiosarkom av kutan/ mjuk vävnad: bestämma tumörens beteende före kirurgisk resektion. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Contralateral lymph node metastasis in a woman with new primary breast cancer: Systemisk sjukdom eller lokoregional spridning? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement: Konsensusbaserade riktlinjer för kirurgiska fallrapporter. Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Secondary sarcomas after radiotherapy for breast cancer: sustained risk and poor survival. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) Can c-myc amplification reliably discriminate postradiation from primary angiosarcoma of the breast? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiosarcoma of the breast following surgery and radiotherapy for breast cancer. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarkom efter bröstbevarande behandling. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Dosimetric evaluation of integrated IMRT treatment of the chest wall and supraclavicular region for breast cancer after modified radical mastectomy. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstim for resected soft-tissue sarcoma (EORTC 62931): a multicentre randomised controlled trial. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Breast tuberculosis cases rising in Sicily. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Role, timing and technique of radiotherapy in pediatric pleuropulmonary synovial sarcoma. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Intensity-modulated radiotherapy for relapsed malignant pleural mesothelioma. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Single-institution experience of intensity-modulated radiotherapy for malignant pleural mesothelioma at University of Catania. Future Oncol 14: 17-21.
Citation
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) A Single Institution Study Experience of Secondary Breast Angiosarcoma after Breast Conserving Treatment: Multidisciplinär hantering. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114