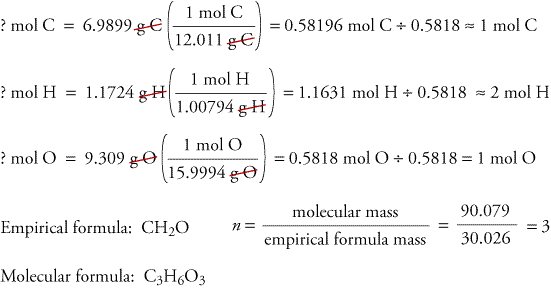Risultano formule empiriche e molecolari dai dati di combustione
Le formule empiriche e molecolari per composti che contengono solo carbonio e idrogeno (CaHb) o carbonio, idrogeno e ossigeno (CaHbOc) possono essere determinate con un processo chiamato analisi di combustione. I passi per questa procedura sono
Pesa un campione del composto da analizzare e mettilo nell’apparato mostrato nell’immagine qui sotto.
Combustione completa del composto. Gli unici prodotti della combustione di un composto che contiene solo carbonio e idrogeno (CaHb) o carbonio, idrogeno e ossigeno (CaHbOc) sono anidride carbonica e acqua.
L’H2O e il CO2 vengono fatti passare attraverso due tubi. Un tubo contiene una sostanza che assorbe l’acqua e l’altro contiene una sostanza che assorbe l’anidride carbonica. Pesate ciascuno di questi tubi prima e dopo la combustione. L’aumento di massa nel primo tubo è la massa di H2O che si è formata nella combustione, e l’aumento di massa per il secondo tubo è la massa di CO2 formata.
Assumiamo che tutto il carbonio del composto sia stato convertito in CO2 e intrappolato nel secondo tubo. Calcolare la massa di carbonio nel composto dalla massa di carbonio nella massa misurata di CO2 formata.
Assumiamo che tutto l’idrogeno nel composto sia stato convertito in H2O e intrappolato nella prima provetta. Calcola la massa di idrogeno nel composto dalla massa di idrogeno nella massa misurata di acqua.
Se il composto contiene ossigeno oltre a carbonio e idrogeno, calcola la massa dell’ossigeno sottraendo la massa di carbonio e idrogeno dalla massa totale del campione originale del composto.
Usa questi dati per determinare le formule empiriche e molecolari nel modo usuale.
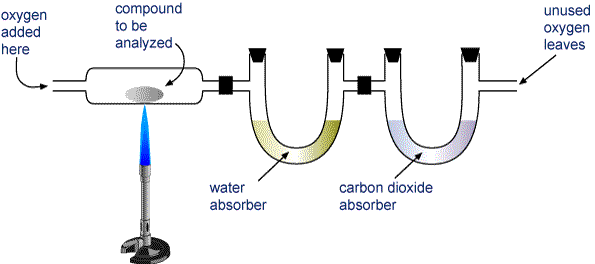
Apparato per l’analisi della combustione Un composto contenente carbonio e idrogeno (CaHb) o carbonio, idrogeno e ossigeno (CaHbOc) viene bruciato completamente per formare H2O e CO2. I prodotti vengono fatti passare attraverso due tubi. Il primo tubo assorbe l’acqua, e il secondo tubo assorbe l’anidride carbonica.
Per illustrare come le formule empiriche e molecolari possono essere determinate dai dati derivati dall’analisi della combustione, consideriamo una sostanza chiamata triossano. La formaldeide, CH2O, è instabile come gas puro, formando facilmente una miscela di una sostanza chiamata triossano e un polimero chiamato paraformaldeide. Questo è il motivo per cui la formaldeide viene dissolta in un solvente, come l’acqua, prima di essere venduta e utilizzata. La formula molecolare del trioxane, che contiene carbonio, idrogeno e ossigeno, può essere determinata usando i dati di due esperimenti diversi. Nel primo esperimento, 17,471 g di trioxane vengono bruciati nell’apparecchio mostrato sopra, e si formano 10,477 g H2O e 25,612 gCO2. Nel secondo esperimento, la massa molecolare del triossano si trova a 90,079.
Possiamo ottenere la formula molecolare di un composto dalla sua formula empirica e dalla sua massa molecolare. (Per ottenere la formula empirica, dobbiamo determinare la massa in grammi di carbonio, idrogeno e ossigeno in 17,471 g di trioxane. Quindi abbiamo bisogno di eseguire questi passi generali.
Primo, convertire dai dati dati dati in grammi di carbonio, idrogeno e ossigeno.
Secondo, determinare la formula empirica dai grammi di carbonio, idrogeno e ossigeno.
Terzo, determinare la formula molecolare dalla formula empirica e dalla massa molecolare data.
Poiché supponiamo che tutto il carbonio nel triossano abbia reagito per formarsi in CO2, possiamo trovare la massa di carbonio in 17,471 g di triossano calcolando la massa di carbonio in 25,612 g di CO2.

Poiché supponiamo che tutto l’idrogeno nel trioxane abbia reagito per formare H2O, possiamo trovare la massa di idrogeno in 17,471 g di trioxane calcolando la massa di idrogeno in 10.477 g di H2O.

Perché il triossano contiene solo carbonio, idrogeno e ossigeno, possiamo calcolare la massa di ossigeno sottraendo le moli di carbonio e idrogeno dalla massa totale del triossano.
? g O = 17,471 g di triossano – 6,9899 g C – 1,1724 g H = 9.309 g O
Ora calcoliamo la formula empirica, la massa della formula empirica e la formula molecolare.
Foglio di studio campione: Calcolo delle formule molecolari dai dati di combustione
Tip-off- Si vuole calcolare la formula molecolare di un composto contenente solo carbonio e idrogeno (CaHb) o carbonio, idrogeno e ossigeno (CaHbOc), e si è data la sua massa molecolare e le masse di CO2 e H2O formate nella combustione di una data massa del composto.
Procedimento generale
Calcolare il numero di grammi di carbonio nel composto calcolando il numero di grammi di carbonio nella quantità data di CO2.

Calcolare il numero di grammi di idrogeno nel composto calcolando il numero di grammi di idrogeno nella quantità data di H2O.

Se il composto contiene ossigeno, calcola il numero di grammi di ossigeno in esso sottraendo le masse di carbonio e idrogeno dalla massa totale del composto data.
? g O = (dato) g totale – (calcolato) g C – (calcolato) g H
Calcolare la formula empirica del composto dai grammi di carbonio, idrogeno e ossigeno.
Moltiplicare ciascuno dei pedici nella formula empirica per n per ottenere la formula molecolare.
ESEMPIO – Ottenere una formula molecolare dai dati della combustione:
Dianabol è uno degli steroidi anabolizzanti che è stato usato da alcuni atleti per aumentare la dimensione e la forza dei loro muscoli. È simile all’ormone maschile testosterone. Alcuni studi indicano che gli effetti desiderati del farmaco sono minimi, e gli effetti collaterali, che includono sterilità andincreased rischio di cancro al fegato e malattie cardiache, mantenere la maggior parte delle persone da usingit. La formula molecolare di Dianabol, che consiste di carbonio, idrogeno e ossigeno, può essere determinata utilizzando i dati di due diversi esperimenti. Nel primo esperimento, 14.765 g di Dianabol è bruciato, e 43.257 g CO2 e 12.395 g H2O sono formed.In secondo esperimento, la massa molecolare di Dianabol è trovato per essere 300.44. Qual è la formula molecolare di Dianabol?
Soluzione: