CH3OH o Metanolo è un liquido infiammabile, incolore e volatile che ha un caratteristico odore di alcol. Studiando il suo Metanolo, si può conoscere la forma molecolare, l’angolo di legame e la polarità della molecola. La polarità del CH3OH è una delle caratteristiche vitali in quanto aiuta a conoscere le altre proprietà del composto, come la sua solubilità, le cariche elettriche e molto altro. Per capire la polarità del metanolo, guardiamo prima gli angoli di legame e la disposizione degli atomi nella molecola di CH3OH.

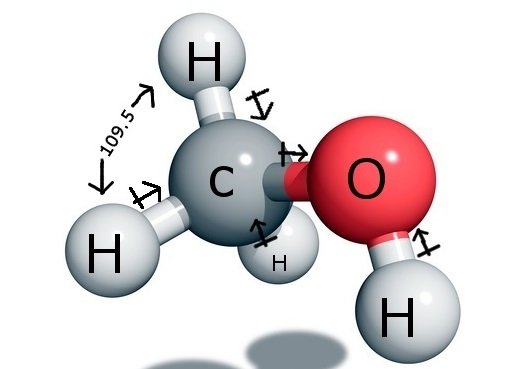
CH3OH Angoli di legame
L’atomo di carbonio centrale forma quattro legami nel composto, tre con l’atomo di idrogeno e uno con il gruppo idrossile (OH). E siccome questo atomo di carbonio ha un’ibridazione sp3 e forma un tetraedro, ha angoli di legame di 109,5 gradi con i suoi atomi di legame.
Al contrario, l’ossigeno forma un legame sigma ma ha due coppie solitarie, quindi c’è una flessione nel suo angolo di legame dovuta alle forze di repulsione coppia-singolo. Questo diminuisce l’angolo di legame a 104,5 gradi.
Quindi il carbonio ha un angolo di legame di 109,5 gradi con tutti e tre gli atomi di idrogeno e un angolo di legame di 104,5 gradi con il gruppo idrossile.
Il CH3OH è polare?
La polarità di qualsiasi composto dipende dal momento di dipolo netto del composto. Questo momento di dipolo netto può essere conosciuto notando le cariche elettriche sugli atomi della molecola. Qui entrambi gli atomi di carbonio e ossigeno (che sono considerati come centri geometrici per questo composto) nel metanolo sono atomi elettronegativi. Ma l’ossigeno è più elettronegativo del carbonio o dell’idrogeno nel composto.
CH3OH non può essere non polare perché c’è una differenza di cariche elettriche tra gli atomi nella molecola di metanolo. L’ossigeno ha più densità di elettroni a causa delle sue due coppie solitarie di elettroni. Questo causa un dipolo netto che punta verso l’atomo di ossigeno, rendendo il CH3OH polare.
A parte le cariche elettriche, la molecola di CH3OH è asimmetrica, il che annulla la possibilità di non polarità. Una molecola non polare ha una struttura simmetrica, poiché il momento dipolo-dipolo si annulla. Ma poiché c’è una curvatura nella forma del metanolo, questo porta alla formazione di una struttura asimmetrica con conseguente estremità negativa del momento di dipolo elettrico netto verso l’atomo di ossigeno. Quindi il CH3OH è una molecola polare.
Ora che conosciamo la polarità della molecola CH3OH, esaminiamo alcune delle sue proprietà fisiche:
- Il punto di ebollizione del Metanolo (CH3OH) è 64,7 °C.
- Il punto di fusione del Metanolo è -97,6 °C.
- Il peso molecolare del metanolo è 32,04 g/mol.
- È un solvente polare ed è anche conosciuto come alcol di legno perché una volta era prodotto dalla distillazione del legno.
- L’odore di questo composto è sul lato più dolce rispetto all’etanolo.
Usi del CH3OH
- Il metanolo è anche usato per produrre idrocarburi e per la sintesi di altre sostanze chimiche come la formaldeide.
- E’ usato come antigelo nelle tubature.
- Il CH3OH è anche usato come additivo della benzina in diversi paesi a causa del suo basso punto di fusione.
- Il composto è anche usato come combustibile nella combustione dei motori interni.
- Molte aziende farmaceutiche usano Metanolo puro per la sintesi di altri composti.
Spero che questo articolo ti aiuti a capire la polarità della molecola e le sue proprietà fisiche e usi. Il CH3OH è una molecola polare in quanto il momento dipolo-dipolo non si annulla a causa della sua forma asimmetrica.