Data l’abbondanza di funzioni che un bioreattore deve svolgere, ci si potrebbe chiedere come possa fare tutto questo. Di quali componenti ha bisogno? Come si fa a sapere quali sono le condizioni attuali nel bioreattore e come si fa a correggerle? E infine, solo per la prospettiva: come si fa a prendere i dati catturati durante un bioprocesso batch, visualizzarli in modo significativo, e poi salvarli e valutarli mantenendoli organizzati?
I parametri di processo più importanti e i meccanismi per regolarli sono trattati di seguito:
- Miscelazione della coltura
- Controllo della temperatura
- Controllo del pH
- Alimentazione dei nutrienti
- Gassificazione
- Controllo della pressione controllo
- Impedire la formazione di schiuma
Miscelazione della coltura
La coltura in un bioreattore deve essere mescolata accuratamente in ogni momento. Se i nutrienti nel bioreattore non sono dispersi abbastanza bene, le condizioni in alcune parti del bioreattore si discosteranno significativamente dall’ideale. Il pH potrebbe essere troppo acido, per esempio, o la fornitura di nutrienti potrebbe essere insufficiente. Deviazioni come queste non solo riducono l’efficienza del bioprocesso pianificato, ma possono anche promuovere modifiche genetiche. La distribuzione della temperatura è un’ulteriore preoccupazione. Senza un’agitazione uniforme, i microrganismi o le colture cellulari lungo il bordo del recipiente saranno letteralmente bolliti, mentre quelli al centro avranno i piedi freddi. Se avete mai riscaldato una zuppa nel microonde e poi l’avete mangiata con grande attesa senza mescolarla, saprete cosa intendiamo.
La velocità di mescolamento tipica varia tra l’altro a seconda dell’organismo coltivato:
| Organismo | Tasso di mescolamento | ||||
| Batteri, Lievito, funghi | 500 – 1500 min-1 | ||||
| Mammiferi, cellule di insetti o piante | 30 – 300 min-1 | ||||
La regolazione della velocità di agitazione per la coltivazione di microrganismi, cellule di piante, cellule di animali o cellule di insetti è molto importante, in quanto questi reagiscono in modo diverso allo stress da taglio, cioèe., lo sforzo meccanico causato dall’agitazione. A seconda della linea cellulare, le colture cellulari possono avere una risposta molto più intensa all’agitazione troppo vigorosa, cioè, semplicemente muoiono, una tendenza che gli scienziati descrivono più accuratamente (e diplomaticamente) come “sensibile allo shear stress”. La disponibilità di ossigeno può essere variata durante il bioprocesso cambiando la velocità di agitazione, assicurando così una crescita ottimale delle cellule.
Misurare e controllare la temperatura
I microrganismi e le colture cellulari hanno enzimi che lavorano meglio entro certi intervalli di temperatura e pH. Se le condizioni non rientrano in questi intervalli, il bioprocesso desiderato procederà molto più lentamente, perché la crescita e le prestazioni metaboliche dipendono fortemente da questi enzimi, cioè dalle proteine cataliticamente attive. Nel peggiore dei casi, condizioni ambientali sfavorevoli possono addirittura distruggerli. Le colture di cellule di mammifero si trovano più a loro agio all’interno di una gamma molto ristretta di temperature – che è presente solo dal loro punto di vista quando la temperatura all’interno del recipiente di coltura è di 37 °C.
Perciò, nel bioreattore viene utilizzato un sensore di resistenza al platino noto come sensore Pt100 per determinare la temperatura. Ha una resistenza di 100 Ω a 0 °C, e copre abbastanza bene l’intervallo di misurazione biologicamente rilevante quando è calibrato in modo appropriato.
L’intervallo di temperatura tipico varia tra l’altro a seconda dell’organismo coltivato:
| Organismo | Gamma di temperatura | ||||
| Batteri, Lievito, funghi | +20 °C a +60 °C | ||||
| Mammiferi, Cellule di insetti o piante | +25 °C a +37 °C | ||||
Se si lavora a temperature vicine o inferiori alla temperatura ambiente, è necessario un sistema di raffreddamento attivo come un refrigeratore a ricircolo. Per la maggior parte dei bioprocessi, la temperatura dovrebbe rimanere costante durante l’intera coltivazione. Per alcuni prodotti, tuttavia, come la penicillina o le proteine ricombinanti (cioè, proteine bioingegnerizzate usando organismi geneticamente modificati), cambiare la temperatura alla fine della fase di crescita attiva geni importanti per la formazione del prodotto ed è quindi vantaggioso. Per i metodi di produzione che coinvolgono le colture cellulari, la temperatura viene talvolta abbassata anche alla fine del bioprocesso (una tecnica nota come “spostamento di temperatura” in biotecnologia) in modo che il prodotto finito rimanga stabile per un uso successivo.
Ci sono diversi modi di usare un circuito di riscaldamento e/o raffreddamento per regolare la temperatura:
-
- Un blocco di riscaldamento elettrico con spirale di raffreddamento incorporata
- Un cuscinetto riscaldante in silicone avvolto intorno al recipiente di coltura dopo la sterilizzazione
- Una doppia camicia in cui circola acqua. La temperatura è regolata tramite un riscaldatore elettrico o vapore e un’elettrovalvola per l’ingresso dell’acqua di raffreddamento
Misurare e controllare il pH
Misurare e controllare il pH è un aspetto molto importante dei bioprocessi, poiché i cambiamenti del pH possono alterare significativamente le condizioni di crescita – solitamente con conseguenze importanti. I mezzi di coltura includono comunemente dei tamponi, cioè delle sostanze che attenuano i cambiamenti troppo repentini del pH causati dall’aggiunta di un acido o di una base. Poiché un acido che gocciola nel mezzo di coltura può danneggiare molte linee cellulari, gli scienziati spesso arricchiscono attentamente la miscela di gas usata nella coltura cellulare con CO2 piuttosto che aggiungere un acido liquido. Il gas si dissolve quindi nel mezzo di coltura, permettendo all’anidride carbonica di influenzare il pH in combinazione con un tampone.
Gamme di pH tipiche a seconda dell’organismo coltivato:
| Organismo | pH | ||||
| Batteri, lieviti, funghi | 4.5 – 7.0 | ||||
| Cellule di mammiferi | 6.7 – 7.4 | ||||
| Cellule di insetti | 6.2 – 6.9 | ||||
| Cellule vegetali | 5.5 | ||||
Per misurare il pH durante il bioprocesso, ogni bioreattore è dotato di un sensore di pH noto come elettrodo combinato per pH. Il bioreattore può correggere eventuali deviazioni del pH; a questo scopo, una soluzione acida e/o alcalina è messa a disposizione e collegata al recipiente di coltura tramite tubi e pompe. La concentrazione dell’acido e della base deve essere abilmente selezionata perché questo funzioni – se è troppo alta, le gocce di acido o base concentrati possono danneggiare i microrganismi e le colture cellulari prima che siano distribuiti nel bioreattore. Se, d’altra parte, la concentrazione è troppo bassa, gli operatori dovranno aggiungere più acido o base, diluendo inutilmente il mezzo di coltura.
Aggiungimento di nutrienti
Durante un bioprocesso, i microrganismi solitamente consumano una vasta gamma di nutrienti. La composizione di base di un mezzo nutritivo consiste di solito in acqua, una fonte di energia utilizzabile dall’organismo (ad esempio il glucosio), così come i nutrienti di cui ha bisogno (carbonio, azoto e fosforo), sali e oligoelementi. A seconda dell’organismo, sono necessari altri composti che non possono essere sintetizzati da soli (vitamine, aminoacidi essenziali, ecc.).
A seconda della strategia del bioprocesso, questi nutrienti sono resi disponibili tutti all’inizio di un bioprocesso (bioprocesso batch) o aggiunti nel tempo come in un fed-batch o in un processo continuo.
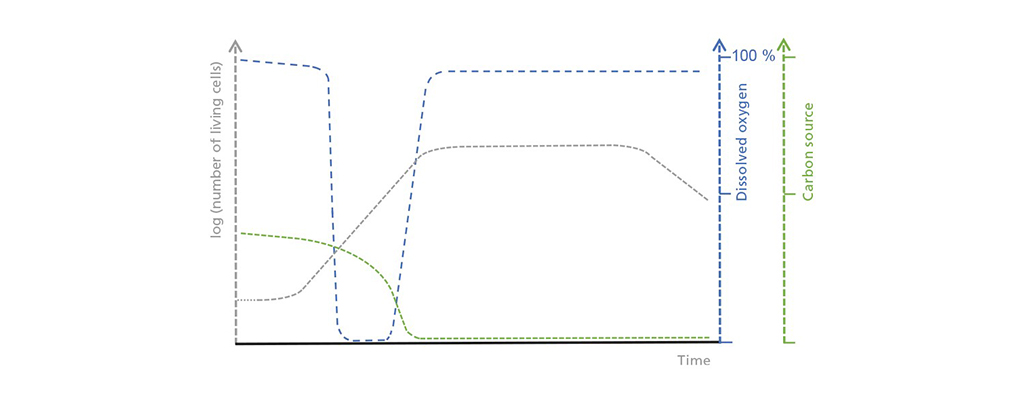
Illustrazione schematica delle correlazioni tra la concentrazione di cellule viventi, l’ossigeno disciolto e la fonte di carbonio limitante nel funzionamento batch. Nella fase iniziale di ritardo, il numero di cellule viventi aumenta solo lentamente, il che porta a un assorbimento moderato ma costante della fonte di carbonio. Il consumo di ossigeno aumenta durante la fase di crescita esponenziale fino a superare il possibile apporto di ossigeno. Una volta che la fonte di carbonio è esaurita, inizia la fase stazionaria che è seguita da una fase morta, durante la quale il numero di cellule vive diminuisce drasticamente.
Se vuoi saperne di più sulle diverse strategie di alimentazione dai un’occhiata al nostro blog-post: La differenza tra processi batch, fed-batch e continui.
Gassificazione
Durante il bioprocesso, il bioreattore alimenta una miscela di gas sterile come l’aria nel mezzo di coltura. L’agitazione costante non solo distribuisce i nutrienti, ma riduce anche la dimensione delle bolle di gas che si formano nel recipiente di coltura, rilasciando così in modo efficiente l’ossigeno nella soluzione nutritiva. Questo è importante, perché i microrganismi e le colture cellulari possono assorbire solo l’ossigeno che è stato disciolto nella soluzione nutritiva.
Le richieste di ossigeno variano: i batteri aerobi hanno bisogno di ossigeno, mentre altri preferiscono miscele di gas come il gas di sintesi (“syngas”). Gli organismi anaerobici, tuttavia, possono fare a meno di gasare completamente, nutrendosi solo di sostanze inorganiche e organiche dal mezzo di coltura, come nitrato o fumarato.
A differenza dei microrganismi, le colture cellulari vengono gasate con più di una semplice aria – il contenuto di ossigeno della miscela di gas può anche essere influenzato utilizzando azoto puro e ossigeno puro. La composizione esatta dipende dall’applicazione della coltura cellulare. Per mantenere costante l’atmosfera di gas, il bioreattore ha bisogno di sistemi di controllo precisi.
All’inizio del bioprocesso, per esempio, una coltura ha spesso bisogno di meno ossigeno – e quindi di un’alimentazione di gas minore – poiché la crescita procede ancora lentamente. Più tardi, tuttavia, una crescita più rapida richiede molto più ossigeno. Oltre a garantire una fornitura costante del gas o della miscela di gas desiderata, il bioreattore fornisce anche la giusta quantità di gas al momento giusto. Per fare questo, il bioreattore ha porte di gas collegate all’aria pressurizzata dell’edificio, un compressore o una bombola di gas.
Il tasso di gasificazione è solitamente misurato in litri al minuto. Al fine di avere un parametro generico applicabile a vari bioreattori, il tasso è anche spesso indicato come tasso di gassificazione specifico, che si riferisce a multipli del volume di lavoro (volumi del recipiente al minuto, vvm) ed è espresso come min-1. Un valore tipico per i bioprocessi microbici è da 1 a 1,5 volte il volume di lavoro al minuto. Per un bioreattore con un volume di lavoro di 4 L, il tasso massimo di gassificazione sarebbe quindi 4 L * 2 L L-1 min-1 = 8 L min-1. Nelle colture cellulari, al contrario, il tasso massimo è spesso dal 10% al 15% del volume di lavoro al minuto come un modo per mantenere le bolle di gas piccole e quindi prevenire la formazione di schiuma e danni alle cellule dallo scoppio delle bolle.
La modifica del tasso di gas, tuttavia, non è l’unico modo per controllare l’efficienza con cui il bioreattore fornisce ossigeno e altri gas al mezzo di coltura. Maggiore è la superficie del numero totale di tutte le bolle di gas nel bioreattore – cioè, più finemente distribuite sono le bolle di gas stesse – più efficientemente l’ossigeno sarà trasferito dal gas alla fase liquida. Questo significa, per esempio, che aumentare la velocità di agitazione può migliorare l’ossigenazione per i microrganismi, poiché l’agitatore rende le bolle di gas ancora più piccole e quindi aumenta la superficie totale di tutte le bolle di gas nel bioreattore.
La regolazione precisa della pO2 – e quindi il controllo preciso del tasso di gasatura e della composizione del gas – è molto importante poiché, normalmente, la pO2 non dovrebbe essere il fattore che inibisce la crescita della cultura. Se non è sufficientemente controllata, tuttavia, la pO2 diventa il fattore limitante.
Poiché il gas di alimentazione del bioreattore è solitamente secco, l’umidità dal bioreattore può essere raccolta nel flusso di uscita durante la gassificazione. Ad un alto tasso di gassificazione, non solo il livello di riempimento si abbasserebbe, ma l’umidità bloccherebbe anche il filtro di scarico, impedendo un corretto sfiato e permettendo alla pressione di accumularsi. Per evitare questo effetto, i bioreattori sono dotati di un efficiente raffreddatore di scarico dove l’umidità nello scarico si condensa e può gocciolare indietro nel bioreattore prima che raggiunga il filtro di scarico.
Misurare e controllare la pressione
Più alta è la pressione nel recipiente, più ossigeno viene dissolto. I vasi di coltura in vetro sono spesso approvati solo per una pressione fino a 0,5 bar, che non è nemmeno la metà della pressione di un pneumatico di bicicletta moderatamente pieno. Ad una pressione d’esercizio più alta, i vasi di coltura in vetro leggermente danneggiati possono scoppiare, il che rappresenta un rischio per la sicurezza. Questo è il motivo per cui si dovrebbe sempre garantire una linea di scarico libera e non pressurizzata dal bioreattore mantenendo il filtro di scarico asciutto e sostituendolo regolarmente – nel processo, si assicura anche l’integrità del recipiente di coltura, naturalmente. A differenza dei recipienti di coltura in vetro, i bioreattori in acciaio inossidabile sono progettati per pressioni più elevate e, anche nella loro configurazione standard, sono adatti a pressioni fino a 2 bar (un copertone di bicicletta ben riempito). Inoltre, sistemi come questi sono spesso dotati di un meccanismo di controllo della pressione basato su un sensore di pressione nel bioreattore e una valvola proporzionale nella linea di scarico. Non solo possono misurare la pressione nel bioreattore – possono anche controllarla attivamente.

Prevenire la formazione di schiuma
Al di fuori di vasche da bagno e bicchieri di birra, la schiuma è un effetto collaterale piuttosto impopolare, specialmente nei bioreattori. La schiuma si forma all’interfaccia tra la fase liquida e quella gassosa nel recipiente di coltura e può rapidamente trovare la sua strada sotto la piastra superiore. Nel peggiore dei casi, blocca il filtro di scarico, che a sua volta blocca il flusso di gas. La maggior parte dei bioreattori sono quindi dotati di un sistema per combattere la formazione di schiuma. I rompi-schiuma meccanici nello spazio di testa sono riservati a bioreattori in acciaio inossidabile piuttosto grandi, mentre i sistemi di controllo antischiuma basati su agenti chimici (come PPG, Struktol, o antischiuma a base di silicio) possono essere trovati in bioreattori più piccoli.
Un tipico sistema di controllo antischiuma consiste in un sensore installato ad una specifica altezza nel recipiente di coltura. Se l’altezza della schiuma raggiunge il sensore, un agente antischiuma viene pompato da un serbatoio nel recipiente di coltura. Questi agenti antischiuma sono attivi nell’interfaccia liquido-gas e aumentano la tendenza delle bolle di schiuma a collassare. In casi particolarmente ostinati in cui la schiuma non si dissolve immediatamente, ripetere la procedura dopo un tempo prestabilito (una strategia “shot & delay”). Si consiglia cautela quando si usa un agente antischiuma – se si eroga anche solo leggermente più del necessario, può giacere come una seconda pelle sulla superficie del liquido, che ostacola lo scambio di gas. Gli agenti antischiuma contrastano anche un efficiente trasferimento di ossigeno, perché il cambiamento della tensione superficiale promuove il collasso delle bolle di gas nel bioreattore, riducendo così la superficie disponibile per lo scambio di gas. La selezione dell’agente appropriato dipende anche dal bioprocesso in questione, perché i batteri e le cellule reagiscono in modo diverso a certe sostanze chimiche.
Bonus: I vantaggi di usare un software SCADA
Al giorno d’oggi, i risultati generati in un bioreattore dovrebbero essere raccolti e valutati il più centralmente possibile, perché questo è l’unico modo di implementare efficacemente i moderni algoritmi di big data per generare più informazioni e per capire meglio come funziona un processo. Questo è il compito del software SCADA. Nella prima fase, tutti i dati del bioreattore possono essere letti – senza alcun input importante da parte dell’utente – e memorizzati a livello centrale per poterli valutare da soli o confrontarli con altri dati di batch. Questo fa scattare rapidamente le idee per nuovi esperimenti e forse anche per complesse strategie di batch. Un software SCADA professionale permette di pianificare facilmente questi esperimenti e poi di controllare il bioreattore, che idealmente sarà un processo completamente automatizzato. Inoltre, il software SCADA integra anche diversi componenti nell’ambiente del bioreattore. Questi includono strumenti per l’ottimizzazione del processo utilizzando la tecnica del design-of-experiment (DoE) o potenti sensori software, che possono essere utilizzati contemporaneamente per calcolare informazioni aggiuntive direttamente dai parametri del processo batch e persino per regolare tali parametri. Per esempio, il quoziente respiratorio (RQ) può essere usato per ottenere una stima dell’attività metabolica attraverso il rapporto tra l’anidride carbonica espulsa e l’ossigeno assorbito.
Ci sono così tante possibilità – specialmente quando il bioreattore e il software SCADA sono perfettamente abbinati – che non potremmo descriverle tutte. Se sei interessato a saperne di più su tutto ciò che un moderno software SCADA ha da offrire, dai un’occhiata alla piattaforma software eve® bioprocess

.