Apoptóza

Apoptóza neboli programovaná buněčná smrt je vysoce regulovaný způsob selektivní likvidace buněk v organismu. Tento proces hraje důležitou roli v embryogenezi, při udržování velikosti organismu a při odstraňování poškozených nebo aberantních buněk. Význam apoptózy pro lidské zdraví podtrhuje mnoho nemocí, které jsou důsledkem aberantní apoptózy. Dysregulace apoptózy je spojována s různými druhy rakoviny, neurologickými a kardiovaskulárními poruchami a autoimunitními chorobami.
Běžně rozlišujeme dva různé typy apoptózy: vnitřní cestu, zprostředkovanou mitochondriemi v reakci na vnitřní podněty, jako je poškození DNA, a vnější cestu, zprostředkovanou extracelulárními receptory smrti (například vazbou FasL na receptor FasLG) (obr. 1). Obě cesty se opírají o proteázy zvané iniciátorové kaspázy, které aktivují kaskádu efektorových kaspáz, což vede k apoptóze. Vzájemné ovlivňování mezi intrinsickou a extrinsickou dráhou je zprostředkováno prostřednictvím agonisty smrti BH-3 interagující domény (Bid).
Intrinsická dráha (obr. 1) je iniciována proteiny homologie Bcl-2. Vnitřní dráha (obr. 2) je iniciována proteiny homologie Bcl-2 (obr. 3). V klasické dráze apoptózy se aktivují proteiny Bcl-2 Bax a Bak v reakci na vnitřní podněty, jako je poškození DNA nebo oxidační stres. Tyto dva proteiny následně interagují s Bid a jsou vloženy do vnější mitochondriální membrány. To vede k tomu, co je v apoptóze považováno za bod, odkud není návratu – permeabilizaci vnější mitochondriální membrány (MOMP). MOMP vede k uvolnění proapoptotických faktorů, jako je cytochrom c, do cytoplazmy. Cytochrom c v cytoplazmě váže APAF-1 a dATP a rekrutuje prokaspázu 9, čímž vzniká apoptosom. Tvorba apoptosomu spustí štěpení prokaspázy-9 na její aktivní proteázovou formu, kaspázu-9. Kaspáza-9 je iniciační kaspáza, která pak prostřednictvím proteolýzy aktivuje následné efektorové kaspázy, jako jsou kaspáza-3 a -7, a spouští kaspázovou kaskádu, která vede k apoptóze.
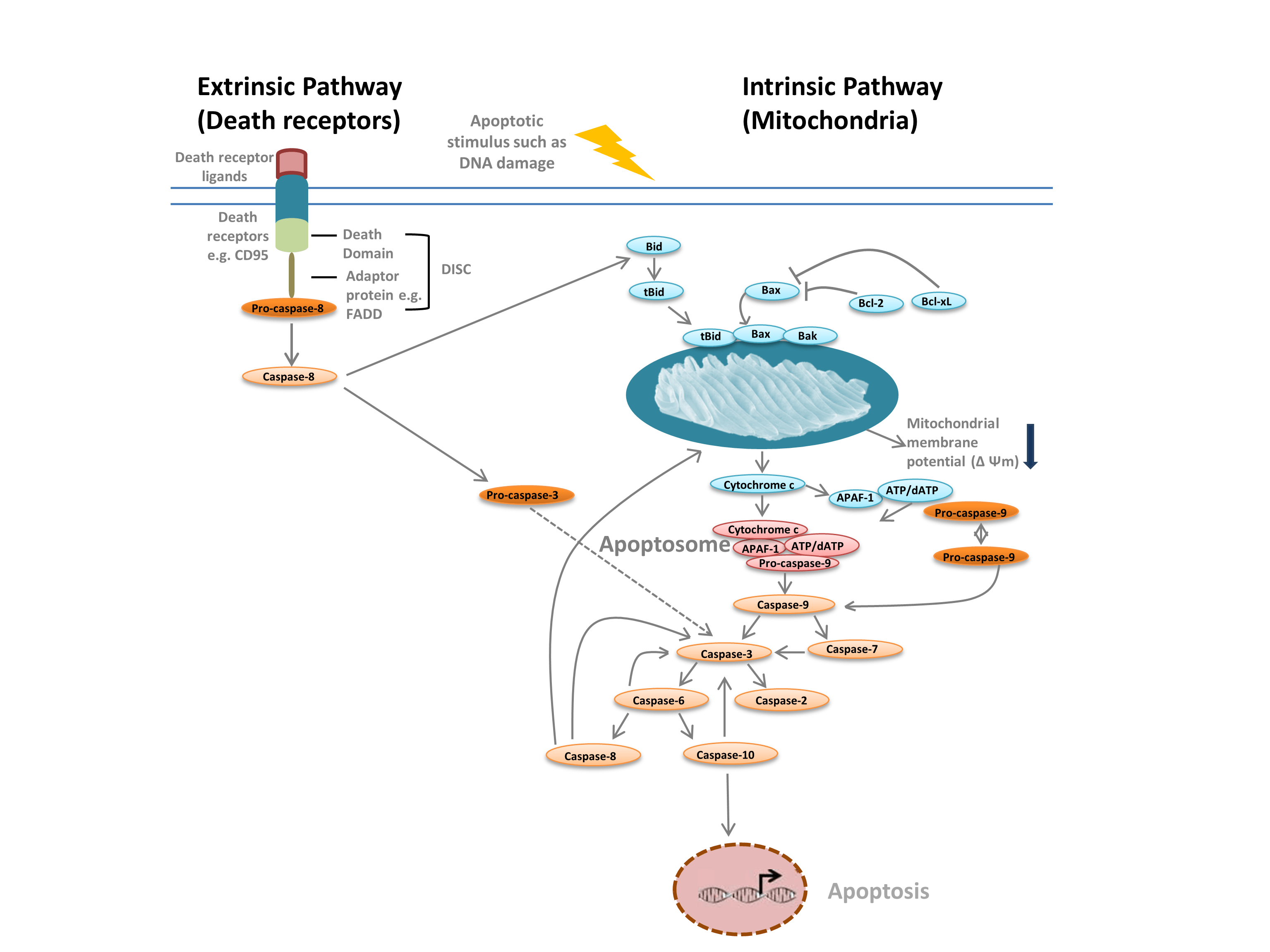
Obr. 1. Dráhy apoptózy.
Vnější dráha je spuštěna vazbou ligandů na receptory smrti. Po navázání ligandu se receptory smrti oligomerizují a rekrutují adaptorové proteiny, jako je FADD. To umožňuje nábor pro-kaspázy-8, neaktivní formy iniciátorové kaspázy-8, a vytvoření signálního komplexu vyvolávajícího smrt (DISC). Pro-kaspáza-8 oligomerizuje a je štěpena na aktivní formu, kaspázu-8, která následně štěpí a aktivuje efektorovou kaspázu-3. Kaspáza-3 zase proteolyticky aktivuje různé další kaspázy, což vede k apoptóze. V některých případech může aktivace extrinsické dráhy vést také k aktivaci intrinsické dráhy zprostředkované Bid.
Apoptóza se liší od neprogramované buněčné smrti/nekrózy. Nekróza je neregulovaný proces iniciovaný vnějším poškozením a od apoptózy se liší několika klíčovými způsoby (tab. 1). Nicméně s tím, jak jsme se o apoptóze a nekróze dozvěděli více a identifikovali nové mechanismy buněčné smrti, jako je nekroptóza, se hranice mezi apoptózou a nekrózou stále více stírají. Rozlišovací znaky uvedené v tabulce 1 jsou však stále užitečným vodítkem.
Tabulka 1. Znaky apoptózy a nekrózy.
| Apoptóza | Nekróza |
| Buňky se zmenšují | Buňky bobtnají |
| Fagocyty/makrofágy pohlcují buňky | Buňky se zvětšují. uvolňují se zbytky |
| Proces je nezánětlivý | Proces je zánětlivý |
Při analýze apoptózy je užitečné rozdělit tento proces na fáze:
- Je zahájena apoptóza a aktivují se signální kaskády
- Buňky se zmenšují a zakulacují, zprostředkované kaspázami
- Organely mění tvar a membrány začínají krvácet
- Začíná kondenzace jader
- Můžeme pozorovat fragmentaci DNA
- Vytvářejí se apoptotická tělíska
- Apoptotická tělíska jsou fagocytována
Tyto apoptotické fáze, spolu se známými mediátory apoptózy lze použít jako identifikátory apoptózy. Při výběru testu apoptózy si promyslete, jakou otázku chcete položit – testy aktivity kaspáz jsou vynikajícími indikátory zahájení apoptózy, zatímco testy fragmentace DNA lze použít k identifikaci buněk v pozdních stadiích apoptózy, kdy jsou nevratně zavázány k programované buněčné smrti.
Při provádění testů apoptózy je vždy vhodné zahrnout barviva životaschopnosti, jako je propidium jodid (PI), aby bylo možné odlišit apoptotické buňky od nekrotických a vizuálně zkontrolovat buňky nebo tkáně pod mikroskopem pro klíčové morfologické ukazatele apoptózy.
Ohodnocení apoptózy
1. Morfologické změny
K sledování apoptózy v reálném čase lze použít časosběrné snímání živých buněk, které je zvláště užitečné pro identifikaci membránového krvácení. U tkání lze transmisní elektronovou mikroskopii použít k identifikaci mnoha strukturálních změn, které doprovázejí jednotlivé fáze apoptózy. Tkáně lze také obarvit hematoxylinem a eosinem, aby se zviditelnily makrofágy, které pohltily apoptotické buňky. Dalším barvivem běžně používaným k vizualizaci apoptotických buněk je akridinová oranž (AO). Toto oblíbené barvivo pro hodnocení životaschopnosti a proliferace lze použít k hodnocení apoptózy, protože jeho emisní spektrum se v kyselém prostředí lyzozomů mění na oranžové; díky tomu je barvivo užitečné pro identifikaci pohlcených apoptotických buněk. Barviva vázající DNA, jako jsou DAPI, Hoechst, propidium jodid (PI) a 7-AAD, lze použít k vizualizaci jaderného krvácení, zatímco smršťování buněk lze detekovat buď na průtokovém cytometru jako snížení přímého rozptylu (FSC), nebo vizuálně pomocí světelné mikroskopie.
2. Změny mitochondriálního membránového potenciálu
Změny membránového potenciálu naznačují, že buňka překročila bod, z něhož není návratu, a nyní podléhá apoptóze. Zhroucení mitochondriálního membránového potenciálu lze detekovat pomocí průtokové cytometrie nebo imunofluorescence s použitím potenciometrických barviv.
Běžně používanými potenciometrickými barvivy jsou ethylester tetrametylrhodaminu (TMRE), methylester tetrametylrhodaminu (TMRM) a JC-1. TMRE a TMRM se shlukují v mitochondriích neapoptotických buněk a fluoreskují jasně oranžově nebo červeně. V apoptotických buňkách se sníženým mitochondriálním membránovým potenciálem se tato barviva nacházejí v celé cytoplazmě v monomerní formě a vykazují sníženou červenou fluorescenci. Tato barviva lze použít v kombinaci s fluoroforem značeným inhibitorem kaspáz (FLICA) (viz další oddíl) k identifikaci apoptotických buněk na základě dvou znaků: rozpadu mitochondriálního membránového potenciálu a aktivace kaspáz (obr. 2).
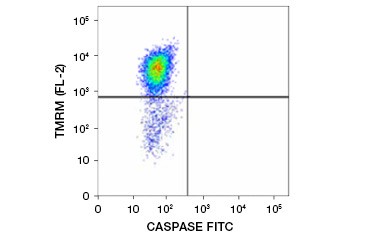
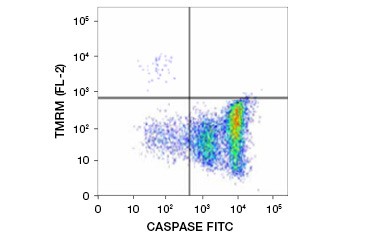
Obr. 2. Obr. 3. Inhibitor kaspáz. Detekce snížení mitochondriálního membránového potenciálu a aktivace kaspáz pomocí průtokové cytometrie. Současný úbytek oranžové fluorescence z TMRM a nárůst zelené fluorescence, který ukazuje aktivaci kaspáz měřenou soupravou FAM-FLICA Polycaspase Kit, ukazuje na apoptotické buňky (pravý dolní kvadrant).
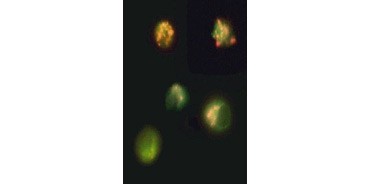
Obr. 3. Ztráta oranžové fluorescence z TMRM. Rozpad mitochondriálního membránového potenciálu vizualizovaný pomocí JC-1. Buňky Jurkat byly obarveny pomocí MitoPT JC-1. Neapoptotické buňky (nahoře) vykazují červeně zbarvené mitochondrie, zatímco buňky v různých stadiích apoptózy vykazují zelenou cytoplazmatickou fluorescenci.
JC-1 se také shlukuje v mitochondriích neapoptotických buněk a u apoptotických buněk se nachází rozptýlený po celé buňce. Na rozdíl od TMRE a TMRM , které vykazují sníženou fluorescenci, JC-1 mění barvu, z červené na zelenou. To umožňuje snadné rozlišení neapoptotických červeně fluoreskujících buněk a apoptotických zeleně fluoreskujících buněk (obrázek 3). Aktivní kaspáza-9 je detekována pomocí western blotu. Western blot analýza neošetřených (pruh 1) a etoposidem ošetřených (pruh 2) buněk sondovaných protilátkou Rabbit anti-caspase-9 (active). Aktivní, štěpená kaspáza-9 je detekována pouze po indukci apoptózy etoposidem.
Aktivace kaspázy je určujícím znakem apoptózy. Běžně testovanými klíčovými apoptotickými kaspázami jsou iniciační kaspázy 3, 6 a 7 a efektorové kaspázy 2, 8, 9 a 10. V případě, že se jedná o iniciační kaspázy, je možné, že dojde k jejich aktivaci. Aktivaci kaspáz lze identifikovat buď podle zmenšené velikosti prokaspáz při jejich štěpení, nebo pomocí protilátek, které interagují pouze se štěpenou, aktivovanou formou (obrázek 4). Oba přístupy lze odečíst pomocí Western blottingu, zatímco druhý přístup lze také přizpůsobit pro fluorescenční a imunohistochemické testy výběrem protilátek konjugovaných s fluorofory nebo biotinem. Tyto testy jsou kompatibilní s fixovanými i nefixovanými buňkami.
Jednou věcí, kterou je třeba mít na paměti, je, že iniciační kaspázy jsou v signální dráze apoptózy daleko nahoře a že jejich aktivace nemusí vždy vést k apoptóze. Proto je rozumné kombinovat testy pro iniciační kaspázy s testy pro efektorové kaspázy nebo ještě lépe se sondami pro události za bodem bez návratu, jako je MOMP.
Další třídou testů aktivace kaspáz jsou fluoroforem značené kaspázové substráty, jako je FLICA Assays. FLICA Assays se kovalentně a ireverzibilně vážou na aktivované kaspázy; jakýkoli nenavázaný inhibitor difunduje z buněk a/nebo může být odstraněn promytím. Tyto inhibitory jsou k dispozici ve spojení s červeným nebo zeleným barvivem. Intenzitu fluorescence lze použít jako kvantitativní měřítko aktivity kaspáz – apoptotické buňky s vysokou aktivitou kaspáz budou vykazovat větší fluorescenci než buňky s nízkou aktivitou kaspáz. Testy FLICA jsou kompatibilní s živými buňkami, tkáňovými řezy a tenkými zmrazenými řezy, nikoli však s fixovanými buňkami nebo tkáněmi zalitými v parafínu, a lze je odečítat pomocí kvantifikace intenzity fluorescence pomocí fluorescenční mikroskopie, průtokové cytometrie (obr. 2) nebo čtečky mikrotitračních destiček.
Pro vyvození správných závěrů z testů kaspázové aktivity je vždy moudré vybrat více než jeden cíl.
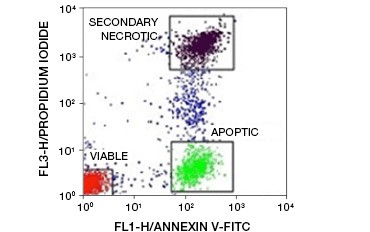
Obr. 5. Kvantifikace intenzity fluorescence. Konjugáty annexinu-V lze použít k rozlišení apoptotických buněk od nekrotických a životaschopných. Bodový graf zobrazující Ramosovy buňky obarvené annexinem V:FITC versus propidium jodid. Lze pozorovat tři odlišné populace.
4. Externalizace fosfatidylserinu
Klíčovým rysem apoptózy, který je zjistitelný i v raných stadiích, je externalizace fosfatidylserinu (PS), fosfolipidu, který se u zdravých buněk nachází výhradně ve vnitřní membráně. Annexin-V váže fosfatidylserin a konjugáty annexinu-V lze tedy použít k hodnocení apoptózy. Tyto testy se běžně provádějí pomocí průtokové cytometrie s použitím annexinu-V značeného fluoroforem. Kombinací tohoto barviva s jakýmkoli barvivem životaschopnosti, jako je PI, lze odlišit apoptotické buňky od nekrotických. V těchto dvoubarevných experimentech s průtokovou cytometrií lze snadno rozlišit tři populace: anexin-V/PI dvojitě negativní životaschopné buňky, anexin-V pozitivní/PI negativní apoptotické buňky a anexin-V/PI dvojitě pozitivní sekundární nekrotické buňky
(obrázek 5).
Externalizace fosfatidylserinu je dynamický, reverzibilní proces, dokud není buňka po MOMP oddána apoptóze. Pomocí konjugátů annexinu-V nelze rozlišit časná, reverzibilní stadia apoptózy od pozdějších stadií apoptózy, kdy je buňka zavázána k smrti. Sondy citlivé na polaritu indikátoru životaschopnosti a apoptózy (pSIVA) jsou biosenzory, které reverzibilně vážou PS, a tak se zapínají a vypínají, jak se PS překlápí z vnější membrány na vnitřní (obrázek 6). Další výhodou testu pSIVA je, že na rozdíl od konjugátů annexinu-V lze sondy pSIVA přidávat přímo do buněk bez promývání. Tento test lze odečítat pomocí imunocytochemie a imunofluorescenční mikroskopie, včetně zobrazování živých buněk, což umožňuje snadné porovnání rozdílů v míře apoptózy v reakci na různá experimentální ošetření v reálném čase. Vzhledem k tomu, že apoptóza je sledována v reálném čase, není tento test kompatibilní s fixovanými buňkami.
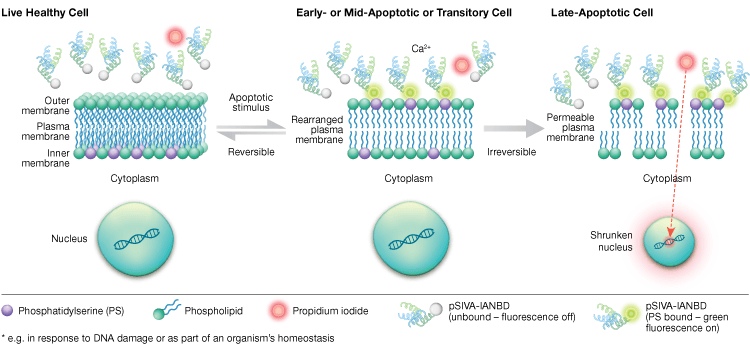
Obr. 6. Test pSIVA Assay dokáže rozlišit živé, časně apoptotické a pozdně apoptotické buňky sledováním externalizace a internalizace fosfatidylserinu v reálném čase.
5. Fragmentace DNA
Fragmentace DNA je jedním z pozdějších stadií apoptózy a běžně se analyzuje detekcí žebrování DNA pomocí elektroforézy založené na agaróze nebo metodou značení terminální deoxynukleotidyl transferázy dUTP nick end (TUNEL).
Definičním znakem apoptózy je fragmentace DNA na fragmenty o velikosti ~180 bp pomocí endonukleáz aktivovaných kaspázou. Extrahovaná genomová DNA vedená na agarózovém gelu tak bude vykazovat charakteristické řazení DNA, které není vidět u buněk umírajících jinými mechanismy, například nekrózou.
Metoda TUNEL je další způsob detekce tvorby oligonukleozomů kaspázou aktivovanou endonukleázou. Při štěpení DNA vznikají 3′ hydroxylové skupiny (3′-OH skupiny). Test TUNEL používá enzym terminální deoxynukleotidyltransferázu (TdT) k přidání BrdU k těmto 3′-OH skupinám. Inkorporovaný BrdU lze poté detekovat pomocí protilátek proti BrdU značených biotinem nebo fluoroforem. Tento test je kompatibilní s průtokovou cytometrií, stejně jako s imunohistochemií a imunofluorescencí, a lze jej převést na radioaktivní značení použitím -TdR místo BrdU. Buňky je třeba po inkorporaci BrdU před barvením fixovat.
Fragmentaci DNA lze měřit také průtokovou cytometrií pomocí testu sub-G1. Malé, ~180 bp, fragmenty DNA vznikající během apoptózy unikají z buněk, čímž se snižuje celkový obsah DNA apoptotických buněk. Při barvení DNA pomocí PI lze hypodiploidní apoptotické buňky spočítat v sub-G1 píku PI histogramu.
6. Multiplexní panely markerů apoptózy
Nakonec mnoho prodejců prodává panely pro multiplexní imunoanalýzu buněčných populací. Tyto panely mohou testovat více markerů apoptózy najednou.
Bez ohledu na metodu použitou k detekci apoptózy je třeba zahrnout vhodné kontroly, protože experimentální podmínky a typ buněk mohou změnit výkonnost některých testů. Vždy zahrňte pozitivní a negativní kontroly. Zahrňte kontroly ošetřené vehikulem, abyste zohlednili účinky rozpouštědel, kontroly specifické pro danou aplikaci, abyste kontrolovali faktory, jako je autofluorescence při imunofluorescenčních experimentech, a kontroly zatížení při western blottingu.
Tabulka 2. Zjistěte, zda je možné použít kontrolní metody. Souhrn testů pro detekci charakteristických znaků apoptózy.
| Stupeň poptózy | Reagencie umožňující detekci | Použití |
| Překlápěcí konjugáty annexinu-V | , pSIVA sondy | Průtoková cytometrie, mikroskopie |
| Signalizační kaskády iniciované | FLICA, protilátky proti kaspázám | Průtoková cytometrie, mikroskopie, western blot |
| MOMP | TMRM, TMRE, JC-1 | Průtoková cytometrie, mikroskopie, mikrodestičková čtečka |
| Smršťování buněk | Průtoková cytometrie, mikroskopie | |
| Membránové krvácení | hematoxylin + eosin | Mikroskopie |
| Jaderná kondenzace | DAPI, Hoechst, PI, 7-AAD | Mikroskopie |
| DNA fragmentace | TUNEL, Sub-G1 test, DNA laddering | Agarosový gel, průtoková cytometrie, mikroskopie |
| Fagocytóza apoptotických tělísek | Akridinová oranž, hematoxylin + eosin | Průtoková cytometrie, světelná a elektronová mikroskopie |
.