Úvod
Charophytes neboli bazální streptofyty; (Becker a Marin, 2009; Leliaert a kol., 2012) představují rozmanitý taxonomický sortiment zachovalých sladkovodních a suchozemských zelených řas, které vykazují širokou škálu jednobuněčných, vláknitých a „parenchymatózních“ forem (Graham, 1993; Lewis a McCourt, 2004). Prapůvodní linie charofytů se objevila na souši a kolonizovala ji před 450-500 miliony let. Tyto organismy se přizpůsobily suchozemským podmínkám, staly se schopnými přežívat a rozmnožovat se při plném vystavení atmosféře a někteří členové se nakonec vyvinuli v suchozemské rostliny (Zhong et al., 2013; Delwiche a Cooper, 2015). Tato „terestrializace“ zelených rostlin představovala klíčovou biologickou událost, která navždy změnila biogeochemii a přírodní historii planety. Následné rozšíření suchozemských rostlin změnilo atmosférické a dále změnilo půdní podmínky a umožnilo vznik dalších rozmanitých forem života na souši. Evoluce suchozemských rostlin také nejvýrazněji proměnila lidské dějiny prostřednictvím inovace zemědělství a následného vzniku moderní lidské civilizace. Částečně díky svému evolučnímu významu se charofytům v posledních desetiletích dostalo značné pozornosti rostlinných biologů (Pickett-Heaps a Marchant, 1972; Pickett-Heaps, 1975; Mattox a Stewart, 1984; Becker a Marin, 2009; Harholt a kol., 2016). S tím, jak byly shromážděny další nové údaje týkající se biologie těchto řas, se však staly důležitými modely pro pochopení základních jevů v biochemii, buněčné biologii, vývojové biologii, ekologii a stále více i v molekulární biologii (Delwiche a Cooper, 2015; Lemieux a kol., 2016). Série Frontiers in Plant Science věnovaná „Charophytes“ ilustruje význam těchto organismů v několika specifických oblastech výzkumu biologie rostlin. Tato minirecenze vyzdvihuje atributy charofytů jako modelových organismů v různých oblastech výzkumu. Doufejme, že také poskytne nové generaci vědců podnět k rozšíření využití těchto řas v základním výzkumu a k zahájení screeningu dalších taxonů, což následně může vést k identifikaci a využití nových modelových charofytů.
„Line-Up“ charofytů
V průběhu 70. a 80. let 20. století byly na základě ultrastrukturálních (např, mechanismus buněčného dělení, substruktura bičíkového aparátu) a biochemická data (např. profily enzymů) byly hlavními kritérii pro zařazení zelené řasy do linie charofytů (Mattox a Stewart, 1984; Lewis a McCourt, 2004; Leliaert a kol., 2012). Od 90. let 20. století do současnosti studie zaměřené na molekulární analýzy chloroplastových a jaderných genomů a transkriptomů potvrdily a zpřesnily dřívější taxonomická a fylogenetická schémata (Timme et al., 2012; Delwiche a Cooper, 2015). K tomu se dále přidaly podrobné biochemické, imunologické a na buněčné biologii založené analýzy buněčných stěn charofytů a biosyntetických a signálních drah hormonů (Popper a Fry, 2003; Popper, 2008; Sørensen et al., 2010, 2011, 2012; Zhang a van Duijn, 2014; Ju et al., 2015; O’Rourke et al., 2015). Rozšířené charofyty vykazují ve srovnání s ostatními taxony zelených řas poměrně nízké procento diverzity a zahrnují 13 čeledí a 122 rodů (Becker a Marin, 2009; Leliaert a kol., 2012). Současný fylogenetický názor řadí charofyty do šesti tříd (obr. 1; Delwiche a Cooper, 2015). Bazální třída, Mesostigmatophyceae, je zastoupena jediným známým rodem Mesostigma. Tato řasa je jednobuněčný dvoubuněčník s unikátním asymetrickým tvarem (tj. jako zploštělý záchranný člun) a je pokryta vrstvami ozdobně řešených šupin (Manton a Ettl, 1965; Becker a kol., 1991; Domozych a kol., 1991, 1992). Druhou třídu, Chlorokybophyceae, tvoří rovněž jediný známý druh, Chlorokybus atmophyticus. Tato vzácná řasa tvoří sarcinoidní paket buněk obklopený silným gelovitým obalem (Rogers et al., 1980). Je třeba poznamenat, že alternativní fylogeneze řadí Mesostigma a Chlorokybus mezi sesterské linie, které jsou společně sesterské všem ostatním streptofytům (Rodríguez-Ezpeleta et al., 2007). Ve fylogenezi šesti tříd je třetí třída, Klebsormidiophyceae, tvořena třemi rody, které tvoří jednoduchá nevětvená vlákna (Sluiman et al., 2008), která jsou často členy „biologických krust“ rostoucích na povrchu různých suchozemských stanovišť. Několik druhů z této třídy dokáže odolávat i značnému stresu z vysychání, pokud jsou součástí pouštních krust (Mikhailyuk et al., 2008, 2014; Holzinger a Karsten, 2013); jiné jsou tolerantní vůči stresu z vysychání spojenému s nízkými teplotami prostředí (Stamenkovic et al., 2014; Herburger a Holzinger, 2015). Tyto první tři třídy tvoří „časné divergentní“ charofyty. Do „pozdně divergentní“ linie patří rovněž tři třídy. Charophyceae neboli kamenáče se běžně vyskytují ve sladkovodních ekosystémech a mají makroskopické mnohobuněčné tály tvořené shluky rozvětvených vláken z mimořádně protáhlých buněk (Lewis a McCourt, 2004). Zástupci této skupiny vykazují pohlavní rozmnožování založené na oogamii, které zahrnuje pohyblivé spermie a nepohyblivá vajíčka produkovaná v mnohobuněčných gametangiích. Do skupiny Coleochaetophyceae patří taxony, které mají mnohobuněčné řasy tvořené rozvětvenými vlákny nebo parenchymatickými řasami (Graham, 1993; Delwiche et al., 2002). Tyto organismy také vykazují odlišné pohlavní rozmnožování založené na oogamii. Coleochaetophyceae se obvykle vyskytují na rozhraní sladkovodních a suchozemských stanovišť, často jako epifyty. A konečně největší a nejrozmanitější skupina charofytů, Zygnematophyceae, je tvořena jednobuněčnými a nevětvenými vlákny (Gontcharov et al., 2003; Guiry, 2013). Charakteristickým znakem této skupiny je přítomnost pohlavního rozmnožování založeného na konjugaci, které vyžaduje složitou buněčnou signalizaci a adhezi (Abe et al., 2016). Zygnematofytní řasy jsou běžnými obyvateli sladkovodních biotopů, někdy se vyskytují ve velkolepých efemérních květech, stejně jako ve vlhkých suchozemských substrátech.

FIGURE 1. Rozšířené druhy charofytů. Rozšířené Charophytes se dělí na časné a pozdní divergující taxony. Mezi časně divergující taxony patří Mesostigmatophyceae, Chlorokybophyceae a Klebsormidiophyceae a mezi pozdně divergující taxony patří Charophyceae, Coleochaetophyceae a Zygnematophyceae. Zástupci jednotlivých skupin jsou Mesostigma (Mesostigmatophyceae), Chlorokybus atmophyticus (Chlorokybophyceae), Klebsormidium flaccidum (Klebsormidiophyceae), Chara (Charophyceae), Coleochaete scutata (Coleochaetophyceae) a Micrasterias (Zygnematophyceae).
Charophytes as Model Organisms
Několik charofytů bylo hojně využíváno jako modelové organismy při studiu základních biologických procesů. Jejich malé a jednoduché thálie (tj. ve srovnání se suchozemskými rostlinami) a snadná experimentální manipulace jsou jen dvě z jejich vlastností, které z nich činí atraktivní modelové organismy. Nedávné důkazy také ukázaly, že mnoho charofytů má několik pozoruhodně podobných vlastností jako suchozemské rostliny, včetně přítomnosti biosyntetických drah pro mnoho růstových regulátorů (obr. 2; Boot et al., 2012; Hori et al., 2014; Wang et al., 2014, 2015; Holzinger a Becker, 2015; Ju et al., 2015) a více polymerů buněčné stěny (Popper, 2008; Sørensen et al., 2010, 2011, 2012; Mikkelsen et al., 2014). Díky těmto dvěma vlastnostem jsou charofyty účinné v takových oblastech studia, jako je molekulární vývoj rostlin a fyziologie stresu. Ačkoli mnoho charofytů bylo použito v široké škále biologických studií, následující taxony jsou nejpozoruhodnější pro své rozsáhlé využití v mnoha oblastech studia jako modely:
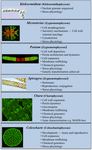
FIGURE 2. Současné modelové Charophytes. Jako modely se používá několik Charophytů včetně Klebsormidium, Micrasterias, Penium, Spirogyra, Chara a Coleochaete; každý z nich má specifické vlastnosti, díky nimž je zvláště vhodným modelem pro specifické fyziologické a biochemické procesy.
Desmidy: Symetrické modely
Nedávno se ukázalo, že Zygnematophyceae jsou s největší pravděpodobností nejbližšími žijícími předky suchozemských rostlin (Wodniok et al., 2011; Delwiche a Cooper, 2015). Jednobuněční příslušníci inkluzivní skupiny plakozubců se stali důležitými modely pro objasnění mnoha základních principů biologie a vývoje rostlinných buněk. Velká velikost buněk, pozoruhodná symetrie/tvar, výrazná architektura buněčné stěny a propracovaný endomembránový/cytoskeletální systém jsou jen některé z vlastností, které z nich činí vynikající buněčné systémy pro studium buněčné fyziologie a vývoje. Nedávné vytvoření stabilních transformovaných linií a genomů/transkriptomů vybraných desmidů, které budou brzy sekvenovány, dále zvýšilo jejich hodnotu v botanických studiích. Jako nejlépe prozkoumané desmidy se ukázaly dva taxony, Micrasterias a Penium.
Micrasterias je díky svým jedinečným vlastnostem již 50 let nejoblíbenějším desmidem pro výzkum buněčné biologie (Meindl, 1993; Lutz-Meindl, 2016). Buňka Micrasterias vykazuje bilaterální symetrii, která je často zvýrazněna efektně rozčleněnou (tj. vícebuněčnou) periferií. Nové dceřiné polobuňky vzniklé buněčným dělením nemají tuto složitou morfologii, ale mají spíše kulovitý tvar. Složitý postcytokinetický vývojový program, který využívá několik sad vysoce koordinovaných subcelulárních mechanismů, následně vytváří vícebuněčný fenotyp během expanze dceřiných polobuněk. Tento program je také zodpovědný za ukládání polymerů pro tvorbu primární i sekundární buněčné stěny. Tyto události se soustřeďují na rozsáhlou síť Golgiho tělísek a přidružených vezikul, které vytvářejí komplexní sekreční mechanismus. Tento proces je zase zaměřen na specifická místa buněčného povrchu, která vytvářejí multipolární buněčnou expanzi a současnou sekreci makromolekul buněčné stěny a extracelulárního slizu (Kim et al., 1996; Lutz-Meindl a Brosch-Salomon, 2000; Oertel et al., 2004; Aichinger a Lutz-Meindl, 2005). Doprava sekrečních složek do přesných míst na povrchu buněk vyžaduje propracovaný cytomotilový systém založený na aktinomyosinu a je řízena několika signálními transdukčními kaskádami (Meindl et al., 1994; Oertel et al., 2003). Kromě toho je morfogeneze buněk velmi citlivá na vnější stres (např. oxidační stres, zasolení, těžké kovy), který vede k zásadním změnám v diferenciaci buněk (Darehshouri et al., 2008; Affenzeller et al., 2009; Andosch et al., 2012). Micrasterias je vynikajícím organismem pro analýzu těchto subcelulárních vlastností, protože se snadno udržuje a manipuluje v laboratoři a obzvláště dobře se hodí pro pořizování snímků s vysokým rozlišením pomocí světelné a elektronové mikroskopie včetně imunocytochemie, skenovací elektronové mikroskopie s fokusovaným iontovým svazkem (FIB-SEM) a snímání pomocí spektroskopie ztrát energie elektronů (EELS) (Lutz-Meindl, 2007; Eder a Lutz-Meindl, 2008, 2010; Wanner a kol., 2013; Lutz-Meindl a kol., 2015). Kromě toho počáteční molekulární analýzy včetně produkce transformovaných buněčných linií dále rozšířily využití micrasterií zejména v oblasti molekulární dynamiky zpracování buněčné stěny (Vannerum et al., 2010, 2011, 2012).
V průběhu posledního desetiletí se cenným modelovým organismem stal také desmid, Penium margaritaceum (Domozych et al., 2009, 2014; Sørensen et al., 2014; Rydahl et al., 2015; Worden et al., 2015). Na rozdíl od Micrasterias má Penium jednoduchý válcovitý tvar, má pouze primární buněčnou stěnu a při expanzi ukládá stěnové polymery na dvou specifických místech povrchu buňky (Domozych et al., 2011). Tato relativní jednoduchost je velmi atraktivní pro objasnění základních principů vývoje rostlinných buněk včetně vývoje buněčné stěny, expanze buněk a dynamiky sekrece (Domozych et al., 2005, 2014; Ochs et al., 2014). Jedním z jejích hlavních atributů je, že má stěnové polymery podobné těm, které jsou přítomny v mnoha suchozemských rostlinách (např. celulóza, pektiny, hemicelulózy), a že tyto polymery lze značit monoklonálními protilátkami. Po označení živých buněk je lze vrátit do kultury, kde lze sledovat následnou expanzi buněk a děje spojené s ukládáním stěn (Domozych et al., 2009; Rydahl et al., 2015). Penium se také snadno udržuje v laboratoři a jeho rychlý růst za přesně kontrolovaných podmínek z něj činí vynikající vzorek pro rozsáhlé souběžné mikroscreeningy mnoha chemických látek (pomocí růstu ve vícejamkových destičkách) a pro hodnocení jejich specifických účinků na expanzi/vývoj stěny (Worden et al., 2015). To významně napomáhá odhalit roli specifických subcelulárních složek a procesů v expanzi/diferenciaci. Nedávná izolace stabilních transformovaných linií (Sørensen et al., 2014) dále zvýšila potenciál této řasy v budoucích studiích rostlinných buněk
Chara a Nitella: Buněční giganti pro rostlinnou fyziologii
Druhy Chara a Nitella (Charophyceae) se již dlouho používají jako vzorky pro různé biologické výzkumy, zejména ty, které se zabývají buněčnou dynamikou, expanzí a cytoplazmatickým prouděním (Green, 1954; Probine a Preston, 1962). Jejich makroskopické tály se vyznačují uzly, kde vznikají větve a gametangia, a internodálními oblastmi, které se skládají z mimořádně protáhlých buněk. Internodální buňky vykazují jasně patrné rozvrstvení subcelulárních složek, kdy šroubovicově orientované chloroplasty vymezují stacionární kůru, která obklopuje endoplazmu, kde dochází k nejrychlejšímu zaznamenanému proudění cytoplazmy generovanému aktinomyozinem. Cytoplazma obsahuje rozmanité endomembránové komponenty, které se účastní dynamických sítí membránového obchodu (např. endocytózy a exocytózy), jež jsou řízeny komplexními signálními transdukčními kaskádami (Foissner a Wastenys, 2000, 2012, 2014; Sommer a kol., 2015; Foissner a kol., 2016). Internodální buňky mají buněčné stěny bohaté na celulózu a pektin, homogalakturonan (HG). Turgor je hlavní hnací silou expanze a pektin je pravděpodobně nosnou složkou řídící expanzi stěny. Cyklická, neenzymatická modulace a současné komplexování HG vápníkem je mechanismus zodpovědný za řízení modulací stěn, které vedou k expanzi buněk (Proseus a Boyer, 2007, 2008, 2012; Boyer, 2016). Jednou z technických výhod Chara a Nitella v buněčném výzkumu je, že internodální buňky lze individuálně odstranit; endoplazma a buněčné stěny mohou být „vypreparovány“ a poté použity jako acelulární systémy pro experimentální manipulaci.
Jiné složky thallusu, jako jsou rhizoidy, mají organizovanou polární organizaci cytoplazmy. Tyto buňky obsahují sedimentovatelné, na minerály bohaté statolity umístěné na vrcholu, které fungují při vnímání gravitace (Hodick et al., 1998; Braun, 2002; Braun a Limbach, 2006). Díky této vlastnosti se Chara stala prvním charofytem ve vesmíru. Během parabolických letů rakety TEXUS se ukázalo, že statolity působí tahovými silami na aktinová vlákna. Rovnováha sil (tj. gravitace a protichůdná síla aktinových vláken) je zodpovědná za správnou polohu statolitů v rhizoidu, které následně zaručují schopnost reagovat na gravitační vektor (Braun a Limbach, 2006). Použití laserové pinzety a mikroskopie na pomalu rotující centrifuze ukázalo, že sedimentace statolitů není dostatečná k tomu, aby způsobila gravitropické ohnutí špičky rhizoidu. Aby došlo ke gravitropickým morfologickým efektům, musí se statolity bohaté na minerály spíše usazovat na specifických oblastech plazmatické membrány (Braun, 2002). Chara byla také použita ke studiu dalších jevů včetně elektrofyziologie a role a pohybu hormonů (Belby, 2016).
Coleochaete pro vývojové studie a vývoj vzorů
Tvorba mnohobuněčného thallu (tj. tkáně, orgánu) rostliny vyžaduje přesné, prostorově regulované roviny buněčného dělení, které jsou řízeny několika sadami genů exprimovaných v určitých bodech během vývoje (Besson a Dumais, 2011; Umen, 2014). Morfogeneze thallusu, řízená jak v trojrozměrném prostoru, tak v čase, se také moduluje v reakci na vnější stresové faktory. U rostlin jsou tyto vývojové programy ještě složitější díky přítomnosti buněčných stěn, které neumožňují migraci buněk ani flexibilitu tkání. Objasnění specifických událostí, které jsou klíčové pro projevy tvaru a velikosti thallusu, je často obtížné rozluštit u suchozemských rostlin, kde je rozlišení specifického chování buněk často špatně rozlišitelné, pokud jsou zasazeny do vysoce komplexních a expanzivních tkání/orgánů. Pro pochopení základních vývojových jevů je výhodné použití organismů s jednodušší konstrukcí thallu a takovým příkladem je charofyt rodu Coleochaete. Některé druhy (např. C. orbicularis, C. scutatum) vytvářejí parenchymatózní diskoidní thallus, který roste směrem ven kombinací antiklinálních nebo periklinálních buněčných dělení a následné expanze jeho vnějších buněk (Brown et al., 1994; Cook, 2004). Rovina dělení každé buňky se řídí jednoduchými pravidly, která vycházejí z velikosti buňky, jejího tvaru a geografického umístění v thallu (Dupuy et al., 2010; Besson a Dumais, 2011). Tato charakteristika umožňuje konstrukci matematických modelů, které lze následně využít k interpretaci mnohobuněčné morfogeneze (Domozych a Domozych, 2014; Umen, 2014) a přináší zásadní poznatky o evoluci, biomechanice a fyziologii orgánů a celých organismů. Některé druhy rodu Coleochaete byly navíc intenzivně studovány za účelem určení strukturálních a funkčních modulací, k nimž dochází na thallu v podmínkách vysychání (Graham et al., 2012), tj. klíčových vlastností pro pochopení evoluce raných suchozemských rostlin a dynamiky růstu rostlin během sucha.
Poznatky z genomických a genových studií
Podobně jako mnoho jiných technologií mají molekulární nástroje schopnost přinášet nové informace důležité pro mnoho oblastí výzkumu, včetně fyziologie a vývoje. Například členové rodiny genů MADS-box byli izolováni a charakterizováni ze tří charofytů, Chara globularis, Coleochaete scutata a Closterium peracerosum-strigosum-littorale (Tanabe et al., 2005). Vzor exprese genů MADS-box u charofytů naznačuje, že hrají roli v haploidním vývoji a rozmnožování (Tanabe et al., 2005). Předpokládá se, že během evoluce suchozemských rostlin byly rekrutovány do diploidní generace a jejich role ve vývoji se dále diverzifikovala (Tanabe et al., 2005). K dnešnímu dni je Klebsormidium flaccidum jediným charofytem, pro který je k dispozici téměř kompletní jaderný genom (Hori et al., 2014); ačkoli chloroplastový a mitochondriální genom byl sekvenován pro zástupce každé ze šesti tříd charofytů a pro některé charofyty jsou k dispozici EST (expressed sequence tags) (Delwiche, 2016). Genom Klebsormidium již odhalil přítomnost genů pro syntézu několika rostlinných hormonů a signálních meziproduktů, mechanismy ochrany proti vysoké intenzitě světla (Hori et al., 2014) a přítomnost transkripčních faktorů WRKY skupiny IIb, o nichž se dříve předpokládalo, že se poprvé objevily u mechů (Rinerson et al., 2015). V současné době probíhá několik projektů sekvenování genomu charofytů (Delwiche, 2016), které umožní podrobnější srovnávací analýzy zahrnující větší počet charofytů a potenciálně poskytnou nový pohled na evoluční vztahy mezi druhy a geny. Jedinečná pozice charofytů jako nejranější divergující skupiny streptofytů z nich činí obzvláště mocný nástroj pro evolučně-vývojové studie a nové technologie, jako je nedávné dosažení stabilní transformace u Penium (Sørensen et al., 2014) umožní zkoumat funkci konkrétních genů.
Budoucí využití charofytů jako modelových organismů
Kritickým dalším krokem ve výzkumu charofytů je analýza genomů inkluzních taxonů a srovnávací studie s genomy suchozemských rostlin. Tato práce nejenže přinese klíčové poznatky o adaptačních mechanismech, které se u charofytů vyvinuly při vstupu na suchozemská stanoviště a jejich úspěšné kolonizaci, ale také dále zpřesní a rozšíří využití současných modelových organismů v základním výzkumu rostlin. Ačkoli molekulární studie podpoří mnoho oblastí výzkumu, dvě oblasti, které budou mít okamžitý přínos, jsou biologie buněčných stěn a dynamika růstových regulátorů v růstu a vývoji. V první z nich by charofyty mohly objasnit mnoho základních, dosud nedostatečně vyřešených jevů, včetně biosyntézy pektinů a proteinů buněčné stěny, řízené sekrece, ukládání a postsekreční modulace polymerů stěny a specifických, interaktivních sítí membránového obchodu v rostlinných buňkách. V posledním případě by modely charofytů pomohly rozluštit molekulární signalizaci, buněčnou biologii a vývojovou dynamiku růstu a vývoje spojenou s hormony, jako je etylen a auxin. Nedávné ekofyziologické studie s charofyty také nabízejí potenciální bonanzu kritických dat při určování toho, jak se rostlinné buňky přizpůsobují stresu, včetně tolerance k vysychání a soli (Holzinger a Karsten, 2013; Pichrtová a kol., 2014; Herburger a kol., 2015; Holzinger a Becker, 2015; Holzinger a Pichrtová, 2016; Kondo a kol., 2016). Budoucnost výzkumu charofytů je skutečně velmi světlá a následně se stane přínosem pro celou rostlinnou biologii.
Příspěvky autorů
Všichni uvedení autoři se na práci významně, přímo a intelektuálně podíleli a schválili ji k publikaci.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Tato práce byla podpořena granty spolupráce NSF (USA) MCB 1517345 a 1517546.
Belby, M. J. (2016). Multiškálový experimentální systém characeanů: od elektrofyziologie membránových transportérů k propojení mezi buňkami, cytoplazmatickému proudění a metabolismu auxinů. Front. Plant Sci. 7:1052. doi: 10.3389/fpls.2016.01052
CrossRef Full Text | Google Scholar
Braun, M. (2002). Vnímání gravitace vyžaduje statolity usazené na specifických plochách plazmatické membrány v rhizoidech a protonematech characeí. Protoplasma 219, 150-159. doi: 10.1007/s007090200016
CrossRef Full Text | Google Scholar
Braun, M., and Limbach, C. (2006). Rhizoidy a protonemata chaluh: modelové buňky pro výzkum polarizovaného růstu a vnímání gravitace rostlin. Protoplasma 229, 133-142. doi: 10.1007/s00709-006-0208-9
CrossRef Full Text | Google Scholar
Graham, L. E. (1993). Původ suchozemských rostlin. New York, NY: John Wiley & Sons, 287.
Google Scholar
Herburger, K., and Holzinger, A. (2015). Lokalizace a kvantifikace kalózy u streptofytních zelených řas Zygnema a Klebsormidium: korelace s tolerancí k vysychání. Plant Cell Physiol. 56, 2259-2270. doi: 10.1093/pcp/pcv139
CrossRef Full Text | Google Scholar
Lemieux, C., Otis, C., and Turmel, M. (2016). Srovnávací analýzy chloroplastových genomů streptofytních zelených řas odhalují významné strukturní změny u Klebsormidiophyceae, Coleochaetophyceae a Zygnematophyceae. Front. Plant Sci. 7:697. doi: 10.3389/fpls.2016.00697
CrossRef Full Text | Google Scholar
Lutz-Meindl, U. (2007). Využití transmisní elektronové mikroskopie s filtrováním energie pro tvorbu snímků a analýzu prvků v rostlinných organismech. Micron 38, 181-196. doi: 10.1016/j.micron.2006.03.017
CrossRef Full Text | Google Scholar
Meindl, U. (1993). Buňky Micrasterias jako modelový systém pro výzkum morfogeneze. Microbiol. Rev. 57, 415-433.
Google Scholar
Pichrtová, M., Kulichova, J., and Holzinger, A. (2014). Omezení dusíku a pomalé vysychání vyvolávají toleranci k vysychání u konjugovaných zelených řas (Zygnematophyceae, Streptophyta) z polárních stanovišť. PLoS ONE 9:e113137. doi: 10.1371/journal.pone.0113137
CrossRef Full Text | Google Scholar
Pickett-Heaps, J. D., and Marchant, H. J. (1972). The phylogeny of green algae: a new proposal [Fylogeneze zelených řas: nový návrh]. Cytobios 6, 255-264.
Google Scholar
Stamenkovic, M., Woelken, E., and Hanelt, D. (2014). Ultrastruktura kmenů Cosmarium (Zygnematophyceae, Streptiophyta) shromážděných z různých geografických lokalit vykazuje druhově specifické rozdíly při optimálních i stresových teplotách. Protoplasma 251, 1491-1509.
Google Scholar
.