Tetrachlorid uhlíku lze vyjádřit jako CCl4 a skládá se z jedné molekuly uhlíku a čtyř molekul chloridu. Tetrachlormethan je nepolární. Proč je tetrachlormethan nepolární? Je nepolární, protože dipólové momenty molekuly jsou rovnoměrně rozloženy kolem centrálního atomu uhlíku. To znamená, že jejich jednotlivé účinky se vyruší a molekula je neutrální.
Čtyři atomy chloru jsou umístěny symetricky ve čtyřech rozích čtyřstěnu a každý z nich spojuje s atomem uhlíku ve středu molekuly jediná vazba. V důsledku toho nemá CCl4 žádný čistý kladný ani záporný dipólový moment. Kdyby byl na jakémkoli jiném místě v molekule umístěn jiný atom než chlor, měla by molekula dipólový moment a CCl4 by byl v důsledku toho polární.
„Organickou chemii definujeme jako chemii sloučenin uhlíku“. – August Kekule
To je rychlá odpověď týkající se polarity tetrachlormethanu. Bylo by však přínosné hovořit o polaritě molekul obecně a prozkoumat tetrachlorid uhlíku a jeho vlastnosti, abychom pochopili, proč je v přírodě nepolární.
Co znamená, že molekula má polaritu?“
Když slyšíte pojem polární, pravděpodobně si vybavíte severní a jižní pól na Zemi. Tyto severní a jižní póly se nacházejí na opačných koncích Země, podobně jako baterie může mít kladný a záporný pól. Polaritu mohou mít také molekuly a vazby mezi atomy. Molekula je definována jako polární, pokud jsou atomy, které ji tvoří, uspořádány tak, že jeden konec molekuly má kladný náboj a druhý konec molekuly záporný náboj.
Polární molekula vzniká, když se atom, který má vysokou hladinu elektronegativity, spojí nebo naváže s atomem, který má slabší hladinu elektronegativity. Vzniklá molekula má jednu oblast s vysokou elektronegativitou a jednu oblast s nižší elektronegativitou neboli elektrické póly. Jedním z nejznámějších příkladů polární molekuly je voda a právě díky polární povaze vody slouží jako základ života na Zemi.
Nepolární molekuly naopak postrádají elektrické póly a elektrony jsou v nich rozloženy rovnoměrněji. Nepolární molekuly postrádají výrazný náboj na obou koncích molekuly. Většina uhlovodíkových kapalin je v přírodě nepolární.
Shrnem lze říci, že molekula, která má dipóly, které se vzájemně neruší, je polární, zatímco nepolární molekuly jsou takové, kde se náboje atomů vzájemně ruší a na jednom nebo druhém konci molekuly není žádný náboj.
Příklady polárních molekul
Jak již bylo uvedeno, voda je polární molekula. Vazby, které existují mezi atomy kyslíku a vodíku, jsou rozloženy tak, že obě strany atomu, jak kyslíko-vodíkové, tak i vazby, jsou rovnoměrně rozloženy. Výsledkem je, že strana kyslíku neboli horní část molekuly má mírně záporný náboj, zatímco atomy vodíku neboli spodní část molekuly má mírně kladný náboj.
Ethanol je polární molekula, protože atomy kyslíku, které jsou v molekule, mají větší elektronegativitu než ostatní atomy. Atomy kyslíku přitahují více elektronů díky svému vyššímu potenciálu elektronegativity a vazebné skupiny -OH v molekule mají celkově záporný náboj, i když je tento záporný náboj velmi slabý.
„Život existuje ve vesmíru jen proto, že atom uhlíku má určité výjimečné vlastnosti.“ – James Jeans
ADVERTISEMENT
Dalšími příklady polárních molekul jsou oxid siřičitý (SO2), sirovodík (H2S) a amoniak (NH3).
Upozorňujeme, že molekula může být složena z polárních vazeb, a přesto může být nepolární. Příkladem je oxid uhličitý, který má čtyři vazby, a přesto se dipólové momenty molekuly nakonec vzájemně neutralizují, takže molekula je nepolární.
Příklady nepolárních molekul

Mezi příklady nepolárních molekul patří dusík, metan, ozon a kyslík. Jedná se o homonukleární molekuly neboli molekuly složené z atomů pouze jednoho prvku. Mezi nepolární molekuly, které nejsou homojaderné, patří výše zmíněný oxid uhličitý a metan. Příkladem nepolárních látek jsou také toluen a benzin. Obecně platí, že sloučeniny uhlíku jsou nepolární, i když existují některé výjimky, například oxid uhelnatý. Oxid uhelnatý je lineární povahy, což by obvykle činilo molekulu nepolární, avšak rozdíl elektronegativit mezi molekulou kyslíku a uhlíku je natolik podstatný, že molekula je polární. Alkiny se ve vodě nerozpouštějí a jsou považovány za nepolární molekuly. Inertní nebo vzácné plyny jsou také klasifikovány jako nepolární molekuly, protože se jedná pouze o jednotlivé atomy příslušných prvků, jako jsou neon, helium, argon a krypton.
Predikce polarity molekuly
Zkoumání hodnot elektronegativity atomů v molekule vám pomůže určit, zda bude molekula pravděpodobně polární nebo nepolární. Výrazné rozdíly mezi hodnotami elektronegativity znamenají, že elektrony jsou mezi atomy v molekule rozděleny rovnoměrně. Protože elektrony budou blíže jednomu atomu než druhému, bude tato oblast molekuly polární, ačkoli pro určení polarity celé molekuly je třeba vzít v úvahu všechny vazby.
Rozhodujícím faktorem polarity či nepolarity molekuly je její geometrie. Pokud má jeden konec molekuly záporný náboj, zatímco druhý konec molekuly má náboj kladný, bude molekula polární. Pokud jsou však náboje rovnoměrně rozloženy a obíhají kolem centrálního atomu, je molekula pravděpodobně nepolární. Na základě toho můžete předpovědět, zda bude molekula polární, nebo nepolární. Ne každá molekula má dipólový moment, a to může předpovídání polarity molekuly trochu ztížit. Jako příklad lze uvést molekuly, které lze převrátit a zrcadlově převrátit přes geometrickou rovinu, nemají dipólové momenty, protože dipólové momenty nemohou obsahovat více než jeden bod.
Fakty o tetrachloridu uhlíku
Tetrachlorid uhlíku poprvé objevil francouzský chemik Henri Victor Regnault v polovině 19. století. Chemická látka byla objevena kombinací chloru a chloroformu. Přesto se dnes tetrachlormethan získává především z methanu. Výroba tetrachlormethanu často funguje tak, že se k získání této sloučeniny používají vedlejší produkty reakcí chlorace. Patří sem vedlejší produkty vzniku chloroformu a dichlormethanu. Tetrachlormethan je ve své podstatě poměrně těkavý a vydává zápach podobný chemikáliím pro chemické čištění. Tetrachlormethan je také rozpouštědlo, a proto je užitečný při rozpouštění nepolárních látek, jako jsou oleje a tuky.
Tetrachlormethan má mnoho různých aplikací a používá se jako čisticí prostředek, jako chladivo a v hasicích přístrojích. Často se tetrachlormethan používá při výrobě lávových lamp, díky čemuž se vosk stává těžším.
„… Je molekula uhlíku lemována myšlenkou?“ – Saul Bellow
Vzhledem k dopadu tetrachlormethanu na životní prostředí jeho výroba od 80. let 20. století prudce klesá. Montrealský protokol omezil výrobu chlorfluoruhlovodíků, a protože tetrachlormethan je klíčovou složkou při výrobě freonů, zaznamenal tetrachlormethan v důsledku toho prudký pokles výroby. Nepříznivé účinky tetrachlormethanu na zdraví rovněž způsobily pokles jeho výroby, a přestože byl kdysi hojně používán jako rozpouštědlo, dnes se k těmto účelům používá jen zřídka.
Tetrachlormethan je extrémně toxický pro játra a jiné látky poškozující játra jsou často srovnávány s toxicitou tetrachlormethanu. Vysoké koncentrace tetrachlormethanu mohou poškodit nejen játra, ale mohou poškodit i ledviny. Dlouhodobé působení tetrachlormethanu může způsobit kóma nebo smrt. Vystavení této chemické látce může také zvýšit pravděpodobnost vzniku rakoviny.
Proč je tetrachlormethan polární?“
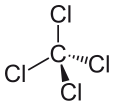
Poté, co dělá molekulu polární, a poté, co jsme se podívali na některé příklady polárních molekul, můžeme nyní lépe pochopit, proč je tetrachlormethan nepolární molekulou. První věc, kterou je třeba udělat, když se snažíme určit, zda je molekula polární a nepolární, je vypočítat hodnoty elektronegativity atomů v molekule. Je třeba zjistit polaritu vazby mezi dvěma atomy a při pokusu o určení polarity molekuly je třeba vzít v úvahu všechny vazby. Přesto rozdíl hodnot elektronegativity mezi chloridem a uhlíkem, v případě tetrachloridu uhlíku, není jediným faktorem, který je třeba vzít v úvahu. Je třeba vzít v úvahu také tvar molekuly. V molekule jsou sice přítomny dipóly, ale lineární tvar tetrachlormethanu znamená, že se účinky různých dipólových momentů v molekule vzájemně ruší a molekula je v důsledku toho neutrální nebo nepolární.
.