V tomto tutoriálu je krok za krokem nakreslena Lewisova struktura oxalátového iontu. Pro nakreslení Lewisovy struktury iontu C2O42- je použit koncept celkových valenčních elektronů. Po dokončení lewisovy struktury C2O42- by měl být náboj -2 a stabilita. O těchto věcech se dozvíte v tomto výukovém programu.
Oxalátový iont | C2O42-
Karbonátový iont má náboj -2 . V oxalátovém iontu jsou dva atomy uhlíku.
C2O42- Lewisova struktura
Dva atomy uhlíku jsou spojeny s jedním atomem uhlíku. Stejně tak další dva atomy kyslíku jsou spojeny s dalšími atomy uhlíku. V lewisově struktuře iontu C2O42- je ion symetrický kolem vazby C-C.
Kroky nakreslení lewisovy struktury C2O42-
K nakreslení lewisovy struktury C2O42- jsou zapotřebí následující kroky, které jsou podrobně vysvětleny v tomto učebním materiálu.
- Zjistěte celkový počet elektronů valenčních slupek atomů uhlíku a kyslíku. To slouží k určení počtu vazeb, osamělých párů kolem atomů.
- Celkový počet elektronových párů kolem atomů
- Výběr centrálního atomu podle maximální valence
- Přidání osamělých párů na atomy
- Kontrola stability a minimalizace nábojů na atomech pro sestavení co nejstabilnější struktury převodem osamělých párů na vazby.
Stejně jako tyto kroky jsou pro nakreslení lewisovy struktury důležité následující skutečnosti.
Kyslík by měl mít v Lewisově struktuře záporné náboje, protože kyslík si rád udržuje elektrony než atom uhlíku.
Elektronegativita kyslíku je vyšší než u uhlíku.
Kreslení správné Lewisovy struktury je důležité pro správné nakreslení rezonančních struktur CO32-.
Celkový počet elektronů valenčních slupek C2O42-
Uhlík se v periodické tabulce nachází ve 4. skupině. Uhlík má tedy ve své valenční slupce čtyři elektrony. Kyslík se nachází v 6. skupině. Ve valenční slupce má šest elektronů.
- Celkový počet valenčních elektronů daných atomem uhlíku = 4 * 2 = 8
V iontu C2O42- jsou čtyři atomy kyslíku, proto
- Celkový počet valenčních elektronů daných atomy kyslíku = 6 *4 = 24
Na iontu C2O42- je -2 náboj. Proto jsou zde další dva elektrony, které přispívají k valenčním elektronům.
- Celkový počet valenčních elektronů = 8 + 24 + 2 = 34
Celkový počet valenčních elektronových párů
Celkový počet valenčních elektronových párů = σ vazby + π vazby + osamělé páry na valenčních slupkách
Celkový počet elektronových párů se určí vydělením počtu celkových valenčních elektronů dvěma. Pro iont C2O42- je celkový počet elektronových párů 17.
Centrální atom iontu C2O42-
Pro to, aby byl centrální atom, je důležitá schopnost mít vyšší valenci. Uhlík má větší šanci být středovým atomem (viz obrázek), protože uhlík může vykazovat valenci 4. Nejvyšší valence kyslíku je 2. Nyní tedy můžeme sestavit náčrtek iontu C2O42-.
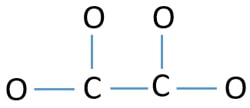
Samostatné páry na atomech
- V uvedeném náčrtku jsou čtyři vazby C-O a jedna vazba C-C, což tvoří pět vazeb. Zbývá tedy pouze dvanáct (17-5 = 12) valenčních elektronových párů.
- Nejprve označte těchto dvanáct valenčních elektronových párů jako osamělé páry na vnějších atomech (na atomech kyslíku). Jeden atom kyslíku přijme tři osamělé páry podle osmičkového pravidla (atom kyslíku si ve své valenční slupce nemůže ponechat více než osm elektronů).
- Při čtyřech atomech kyslíku zbývá dvanáct elektronových párů. Nyní, po vyznačení osamělých párů na atomech uhlíku (mimo atomy), již není třeba vyznačovat osamělé páry na atomech kyslíku.
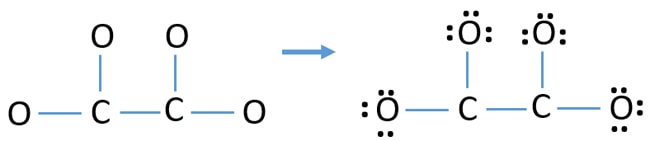
Náboje na atomech
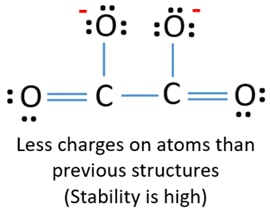
Po, vyznačení elektronových párů na atomech (v tomto případě pouze na atomech kyslíku), bychom měli vyznačit náboje jednotlivých atomů, pokud tam náboj je. Označení nábojů je významné, protože se používá k určení nejlepší Lewisovy struktury iontu. Po označení nábojů uvidíte, že každý atom kyslíku dostane náboj -1 a oba atomy uhlíku dostanou náboj +1.
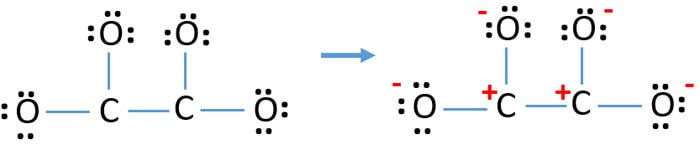
Tato struktura je velmi nestabilní, protože v iontu jsou všude náboje.
Zkontrolujte stabilitu a minimalizujte náboje na atomech převedením osamělých párů na vazby
- Atomy kyslíku by měly mít záporné náboje, protože elektronegativita atomu kyslíku je vyšší než atomu uhlíku. Jinak můžeme říci, že schopnost držet záporné náboje je u atomů kyslíku větší než u atomů uhlíku.
- Nakreslená struktura není stabilní, protože všechny atomy mají náboj (Lewisova struktura by měla být stabilní s menším počtem nábojů).
- Nyní bychom se měli pokusit minimalizovat náboje přeměnou osamělého páru nebo párů na vazby. Převeďte tedy jeden osamělý pár jednoho atomu kyslíku na vazbu C-O.
- Nyní vznikne dvojná vazba mezi jedním atomem uhlíku a jedním atomem kyslíku (jedna vazba C=O). Nyní jsou mezi atomem uhlíku a dalšími třemi atomy kyslíku tři jednoduché vazby (dvě vazby C-O).
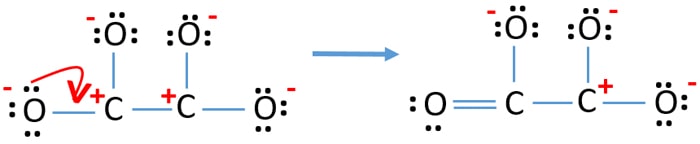
V nové struktuře jsou náboje atomů sníženy oproti předchozí struktuře. Nyní není žádný náboj na jednom atomu kyslíku a jednom atomu uhlíku. Stále však existují náboje na třech atomech kyslíku (mají -1 záporný náboj) a na dalším atomu uhlíku. Nyní chápete, že tato struktura C2O42- je stabilnější než předchozí struktura. Snažíme se však náboje co nejvíce snížit, pokud je to možné.
Náboje dále snižujeme
Můžete převést osamělý pár dalšího atomu kyslíku na vazbu C-O, jak je uvedeno níže.
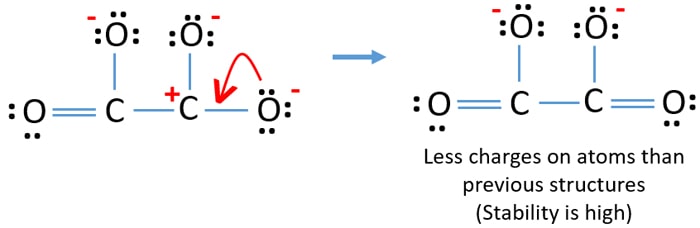
Lewisova struktura C2O42- (uhličitanového) iontu
Otázky
Pokládejte své otázky z chemie a najděte odpovědi
Související výukové materiály
.