Co je to ChIP?
Chromatinová imunoprecipitace neboli ChIP je technologie založená na protilátkách, která se používá k selektivnímu obohacení specifických proteinů vážících se na DNA spolu s jejich cíli. ChIP se používá ke zkoumání konkrétní interakce protein-DNA, několika interakcí protein-DNA nebo interakcí napříč celým genomem nebo podmnožinou genů.
ChIP využívá protilátky, které selektivně rozpoznávají a vážou proteiny, včetně histonů, modifikací histonů, transkripčních faktorů a kofaktorů, a poskytují tak informace o stavu chromatinu a transkripci genů. Kombinace proteomické analýzy a molekulárně biologických technik používaných při ChIP umožňuje porozumět genové expresi a regulaci v buňkách nebo tkáních, které jsou předmětem zájmu.
Kdy se ChIP používá?
Typicky se ChIP používá k určení relativního množství určitého proteinu nebo určité proteinové modifikace v určité oblasti genomu. ChIP lze použít k zodpovězení mnoha vědeckých otázek týkajících se interakce proteinů a chromatinu. ChIP lze například použít k porovnání přítomnosti určitých proteinů v různých lokusech, k mapování různých proteinů v zájmové oblasti genomu nebo ke kvantifikaci vazby proteinu na indukovatelný gen v reakci na podnět v průběhu času.
Jak ChIP funguje?
Princip ChIP je poměrně jednoduchý a spočívá v použití protilátky k izolaci nebo vysrážení určitého proteinu, histonu, transkripčního faktoru nebo kofaktoru a na něj vázaného chromatinu ze směsi proteinů, která byla extrahována z buněk nebo tkání. Odtud pochází název této techniky: Chromatinová imunoprecipitace. Při ChIP-PCR nebo ChIP-seq je pak možné identifikovat a kvantifikovat imunitně obohacené fragmenty DNA pomocí běžně dostupných činidel PCR nebo qPCR a technologií sekvenování nové generace (NGS).
Co je to nativní ChIP (N-ChIP) vs. síťovaná ChIP (X-ChIP)?
Existují 2 typy technik ChIP, které lze provádět v závislosti na experimentální otázce a výchozím materiálu pro experiment: 1) nativní ChIP (N-ChIP) a 2) zesíťovaný ChIP (X-ChIP). Oba typy ChIP mají své výhody a nevýhody:
- Při N-ChIP se k zesíťování proteinů s chromatinem nepoužívá žádné fixační činidlo. Místo toho je nativní chromatin izolován z buněčných jader, která jsou natrávena nukleázou. Protože se protilátky zvyšují proti nefixovaným antigenům, nabízí N-ChIP výhodu lepšího rozpoznání a vazby protilátek na jejich cílové antigeny. Pro následnou analýzu nemusí být nutná PCR vzhledem k vysokému množství histonových proteinů. Ačkoli tyto výhody činí z N-ChIP atraktivní metodu, lze ji použít pouze pro detekci histonů. Kromě toho může ztráta vazby proteinu během kroků štěpení chromatinu a imunoprecipitace zkreslit údaje nebo bránit správným analýzám.
- Při X-ChIP se k zesíťování zájmového proteinu s DNA používají chemická fixativa, jako je formaldehyd, a fragmentace chromatinu se dosahuje sonikací nebo štěpením nukleázami. Výhodou X-ChIP je, že jej lze použít s histonovými i nehistonovými proteiny a obecně vyžaduje méně buněčného výchozího materiálu než N-ChIP. X-ChIP také minimalizuje pravděpodobnost ztráty chromatinových proteinů během extrakce, což umožňuje detekci přechodných proteinových interakcí. Krok precipitace je však méně účinný a pro následné analýzy je nutná amplifikace DNA pomocí PCR.
Jaké jsou různé typy testů ChIP?
Po dokončení samotné imunoprecipitace chromatinu lze provést několik následných analýz purifikovaného chromatinu a souvisejících proteinů, histonů, transkripčních faktorů a kofaktorů. Nejběžnějšími metodami pro analýzu jednotlivých genů a analýzu celého genomu jsou qPCR, respektive ChIP-seq. PCR a ChIP-chip jsou také možnosti následné analýzy.
5.1 Jaké jsou výhody ChIP-PCR?
ChIP-PCR se provádí za účelem analýzy modifikací histonů a/nebo vazby proteinů na známou podmnožinu cílových lokusů v genomu. Při ChIP-PCR se identifikují a kvantifikují imunitně obohacené fragmenty DNA pomocí běžně dostupných činidel a technologií PCR nebo qPCR. Pomocí ChIP-qPCR lze dosáhnout rychlého a kvantitativního porovnání specifických oblastí v genomu u více vzorků. To je levnější a časově efektivnější než metody sekvenování celého genomu.
5.2 Jaké jsou výhody ChIP-čipu?
Technologie ChIP-čipu označuje využití DNA mikročipu k analýze ChIP-imunitně obohacených fragmentů DNA. Použití technologie genomových dlaždicových mikročipů umožňuje celogenomovou analýzu proteinů, které jsou vázány na izolovanou DNA, a vytváří genomovou mapu s vysokým rozlišením vazeb proteinů a jejich modifikací. ChIP-chip má mnohostranné využití v základním výzkumu i ve výzkumu nemocí. Lze jej například použít k identifikaci vazebných míst transkripčních faktorů, enhancerů a represorů a k porovnání těchto typů vázaných proteinů v kontrolních a patologických vzorcích. Protože se však náklady na NGS podstatně snížily a pomocí ChIP-seq lze získat podobné výsledky, stále více lidí se rozhoduje provádět ChIP-seq místo ChIP-chip.
5.3 Jaké jsou výhody ChIP-seq?
Podobně jako ChIP-chip poskytuje ChIP-seq informace o vazbě proteinů v celém genomu. Na rozdíl od ChIP-chip však ChIP-seq využívá technologii NGS k identifikaci fragmentů DNA a jejich mapování vůči celému genomu.
Modernější technologie amplifikace DNA umožňuje provést robustní analýzu během několika dní s malým množstvím vstupní DNA. Pokud je výchozího materiálu málo, umožnily tyto technologické pokroky v metodách přípravy knihoven experimenty ChIP-seq.
Nová technologie, při níž jsou vzorky DNA jedinečně označeny krátkými sekvencemi, známými jako čárové kódy, nyní navíc umožňuje sdružovat jednotlivé fragmenty do jedné sekvenační dráhy pro multiplexní analýzu. To podstatně zvýšilo efektivitu a snížilo náklady na experimenty sekvenování DNA, což dále podporuje aplikace ChIP-seq.
Shrnuto a podtrženo, díky pokroku v technologii sekvenování DNA je výhodou ChIP-seq to, že lze levně sekvenovat velké množství vzorků DNA obohacených o ChIP v relativně krátkém čase s vyšší citlivostí a přesností než u ChIP-chipu.
Jaké jsou jednotlivé kroky v analýze ChIP?
ChIP testy se řídí obecným protokolem:
- Síťování proteinů s DNA pouze pro X-ChIP
- Lýza buněk
- Fragmentace chromatinu štěpením (pro X-ChIP a N-ChIP) nebo sonikací-.(pouze pro X-ChIP)
- Imnoprecipitace pomocí specifických protilátek
- Čištění DNA pro následné analýzy
- Analýza DNA pomocí PCR, qPCR, microarray nebo NGS
Důležité je, že pozitivní a negativní kontroly v každém kroku jsou nedílnou součástí pro určení, zda byl ChIP experiment úspěšný.
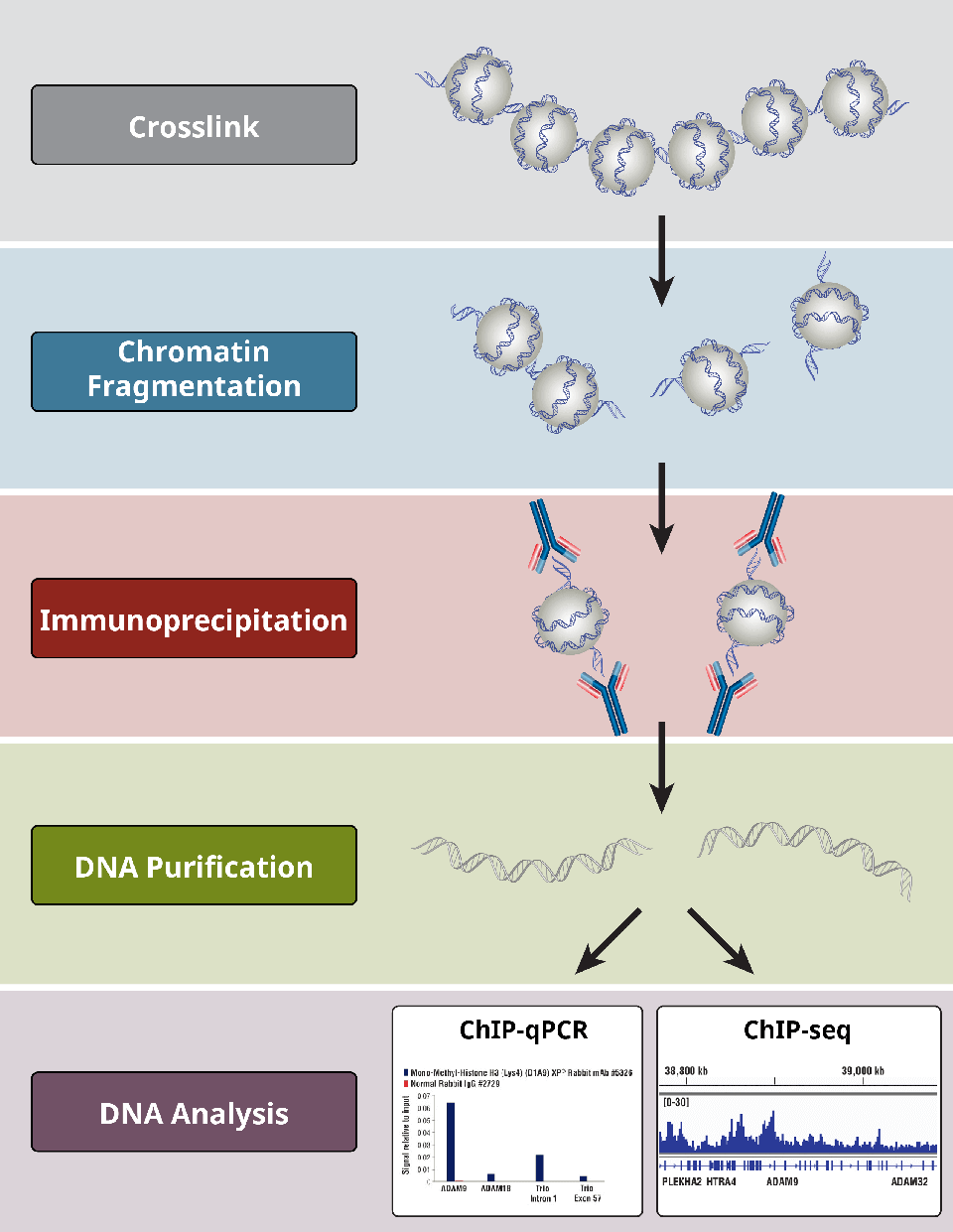
Přehled nejkritičtějších kroků protokolu ChIP
Přehled nejkritičtějších kroků protokolu ChIP.
6.1 Jak se síťují buňky a tkáně pro ChIP?
Síťovací činidla se používají k „fixaci“ proteinů k DNA, kterou vážou. K dosažení této fixace se obvykle používají činidla na bázi formaldehydu. Buňky a tkáně se obecně fixují podobným způsobem, ale tkáně vyžadují delší dobu fixace a rychlejší dodávku fixačních činidel, aby rychle pronikly do cílové tkáně dříve, než začnou degenerovat.
Přílišná fixace chromatinu může snížit účinnost fragmentace sonikací a navíc inhibovat vazbu protilátek na jejich proteinové cíle. Proto by měla být doba fixace stanovena empiricky tak, aby umožňovala maximální vazbu protilátka-antigen a zároveň bylo dosaženo ideálního zesíťování proteinů s jejich cílovou DNA.
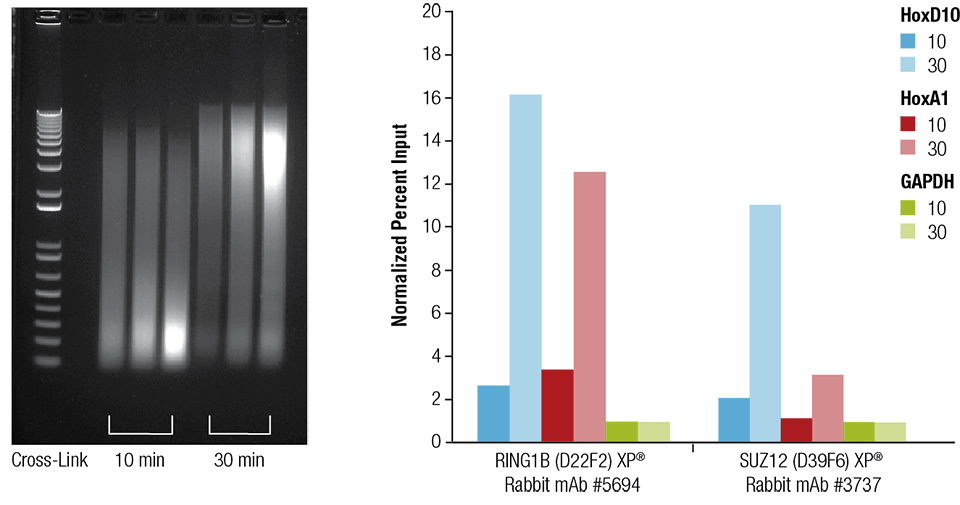
Srdce myší (H), mozek (B) a játra (L) byly zesíťovány po dobu 10 nebo 30 minut, jak je uvedeno (levý panel). Chromatin byl připraven a sonikován po dobu 4 minut. ChIP byl proveden s chromatinem připraveným ze srdeční tkáně s uvedenými protilátkami pomocí sady SimpleChIP® Plus Sonication Chromatin IP Kit #56383 a obohacená DNA byla kvantifikována pomocí PCR v reálném čase s použitím primerů k uvedeným genům (pravý panel). Množství imunoprecipitované DNA v každém vzorku je znázorněno jako normalizovaný signál k negativnímu lokusu GAPDH, který je roven 1.
Srdce myší (H), mozek (B) a játra (L) byly zesíťovány po dobu 10 nebo 30 minut, jak je uvedeno (levý panel). Chromatin byl připraven a sonikován po dobu 4 minut. ChIP byl proveden s chromatinem připraveným ze srdeční tkáně s uvedenými protilátkami pomocí sady SimpleChIP® Plus Sonication Chromatin IP Kit #56383 a obohacená DNA byla kvantifikována pomocí PCR v reálném čase s použitím primerů k uvedeným genům (pravý panel). Množství imunoprecipitované DNA v každém vzorku je znázorněno jako normalizovaný signál vůči negativnímu lokusu GAPDH, který se rovná 1.
6.2 Jak fragmentovat chromatin?
Fragmentace chromatinu je pro úspěch experimentu ChIP nezbytná. Fragmentace chromatinu je nezbytná pro solubilizaci chromatinu a umožňuje jeho koprecipitaci. Kromě toho rozlišení ChIP testu závisí na fragmentaci chromatinu, protože velikost fragmentů DNA určuje rozlišení ChIP testu.
Enzymatické štěpení používá mikrokokovou nukleázu (MNázu), která štěpí dvouřetězcovou DNA mezi nukleosomy a vytváří fragmenty chromatinu. Zatímco úplné štěpení MNázou vytváří fragmenty DNA o délce 150 párů bází (mononukleozomy), neúplné štěpení vytváří fragmenty DNA o délce 150 až 750 párů bází (mono-, di- a tri-nukleozomy). Sonikace využívá k fragmentaci chromatinu mechanickou sílu. Sonikace fragmentuje chromatin mezi nukleosomy a uvnitř nukleosomů, čímž vzniká rozsah chromatinových fragmentů mezi 150 a 1000 páry bází.
Pro X-ChIP se ke střihu chromatinu používá buď enzymatické štěpení, nebo sonikace. Podmínky sonikace v protokolu sonikace ChIP by měly být stanoveny empiricky, protože se liší podle typu buněk a experimentálních podmínek. Podmínky digesce jsou u různých typů buněk a tkání konzistentnější, ale velikost fragmentů chromatinu by se přesto měla před IP analyzovat.
U N-ChIP se k fragmentaci chromatinu používají nukleázy, aby se zachovala vazba proteinů v nefixovaných vzorcích. Fragmentace nukleázami by měla být rovněž stanovena empiricky, aby se minimalizovalo nadměrné trávení chromatinu.
6.3 Proč používat enzymatické trávení pro ChIP?
Pro N-ChIP se musí použít trávení nukleázami, protože proteiny nejsou zesíťovány s DNA a drsné podmínky spojené s fragmentací na základě sonikace by vedly k disociaci proteinů chromatinu od DNA. N-ChIP je ideální pro analýzu interakcí histonových proteinů s DNA, protože vazba histonů s DNA je velmi silná a stabilní. N-ChIP však nefunguje dobře pro analýzu vazby transkripčních faktorů a kofaktorů na chromatin.
K fragmentaci chromatinu při X-ChIP lze použít buď enzymatické štěpení, nebo sonikaci. Mezi výhody enzymatického štěpení patří konzistence fragmentace a mírné podmínky fragmentace (nižší teplota a detergent), které lépe zachovávají integritu chromatinu a epitopů protilátek, což vede k většímu imunologickému obohacení chromatinu vázaného na transkripční faktory a kofaktory.
6.4 Proč používat sonikaci k fragmentaci chromatinu pro ChIP?
Na rozdíl od fragmentace chromatinu dosažené enzymatickým štěpením se sonikace spoléhá na mechanické síly k fragmentaci chromatinu na menší kousky. Ideální velikost fragmentů chromatinu pro obohacení imunity se pohybuje mezi 200 a 1000 páry bází. Sonikace je tradiční metoda používaná k fragmentaci chromatinu a lze ji provádět pomocí tradičního sonikátoru se sondou nebo modernějších sonikátorů s vodní lázní, které poskytují cílenější sonikaci. Sonikace vytváří skutečně randomizované fragmenty chromatinu; vyžaduje však rozsáhlou optimalizaci u různých buněčných linií a tkání a je obtížné ji reprodukovat z experimentu na experiment. Požadavek na vysoký obsah detergentních pufrů a teplo generované během sonikace mohou poškodit integritu jak chromatinu, tak epitopů protilátek na chromatinových proteinech.
6.5 Optimalizace sonikace chromatinu pro ChIP
Fragmentace chromatinu založená na sonikaci tradičně používá vysoký obsah detergentních pufrů a generuje teplo, což obojí může poškodit integritu chromatinu a epitopů protilátek. Proto musí být množství sonikace použité k fragmentaci chromatinu experimentálně stanoveno pro různé buněčné linie a tkáně. Je třeba určit a použít minimální množství sonikace potřebné k vytvoření fragmentů DNA o velikosti 150 až 1000 párů bází, aby se minimalizovalo poškození chromatinu.
Před zahájením úplného testu ChIP s následnou analýzou pomocí qPCR, DNA čipu nebo NGS by se měla použít gelová elektroforéza k analýze vzorků chromatinu sonikovaných po různou dobu. Velikost fragmentů závisí na době sonikace – s rostoucí dobou sonikace se velikost fragmentů snižuje. Údaje však naznačují, že delší doba sonikace nevede k lepším výsledkům. Proto je spuštění přečištěné imunoprecipitované DNA na gelu a stanovení ideální velikosti fragmentu jednoduchou metodou pro určení minimální doby sonikace potřebné pro požadovanou velikost DNA a pro zabránění zbytečnému poškození chromatinu.

Chromatin natrávený enzymem byl spuštěn na agarózovém gelu. Na pruhu 1 je zobrazen chromatin, který je nedostatečně strávený. V pruhu 2 je správně natrávený chromatin a v pruhu 3 je chromatin, který je nadměrně natrávený.
Chromatin natrávený enzymem byl nanesen na agarózový gel. Na pruhu 1 je chromatin, který je nedostatečně strávený. Pruh 2 ukazuje správně natrávený chromatin a pruh 3 ukazuje chromatin, který je nadměrně natrávený.
6.6 Jak vybrat protilátku pro ChIP?
Výběr vhodné protilátky pro experiment ChIP je nedílnou součástí jeho úspěchu. Protilátky použité v experimentu ChIP by měly být specifické pro protein zájmu a mít vysokou afinitu k antigenu. Nejlepší volbou protilátky pro experiment ChIP nebo ChIP-seq je protilátka ověřená pro ChIP nebo ChIP-seq. Pokud pro daný gen není k dispozici žádná protilátka validovaná pro ChIP, je další nejlepší volbou protilátka, která byla validována v IP. Je důležité poznamenat, že ne všechny protilátky validované IP fungují v ChIP a ne všechny protilátky validované ChIP fungují v ChIP-seq. Kromě toho čím více je protilátka validována v jiných aplikacích, jako je western, IP, IF, flow a IHC, tím větší důvěru lze mít ve výkonnost a specifičnost protilátky. Po validaci protilátky musí následovat empirické stanovení optimální koncentrace protilátky spolu s podmínkami promývání IP.
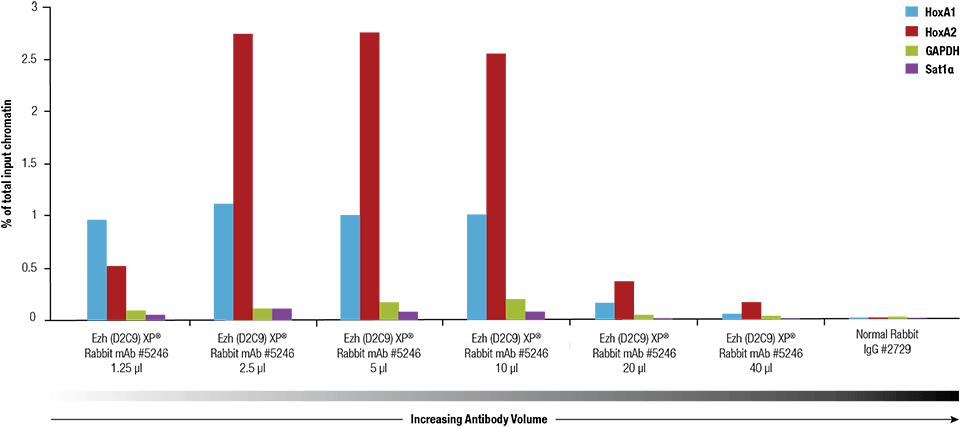
Ezh2 (D2C9) XP® Rabbit mAb #5246 byla titrována pomocí SimpleChIP® Plus Enzymatic Chromatin IP Kit #9005 na zesíťovaném chromatinu připraveném ze 4 x 106 buněk NCCIT.
Ezh2 (D2C9) XP® Rabbit mAb #5246 byla titrována pomocí SimpleChIP® Plus Enzymatic Chromatin IP Kit #9005 na zesíťovaném chromatinu připraveném ze 4 x 106 buněk NCCIT.
6.7 Jak provádět imunoprecipitaci
Protilátky se používají k zachycení zájmového proteinu a jeho navázané DNA. Koncentrace protilátek by měla být stanovena empiricky, přičemž obecný výchozí bod je 0,5-2,0 μg protilátky použité na 10 μg chromatinové DNA (odpovídá přibližně 4 x 106 buňkám). Přísnost pufrů a promývací časy by měly být rovněž stanoveny empiricky, protože závisí na afinitě protilátky k cílovému antigenu. Obvykle se inkubace protilátka:chromatin provádí po dobu 2 hodin až jedné noci.
Komplexy protilátka-antigen (+DNA) jsou afinitně zachyceny na pryskyřici vázající protilátku. Při experimentech ChIP se tato pryskyřice obvykle skládá z magnetických, sefarosových nebo agarosových kuliček třídy ChIP konjugovaných s proteinem A a/nebo proteinem B. Protilátky vážou kuličky s proteinem A a/nebo proteinem G s různou afinitou v závislosti na druhu, u kterého byly vyvinuty, a na podtypu IgG jejich těžkého řetězce. Kuličky se obvykle inkubují s protilátkou:chromatinem po dobu 2 až 4 hodin.
K odstranění chromatinu nenavázaného na protilátku je třeba provést promývací kroky, po nichž následuje obrácení příčných vazeb (pro X-ChIP) a přečištění DNA. Kromě toho je třeba provést kontrolní IP s IgG pro stanovení pozadí (poměr signál:šum). Ke stanovení nespecifické vazby musí být také zahrnuty pozitivní kontrolní protilátky (tj. celkový histon H3) a/nebo pozitivní kontrolní qPCR primery (pro známé pozitivní a negativní lokusy vázající cílové proteiny). Pro dosažení optimálních výsledků by měla být kontrola kvality IP chromatinu pomocí qPCR provedena před následnou analýzou NGS.
6.8 Jak eluovat chromatin z kuliček proteinu A/G
Chromatin se eluuje z kuliček proteinu A/G pomocí detergentu a tepla. K udržení kuliček v suspenzi a ke zvýšení eluce chromatinu je nutné nízkorychlostní „víření“ nebo míchání.
6.9 Jak zvrátit příčné vazby chromatinu
Příčné vazby se zvrátí vysokým teplem a vysokým obsahem soli (obě tyto složky jsou životně důležité). Přidává se také proteináza K, která štěpí přidružené chromatinové proteiny, a přidávají se protilátky, což umožňuje účinnější následné čištění DNA.
6.10 Jak purifikovat DNA
Po odstranění chromatinových příčných vazeb se DNA purifikuje buď pomocí klasických fenol-chloroformových metod s následným srážením etanolem, nebo pomocí souprav pro purifikaci DNA na kolonách.
Jak analyzovat obohacenou DNA
Po přečištění DNA lze provést několik navazujících analýz, včetně ChIP-PCR, ChIP-qPCR, ChIP-chip a ChIP-seq.
7. Jak analyzovat obohacenou DNA?1 Analýza ChIP-PCR a ChIP-qPCR
Analýzy ChIP-PCR a ChIP-qPCR jsou nejvhodnější pro analýzu jednotlivých genů a lze je použít k rychlé a nákladově efektivní amplifikaci a kvantifikaci specifických fragmentů DNA.
7.2 ChIP-chip analýza
ChIP-chip analýza využívající tilingové DNA microarray čipy k vytvoření celogenomové mapy s vysokým rozlišením vazby proteinů a jejich modifikací.
7.3 ChIP-seq analýza
ChIP-seq analýza využívá standardní NGS technologii k vyrovnání purifikované DNA s dříve anotovanými celými genomy k identifikaci celogenomových profilů vazby proteinů.