Abstrakt
Cílem této studie, zaměřené na malý počet případů, je zabývat se angiosarkomem prsu, který představuje méně než 1 % všech nádorů měkkých tkání prsu, a konečně se podělit o naše zkušenosti. V důsledku prs zachovávající terapie (BCT), která je v dnešní době standardní léčbou, byl zvýrazněn nový typ angiosarkomu:
Předkládáme retrospektivní analýzu charakteristických rysů pacientů s RIAS spolu s popisem integrované léčby a výsledků šesti případů RIAS léčených na našem pracovišti v letech 2013 až 2018.
Angiosarkom prsu jako následek chirurgického zákroku a radioterapie byl zaznamenán zřídka, je však dokumentovanou komplikací radioterapie karcinomu prsu s vysokou mírou recidivy a špatnými výsledky.
Zůstává klinicky, radiologicky a histologicky náročný, a proto je u vnímavých pacientů vyžadován vysoký index podezření. Primární možností léčby je prostá mastektomie, nicméně stále více studií se zaměřuje na použití radioterapie a chemoterapie, každá s různou mírou úspěšnosti. Za účelem zvýšení lokální kontroly lze zvážit opětovné ozáření, zatímco chemoterapii lze zvážit u případů v pokročilejším stadiu.
Zkratka
RIAS: Radiation-Induced Angiosarcoma; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: Magnetic Resonance Imaging: magnetická rezonance; IMRT: Intensity-Modulated Radiotherapy
Klíčová slova
Angiosarkom prsu (AS), Radiací indukovaný angiosarkom (RIAS), Radikální mastektomie (RM), Radiací indukované nádory, Adjuvantní radioterapie, Radioterapie s modulovanou intenzitou (IMRT)
Úvod
V této práci je diskutována diagnostika, léčba a výsledky RIAS u malého počtu pacientek s karcinomem prsu.
Jako velmi vzácný cévní nádor lze angiosarkom prsu (AS) rozdělit na primární, pokud vzniká bez známého prekurzoru, nebo sekundární, pokud se vyskytuje v místě dříve ozářené kůže, v takovém případě se označuje jako radiací indukovaný angiosarkom (RIAS) prsu . Stále však neexistují žádná doporučení založená na důkazech, která by se týkala ideální léčby angiosarkomů.
U pacientek, které podstoupí prs zachovávající operaci s adjuvantní radioterapií, se odhadovaná incidence RIAS pohybuje mezi 0,05 a 0,3 %, což představuje méně než 1 % nádorů prsu a přibližně 3 % všech sarkomů měkkých tkání.
Výskyt RIAS se zřejmě zvyšuje, což možná odráží dlouhou dobu latence pro vznik těchto nádorů po širokém rozšíření adjuvantní radioterapie u karcinomu prsu.
Diagnostika RIAS prsu je často opožděná kvůli jeho benignímu vzhledu a obtížnému odlišení od nespecifických kožních změn vyvolaných předchozím ozařováním nebo od jiného onemocnění . Radiologické nálezy jsou rovněž často nespecifické. Ačkoli RIAS vzniká obvykle 10 let po ozařování pro karcinom prsu, doba latence se může pohybovat od 6 měsíců do 20 let , což vede některé autory k názoru, že je pravděpodobně podhodnocena a že skutečná míra výskytu je proto vyšší. Vzhledem k rostoucímu výskytu karcinomu prsu nahrazuje radikální mastektomii jako standardní léčebný postup chirurgický zákrok zachovávající prs a následná radioterapie. Související incidence RIAS rovněž stoupá, přičemž odhadovaná kumulativní incidence je 0,9-3,2 na 1000 případů karcinomu prsu . Ve velké populační kohortové studii byla anamnéza předchozí radioterapie jako léčby karcinomu prsu spojena s 26násobným zvýšením rizika vzniku angiosarkomu ve srovnání s kontrolní skupinou bez ozařování . Prognóza pacientů s RIAS zůstává špatná, přičemž míra celkového pětiletého přežití se pohybuje od 27 do 48 %. Přestože byl RIAS poprvé popsán na počátku 20. let 20. století, jeho molekulární biologie je stále kontroverzní, a proto není k dispozici žádná cílená léčba.
V současné době se jako léčba volby běžně prosazuje agresivní chirurgická resekce. Chybí údaje prokazující účinnost adjuvantní chemoterapie .
Chirurgický zákrok ve formě široké excize nebo mastektomie je základem léčby lokalizovaného onemocnění. Některé studie uvádějí souvislost mezi R0 okraji a lepší mírou přežití, ačkoli nebyla prokázána její nezávislost na jiných biologických faktorech, jako je velikost nádoru . Existují určité důkazy, že neoadjuvantní chemoterapie může zlepšit výsledky léčby angiosarkomu, jehož vzácnost omezuje naše znalosti na kazuistiky nebo malé retrospektivní série případů .
S cílem charakterizovat soubor pacientek s RIAS, léčených v naší nemocnici po dobu 5 let, jsme provedli retrospektivní studii analyzující užitečnost mamografie, ultrazvuku a magnetické rezonance (MRI) pro naši diagnózu .
Naše práce byla podána v souladu s kritérii SCARE .
Materiál a metody
Náš soubor případů se týká pacientek s histologicky prokázaným angiosarkomem prsu, který vznikl po radioterapii karcinomu prsu v letech 2013-2018, a analyzuje strategii léčby s multidisciplinárním přístupem.
Postižené pacientky, šest žen s angiosarkomem prsu vyvolaným zářením, byly identifikovány prostřednictvím komplexního vyhledávání ve výše uvedeném období v onkologickém registru našeho pracoviště, v univerzitní nemocnici v Katánii. Průměrný věk byl 70 let, rozmezí: 59-79 let. Pacientky prováděly předchozí diagnostický a terapeutický management na různých pracovištích, takže nejsou k dispozici všechny informace. Popis charakteristik pacientů a léčebných postupů provedených po stanovení diagnózy RIAS je uveden v tabulce 1. Všechny pacientky podstoupily v době diagnózy prs zachovávající léčbu s adjuvantní radioterapií podávanou konvenční trojrozměrnou konformní radioterapií v celkové dávce 50 Gy, s denní frakcionací 2 Gy, s boostem 10 Gy v lůžku nádoru nebo bez něj. U 3 pacientů byly nádory pravostranné, u dalších 3 levostranné. Během adjuvantní léčby dostávalo pět ze šesti pacientek systémovou chemoterapii na bázi antracyklinů v souladu s institucionálními pokyny, zatímco všechny pacientky dostávaly adjuvantní hormonální léčbu tamoxifenem/aromatázovým inhibitorem. Žádná pacientka neměla v době diagnózy HER2 pozitivní karcinom.
Během sledování, po uplynutí mediánu 7,6 let (rozmezí: 5-11 let), byla provedena diagnostika ipsilaterálního angiosarkomu prsu: nejčastějšími příznaky, které pacientky na počátku onemocnění vykazovaly, byly červenofialově zbarvené kožní uzlíky, lokalizované v kontextu ozařovacích polí, s mírně variabilní rychlostí růstu od několika týdnů do 4-6 měsíců. U všech pacientek byl histologicky potvrzen sekundární angiosarkom a ve všech případech byla provedena radikální mastektomie. Pro diagnostiku RIAS byla dodržena Cahanova a Arlenova kritéria : sarkom vznikající v rámci předchozího ozařovaného pole; doba latence mezi radioterapií a vznikem sarkomu nejméně 3 roky; histologické rozlišení mezi sekundárním sarkomem a primárním nádorem. U všech šesti pacientek bylo provedeno kompletní radiologické vyšetření s mamografií, ultrazvukem a magnetickou rezonancí (u 4/6 pacientek) ve snaze potvrdit klinické podezření na RIAS, ale nebyly zjištěny žádné patognomonické charakteristiky. Rostoucí zájem odborné literatury o identifikaci specifických znaků „radiační signatury“ zatím nepřinesl konsolidované údaje. Tři ze šesti pacientů vyzdvihovaných v naší kazuistice byli předmětem imunohistochemické studie pro hodnocení exprese MYC, která u těchto pacientů prokázala vysokou expresi. Tabulka 1 uvádí také histologické charakteristiky nádoru. Datum diagnózy RIAS bylo definováno jako den, kdy byla stanovena histologická diagnóza. Doba latence byla definována jako doba od prvního ozařování a data diagnózy RIAS. Pouze u jednoho pacienta byly v době diagnózy RIAS zjištěny synchronní metastázy (v plicích), zatímco u ostatních pěti pacientů bylo zjištěno pouze onemocnění prsu.
Tabulka 1: Charakteristiky pacientů a léčebné postupy. Zobrazit tabulku 1
Všichni pacienti podstupující operaci v naší nemocnici byli v předoperační fázi projednáni na multidisciplinární schůzce věnované sarkomům. Pacienti byli klasifikováni jako pacienti s resekabilním onemocněním, pokud předoperační hodnocení ukázalo, že 2 cm nebo většího negativního okraje lze dosáhnout operací s plastickou chirurgickou rekonstrukcí nebo bez ní v podobě jednoho pediklovaného nebo volného myokutánního laloku. Pokud požadované negativní okraje vyžadovaly rozsáhlejší rekonstrukci, například rozsáhlou resurfacingovou plastiku pomocí rozsáhlého kožního štěpu, byl pacient klasifikován jako pacient s neresekabilním onemocněním.
Rychle progredující onemocnění, kdy se objem onemocnění během 2-3 týdnů zvětšil od stavu vhodného pro samotnou mastektomii nebo v kombinaci s pediklovaným lalokem k stavu vyžadujícímu rozsáhlejší rekonstrukci, bylo z onkologického hlediska rovněž hodnoceno jako neresekabilní.
Předoperační biopsie byly prováděny za účelem potvrzení přítomnosti AS a vyloučení jiných onemocnění.
Makroskopicky kompletní resekci zvažoval operující chirurg. Histologicky byla resekce klasifikována jako R0 (mikroskopicky negativní), pokud byly negativní okraje obvodově větší než 1 cm, nebo R1 (mikroskopicky pozitivní), pokud nádor zasahoval do resekčního okraje nebo do vzdálenosti menší než 1 cm.
Čtyři pacienti byli přijati k okamžitému opětovnému ozáření, zatímco jeden pacient byl léčen po 13 měsících, kdy došlo k parietální recidivě (odmítl okamžité opětovné ozáření), poslední pacient byl z opětovného ozáření vyloučen, protože při předchozí léčbě dosáhl dávkových limitů pro srdce. O podání adjuvantní chemoterapie se rozhodovalo případ od případu na základě dostupných údajů o předchozí absolvované léčbě a výkonnostním stavu pacientů. Jedna pacientka dostala čtyři cykly chemoterapie epirubicin-ifosfamid, jedna samotný epirubicin po dobu šesti cyklů, tři byly vyloučeny ze zdravotních důvodů (věk, komorbidity nebo již dříve dosažená toleranční dávka antracyklinů). Jeden pacient dostával týdně paklitaxel po dobu 12 cyklů pro synchronní plicní metastázy.
Radioterapie byla podávána s ohledem na dávky obdržené ze zdravých tkání při předchozím ozařování a předchozím podávání antracyklinů. Z těchto důvodů jsme se rozhodli provést opětovné ozáření pomocí radioterapie s modulovanou intenzitou (IMRT, viz obrázek 1) s použitím techniky step-and-shoot podle našich institucionálních postupů . Dávka záření a frakcionační schéma, které byly použity, se lišily: dvě pacientky dostaly konvenční frakcionaci na 50 Gy, dvě pacientky dostaly 40 Gy (protože doba, která uplynula od předchozího ozáření, byla krátká a novotvar se nacházel na levém prsu), jedna pacientka 35 Gy ve frakci 5 Gy jednou týdně (z důvodu snížené klinické compliance).
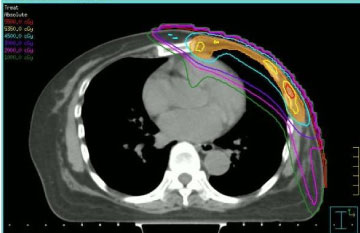 Obrázek 1: Příčný CT obraz s rozložením dávky s modulovanou intenzitou po krocích. Zobrazit obrázek 1
Obrázek 1: Příčný CT obraz s rozložením dávky s modulovanou intenzitou po krocích. Zobrazit obrázek 1
Výsledky
U pacientek, které podstoupily radikální mastektomii provedenou stejným chirurgickým týmem, nebyly zaznamenány žádné pozitivní okraje
Po radikální mastektomii podstoupily pacientky plánovanou léčbu bez přerušení, a to jak chemoterapii, tak radioterapii. Při mediánu doby sledování 22 let (rozmezí: 1,5-4 roky) žijí tři pacientky bez známek recidivy nebo progrese onemocnění. Jeden pacient se synchronními plicními metastázami v době diagnózy stále podstupuje aktivní onkologickou léčbu. U jedné pacientky se objevily plicní a kostní metastázy, ale v době odevzdání práce stále žije. U posledních dvou pacientů se vyvinuly plicní metastázy, z nichž jedna byla spojena s lokální recidivou, a zemřeli po 8-10 měsících (rozložení charakteristik pacientů ve vztahu k projevům onemocnění a absolvované léčbě je popsáno v tabulce 1). Celkově bylo přežití bez nemoci u pěti pacientů bez systémového onemocnění v době diagnózy RIAS 14 měsíců, zatímco přežití bez progrese u pacienta se synchronními metastázami v době diagnózy bylo 12 měsíců.
Jak lze očekávat, horší výsledky přežití, uváděné v literatuře, byly zaznamenány u pacientů s lokálně pokročilým onemocněním nevhodným k chirurgické léčbě ve srovnání s případy v našem souboru. Tyto faktory zdůrazňují význam včasné diagnózy u pacienta s RIAS. Angiosarkomy se často projevují zákeřně fialovými nebo červenými kožními změnami a mohou být snadno zaměněny za modřiny nebo benigní kožní změny, což vede k opožděnému vyšetřování a diagnostice. Včasné odhalení a včasné odeslání může potenciálně snížit počet pacientů vykazujících ireverzibilní onemocnění a zlepšit lokální i vzdálenou kontrolu onemocnění.
Diskuse
Nádory vyvolané zářením obvykle vznikají v kontextu nebo na okraji ozařovacího pole, kde dávka není rovnoměrná a může být ve výsledku nižší, než je nutné k vyvolání destrukce buněk, nebo způsobit mutace, které mohou vést k procesu karcinogeneze. Jako účinek ionizujícího záření vyvolávají chemické a biochemické modifikace vyvolané v živých organismech funkční a morfologické změny buněk, které způsobují biologické poškození. Každá buňka, která je schopna replikace, se může stát potenciálně rakovinnou; pokud se buňky, které vykazují chromozomální modifikace, vymykají normální buněčné kontrole, může dojít ke karcinogenezi.
Pravděpodobnost vzniku nádorů u pacientek podstupujících radioterapii při léčbě karcinomu prsu je velmi nízká a nemůže omezit použití radioterapie v indikovaných případech. Dávky záření nad 50 Gy vyvolávají buněčnou smrt a nižší dávky (
Mnoho studií naznačuje souvislost mezi vznikem sarkomů měkkých tkání a radiační léčbou prováděnou při řešení nádorů prsu. Radioterapie zvyšuje riziko vzniku sarkomů měkkých tkání a zejména vzniku angiosarkomu . RIAS představuje přibližně méně než 1 % nádorů prsu . Radioindukovaný angiosarkom má mnoho klinických projevů: pacientky často vykazují asymptomatické kožní změny, které lze jen stěží odlišit od běžných aktinických změn, které lze nalézt po radioterapii prsu. Pacientky často vykazují hmatný otok, fialovočervenou oblast podobnou hematomu. Angiosarkom může být zaměněn za benigní projevy, jako jsou angiomy nebo atypické teleangiektázie. Mohou se také objevit fialové papuly nebo erytematózní uzlíky.
Přes veškeré terapeutické úsilí se pětileté přežití pohybuje od 27 % do 62,8 % (2-3). Ačkoli se RIAS typicky rozvíjí 10 let po radiační léčbě karcinomu prsu, doba latence se může pohybovat od 6 měsíců do 20 let. Radioindukovaný angiosarkom je k nerozeznání od spontánního angiosarkomu, ale lze hodnotit některé rozdíly: Lae a kol. porovnávali amplifikaci c-myc na chromozomu 8q24.21 u 32 vzorků RASB a 15 vzorků sporadického angiosarkomu .
V našem souboru se u pacientů vyskytovaly nespecifické příznaky onemocnění, ale diagnóza byla ve většině případů stanovena rychle. Doba latence byla v souladu s dobou uváděnou v literatuře, s mediánem 76 let.
RIAS je známý vysokou mírou recidivy. Lokální recidiva, buď v lůžku nádoru, nebo podél chirurgické jizvy, je údajně zjištěna u většiny (96 %) případů RIAS. To je pravděpodobně způsobeno multifokálním růstem RIAS nebo zbytky maligní tkáně po operaci, a to i při negativních chirurgických okrajích. Metastatické onemocnění, nejčastěji do plic a jater, může být přítomno současně nebo krátce po lokální recidivě . Abbott a kol. retrospektivně přezkoumali všechny případy RIAS publikované k roku 2017 a shrnuli údaje . Autoři zjistili, že míra lokální recidivy byla 59 % a že medián doby do recidivy byl 6 měsíců (rozmezí 1-78 měsíců). Zjistili také, že metastatickému onemocnění obvykle předcházela alespoň jedna lokální recidiva a že nejčastějšími lokalizacemi byly plíce, kontralaterální prs a skelet. Jejich histologický přehled 42 případů navíc naznačil, že špatně diferencovaný RIAS je spojen s vysokým rizikem metastazování, zatímco dobře diferencované nádory představují vyšší riziko lokální recidivy než vzdálených metastáz.
Sarkom vyvolaný zářením je vzácný, ale vysoce agresivní nádor. Jeho léčba je předmětem diskusí, protože nejsou k dispozici žádná léčebná doporučení, prognóza je špatná a pětileté přežití se značně liší, jak bylo uvedeno dříve . Přesto se jako léčba volby běžně prosazuje agresivní chirurgická resekce.
Chirurgický zákrok v podobě mastektomie s plastickou rekonstrukcí nebo bez ní je léčbou volby u pacientek s lokalizovaným onemocněním. V sérii léčených pacientek je možné dosáhnout mikroskopicky kompletních (R0) resekčních okrajů u více než 80 %. RIAS se typicky projevují jako multifokální léze. Tendence této patologie vytvářet mikrosatelitní ložiska může přispívat k obtížím při dosahování lokální kontroly.
V literatuře je zdůrazňována důležitost provedení kompletní patologické resekce, ačkoli nebyly publikovány žádné standardní pokyny týkající se doporučené vzdálenosti odstupu. V současné sérii bylo zjištěno, že ti, u nichž došlo k lokální recidivě, měli bližší okraje než ti, u nichž k ní nedošlo. Nebylo však zjištěno, že by stav okrajů byl v této sérii nezávislým prognostickým faktorem onkologických výsledků. To by naznačovalo, že schopnost dosáhnout větších okrajů závisí na dalších biologických faktorech nádoru, které rovněž určují výsledek, jako je velikost. Je pravděpodobné, že za výsledek u RIAS je zodpovědná především biologie nádoru, ačkoli by úvodní operace měla směřovat k makroskopickému vyčištění, je třeba upozornit, že dosažení větších negativních okrajů se nemusí nutně rovnat lepším výsledkům pacientů.
Přes rostoucí počet studií zaměřených na chemoterapii a radioterapii, ať už neoadjuvantní nebo adjuvantní, zůstává jejich role nejasná. Chybí údaje prokazující účinnost adjuvantní chemoterapie, nedávné údaje naznačují, že radioterapie může být užitečná v prevenci recidiv . Adjuvantní radioterapie po operaci podle Johnstonea et al. umožňuje lepší lokální kontrolu . Úloha IMRT v léčbě hrudní stěny je v současné době hodnocena, protože může snížit míru výskytu radiační toxicity snížením ozáření rizikových orgánů (OAR) . Ve srovnávací dozimetrické studii autoři uvádějí, že plán IMRT na hrudní stěnu a cíl ve srovnání s konvenční léčbou umožňuje snížit maximální dávku, zvýšit minimální dávku, což vede k lepší shodě a rovnoměrnosti cílového objemu .
Úloha a účinnost chemoterapie nebyla stanovena, protože dostupné údaje pocházejí z malých skupin vzorků, z nichž nelze vyvodit jednoznačné závěry, ale pravděpodobně pacienti s vyšším stupněm malignity, G3 a s recidivou, by mohli mít největší prospěch z neo nebo adjuvantní chemoterapie .
V rozsáhlé retrospektivní sérii pacientů se sarkomy všech lokalizací vyvolanými zářením bylo rovněž zjištěno, že použití neo/adjuvantní chemoterapie je spojeno s lepší lokální kontrolou onemocnění, i když není spojeno se zlepšením míry systémové recidivy nebo přežití . Nebylo zjištěno, že by adjuvantní chemoterapie přinášela prospěch z hlediska lokální kontroly nebo celkového přežití studie vysoce rizikových sarkomů měkkých tkání léčených chirurgicky a ozařováním . Existují tedy jen omezené důkazy o tom, že neoadjuvantní chemoterapie přináší u RIAS benefit v oblasti přežití, ačkoli jistě může být užitečná jako indukční léčba před operací u pacientů s lokálně pokročilým onemocněním a může pacientům navíc nabídnout účinnou paliaci onemocnění. Cílená léčba může nabídnout alternativní léčbu u pacientů s progresivním onemocněním.
V našem souboru jsme se v důsledku vysoké tendence k lokální recidivě tohoto nádoru rozhodli navrhnout všem pacientům druhé ozáření, s výjimkou jednoho z nich pro výše uvedené dozimetrické problémy. Jeden pacient odmítl okamžité opakované ozáření a léčba byla provedena při recidivě. Pro všechny pacienty nebylo možné naprogramovat homogenní ozařování, a to z důvodu heterogenity vzorku pro dříve použité ozařovací dávky, špatné klinické compliance v jednom případě a především nedostatku jasných indikací literatury a guidelines. V každém případě jsme se rozhodli poskytnout léčbu technikou modulované intenzity, abychom umožnili adekvátní distribuci dávky, snížení dávkového ozáření okolních zdravých tkání, zejména pro základní plicní parenchym a srdce.
Závěry
Radioterapie při léčbě karcinomu prsu je spojena se zvýšeným rizikem následného vzniku sarkomu, ale procento rizika je velmi nízké.
RIAS je vzácná, agresivní léze měkkých tkání s omezenými možnostmi léčby a vysokým procentem lokálních i systémových recidiv.
Po adjuvantní radioterapii je nutné pečlivé sledování. Standardní léčba zahrnuje operaci s prostou mastektomií a adjuvantní radioterapii. Chemoterapie může hrát roli při zmenšování lokálně pokročilého onemocnění, i když nemá prokázaný vliv na přežití.
Angiosarkom se výrazně častěji vyskytuje v případech léčených radioterapií, vyskytuje se zejména v ozařovacím poli nebo v jeho sousedství. Malý rozdíl v riziku vzniku následného sarkomu u pacientek s karcinomem prsu, které podstoupily radioterapii, nenahrazuje přínos radioterapie.
Naše série je však příliš malá na to, abychom mohli vyvodit konečné závěry, a to je omezení studie. Je nutné další hodnocení, a to i prostřednictvím většího počtu případů, aby bylo možné lépe klasifikovat patologii a umožnit přesnější multidisciplinární léčbu.
Konflikty zájmů
Nikdo z autorů nemá žádný konflikt zájmů, který by musel zveřejnit.
Zdroje financování
Žádné.
Etické schválení
Schválení bylo uděleno etickou komisí Univerzity v Katánii.
Informovaný souhlas
Písemný informovaný souhlas se zveřejněním této kazuistiky a doprovodných snímků byl získán od pacienta. Kopie písemného souhlasu je na vyžádání k dispozici k nahlédnutí u šéfredaktora tohoto časopisu.
Příspěvky autorů
Trovato Agata: Recenzování a úprava článku.
Registrace výzkumných studií
Žádná.
Zveřejnění informací
Nikdo z autorů nemá co zveřejnit.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Primary and secondary angiosarcoma of the breast. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Long-term outcomes in patients with radiation-associated angiosarcomas of the breast following surgery and radiotherapy for breast cancer. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma: a large-scale single-institution review. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Cutaneous radiation-associated angiosarcoma of the breast: poor prognosis in a rare secondary malignancy. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Clinical management of secondary angiosarcoma after breast conservation therapy. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Radiation-induced sarcoma of the breast: a systematic review. Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Zvýšené riziko vzniku sarkomu měkkých tkání po radioterapii u žen s karcinomem prsu. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Radiation-associated angiosarcoma after breast cancer: high recurrence rate and poor survival despite surgical treatment with R0 resection. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Surgical management of radiation-induced angiosarcoma after breast conservation therapy. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Lokalizované angiosarkomy: identifikace prognostických faktorů a analýza dopadu léčby. A retrospective analysis from the French Sarcoma Group (GSF/GETO) Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Thalidomid v kombinaci s neoadjuvantní chemoterapií u angiosarkomu prsu s kompletní patologickou odpovědí: kazuistika a přehled literatury. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Neoadjuvantní chemoterapie primárního angiosarkomu kůže/měkkých tkání: stanovení chování nádoru před chirurgickou resekcí. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Contralateral lymph node metastasis in a woman with new primary breast cancer: Systémová desease nebo lokoregionální difúze? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S a další (2016) The SCARE Statement: Consensus-based surgical case report guidelines (Pokyny pro hlášení chirurgických případů založené na konsenzu). Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Sekundární sarkomy po radioterapii karcinomu prsu: trvalé riziko a špatné přežití. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) Can c-myc amplification reliably discriminate postradiation from primary angiosarcoma of the breast? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiosarkom prsu po operaci a radioterapii karcinomu prsu. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarkom po prs zachovávající léčbě. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Dosimetrické hodnocení integrované IMRT léčby hrudní stěny a supraklavikulární oblasti u karcinomu prsu po modifikované radikální mastektomii. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Adjuvantní chemoterapie doxorubicinem, ifosfamidem a lenograstimem u resekovaného sarkomu měkkých tkání (EORTC 62931): multicentrická randomizovaná kontrolovaná studie. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Breast tuberculosis cases rising in Sicily. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Role, načasování a technika radioterapie u dětského pleuropulmonálního synoviálního sarkomu. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Intensity-modulated radiotherapy for relapsed malignant pleural mesothelioma. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Single-institution experience of intensity-modulated radiotherapy for malignant pleural mesothelioma at University of Catania. Future Oncol 14: 17-21.
Citace
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) A Single Institution Study Experience of Secondary Breast Angiosarcoma after Breast Conserving Treatment: Výsledky: multidisciplinární léčba. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114
.