08. 8. 2019
Zmíníme-li ApoE a Alzheimerovu chorobu, řeč se stočí na alelu E4, nejsilnější gen náchylnosti k této chorobě. ApoE má však i druhou stránku, a to ApoE2. Ačkoli tato izoforma chrání před Alzheimerovou chorobou, vědci ji téměř nezkoumali. Nyní ApoE2 přitahuje pozornost, protože vědci se ptají, jak přesně si někteří lidé udržují mentální ostrost až do vysokého věku. Na mezinárodní konferenci Alzheimerovy asociace, která se konala 14.-18. července v Los Angeles, studie genotypů ApoE u 5 000 pitvou potvrzených případů AD odhalila, že u lidí se dvěma kopiemi E2 klesá riziko demence o ohromujících 90 % ve srovnání s lidmi s běžným genotypem E3/E3. Další práce naznačují, že by to mohlo být způsobeno tím, že ApoE2 snižuje patologii amyloidu a tau a zvyšuje objem šedé hmoty v kritických oblastech mozku. Zdá se, že výhody E2 jsou specifické pro Alzheimerovu chorobu, nikoliv obecné pro neurodegeneraci.
ApoE je hlavní protein přenášející cholesterol v mozku. Je studován od svého objevení jako rizikový gen pro AD na počátku 90. let 20. století, ale nově se ukazuje jako centrum gliových reakcí na ukládání amyloidu a tau agregátů (zprávy z srpna 2018; zprávy ze září 2017). Gen existuje ve formě tří polymorfních alel – E2, E3 a E4 – s celosvětovou frekvencí 8 %, 78 % a 14 %. Je známo také několik mutovaných forem, například tzv. mutace Heidelberg, Pittsburgh a Christchurch (Feussner et al., 1992; Kamboh et al., 1999; Wardell et al., 1987).
ApoE4 je věnována zdaleka největší pozornost výzkumníků AD, protože zvyšuje riziko AD až 15krát v závislosti na studované populaci a vyskytuje se u 40 % osob s AD. E2, ochranné alele, je věnována jen malá pozornost, protože je nejméně častá ze všech tří a ve vzorcích s AD se většinou nevyskytuje. Lidé s jednou kopií E2 mají poloviční šanci na rozvoj AD ve srovnání s lidmi s častějším genotypem E3/E3. Má však dodatečný E2 nějaký další vliv? „Nevěděli jsme, zda má dávka E2 rozdílné riziko, tj. zda je riziko E2/2 významně nižší než E2/3,“ řekl Eric Reiman při prezentaci studie.
Aby to zjistili, rozhodli se Reiman a jeho kolegové z Banner Alzheimer’s Institute ve Phoenixu, Gyungah Jun z Bostonské univerzity, Joseph Arboleda z Massachusetts Eye and Ear, Yakeel Quiroz z Massachusetts General Hospital a kolegové z AD Genetics Consortium prozkoumat data z mnoha mozků. Analyzovali podíl všech tří alel ApoE na riziku demence a patologii v 5 007 mozcích z ADGC. Tento vzorek zahrnoval 4 018 případů Alzheimerovy demence potvrzených pitvou a 989 patologicky a kognitivně nepostižených dárců. Kromě toho, že tato kohorta poskytla dostatečné počty pro studium homozygotů E2/E2, vyhnula se také problému chybné diagnózy tím, že vyloučila demence, které nebyly způsobeny AD, a také osoby, které měly v době úmrtí patologii AD, ale neměly demenci.
Podle očekávání byli homozygoti ApoE2 vzácní – bylo jich pouze 24 z více než 5 000 osob, tedy 0,5 %. Ve srovnání s ostatními genotypy u nich byla pravděpodobnost výskytu AD mnohem nižší. Homozygoti E2 tvořili 0,1 % případů, ale 1,9 % zdravých kontrol. Naproti tomu homozygoti ApoE4/4 tvořili 15,6 procenta případů a pouze 1 procento kontrol. Jinými slovy, 19 z 24 ApoE2/2 bylo kognitivně zdravých, ale pouze 10 z 633 ApoE4/4.
Homozygoti E2 měli 66procentní snížení rizika dokonce i ve srovnání s nositeli E2/3, 87procentní snížení rizika ve srovnání s nejčastějším genotypem E3/3 a neuvěřitelné 99,6procentní snížení rizika ve srovnání s lidmi, kteří byli E4/4. V podstatě většina lidí s E4/4 onemocní Alzheimerovou demencí, zatímco jen málo lidí s ApoE 2/2.
Mít dvě alely E2 korelovalo s menší patologií amyloidního plaku a tau neurofibrilární spleti. Ochranný účinek ApoE2 na patologii tau byl stále patrný i po úpravě na zátěž amyloidními plaky. To odráží nedávné údaje ze zvířat, které naznačují, že ApoE4 působí na zhoršení patologie tau nezávisle na amyloidu (Shi et al., 2017).
Hlavní zjištění nové studie opakuje zjištění předchozí studie Pietera-Jelle Vissera z Maastrichtské univerzity v Nizozemsku a jeho kolegů. Ti ve vzorku 7 583 osob nalezli 16 nositelů ApoE2/2, z nichž 10 bylo kognitivně normálních a negativních na amyloid, zatímco 301 z 386 nositelů ApoE4/4 ve vzorku mělo Alzheimerovu demenci. Tento vzorek však nebyl patologicky potvrzen (Jansen et al., 2015).
Jak důležité je neuropatologické potvrzení? Reiman et al. porovnávali odhady rizika odvozené ze souboru ověřeného pitvou s odhady vypočtenými ze souboru 23 857 žijících osob, u nichž byla klinicky diagnostikována pravděpodobná AD demence nebo byly kognitivně normální a u nichž nebyl znám stav amyloidu. V této analýze byl ochranný účinek 2/2 i zvýšené riziko způsobené 4/4 podhodnoceny. Vědci například zjistili, že poměr šancí spojený s E4/E4 oproti E3/E3 v klinickém vzorku byl 10,7 oproti 31,22 v patologicky potvrzených případech. Vliv dávky pro E2 i E4 byl v živém vzorku rovněž podhodnocen. Analýza pitvy tedy poskytuje aktualizované a pravděpodobně přesnější odhady rizika pro všechny genotypy ApoE, domnívají se Reiman a kolegové, přinejmenším pro tyto účastníky výzkumu, kteří nejsou běloši.
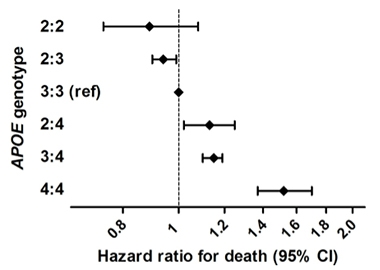
Prodloužení života. V rozsáhlé epidemiologické studii kombinující šest populačních kohort lidí s evropským původem měli homozygoti ApoE2 nižší riziko úmrtí než ostatní genotypy. Nejvíce ohroženi byli homozygoti ApoE4.
Je známo, že vliv ApoE na Alzheimerovu chorobu se u jednotlivých etnických skupin liší. Je třeba provést tento typ studie s různorodějšími subjekty, s větším počtem homozygotů E2/2 a s přihlédnutím k možnému vlivu alel ApoE na přežití, který by mohl výsledky zkreslit. Nicméně Reiman řekl: „Naše výsledky naznačují, že homozygozita ApoE2 je spojena s mimořádně nízkým rizikem AD, že vliv APOE a jeho variant na riziko AD je podstatně větší, než se dosud předpokládalo, a že existuje pádný důvod pro objevení léčby, která tento ochranný účinek podporuje.“
To se shoduje s nedávnými výsledky Sudhy Seshadri, University of Texas Health, San Antonio, Franka Wolterse, Erasmus Medical Center, Rotterdam, Nizozemsko, a jeho kolegů. Ti ve studii 38 537 osob ze šesti populačních kohort zjistili výhodu v přežití pro nositele ApoE2 (Wolters et al., 2019). Identifikovali 239 homozygotů E2, kteří vedli nejdelší život. Účinek E2 byl jen částečně vysvětlen jeho vlivem na krevní lipidy nebo cévní onemocnění. Nejvyšší riziko úmrtí měli homozygoti E4, což bylo z velké části vysvětleno jeho spojením s demencí. Seshadri pro Alzforum uvedl, že výzkumníci se u tohoto vzorku budou zabývat AD a kognitivními změnami a také měřením amyloidu a tau PET.
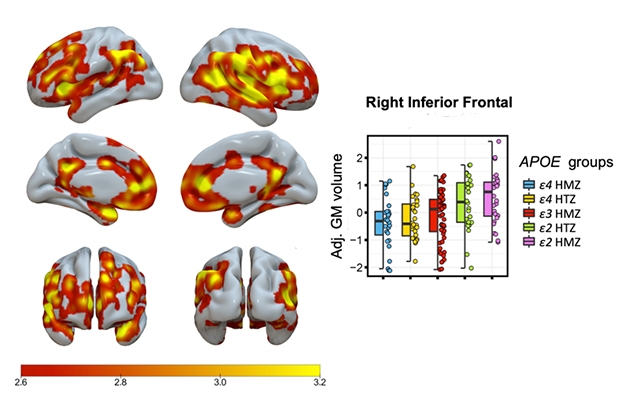
Kousek po kousku. Stínování označuje oblasti s významným postupným, s genotypem ApoE souvisejícím nárůstem objemu šedé hmoty, přičemž homozygoti E4/4 mají nejnižší a E2/2 nejvyšší objem. Graf znázorňuje údaje pro jednu oblast mozku.
Jak může ApoE2 propůjčovat odolnost? Aby to zjistila, představila Gemma Salvadó, Barcelonaβeta Brain Research Center, Španělsko, studii, v níž spolu se spoluautory shromáždila zobrazovací data z různých vzorků u co největšího počtu starších homozygotů ApoE2. Jejich cílem bylo porovnat strukturu mozku homozygotů E2/2 se strukturou mozku ostatních genotypů ApoE.
Předtím byl E2 spojován s jemnými změnami v morfologii mozku u zdravých lidí, včetně pomalejší atrofie hipokampů ve stáří a větších hipokampů ve středním věku (Chiang et al., 2010; Fennema-Notestine et al., 2011). Bylo zjištěno, že v dětství mají nositelé E2 silnější entorhinální kůru než homozygoti E3 nebo nositelé E4 (Shaw et al., 2007). Všechny tyto studie se však zaměřovaly na lidi s jednou kopií E2.
Aby Salvadó zjistil, co by tento dodatečný E2 udělal, shromáždil a analyzoval údaje z magnetické rezonance u lidí s kognitivní poruchou ve studii ALFA v Barceloně (Molinuevo et al. 2016), v kohortě Amsterdam University Medical Center, v otevřených zobrazovacích studiích OASIS a ADNI. Nalezla 28 homozygotů E2/E2. Každého z nich porovnala s pěti dalšími subjekty ze stejného centra podle věku, pohlaví a úrovně vzdělání a s jedním od každého dalšího genotypu ApoE. To dalo celkem 168 subjektů, jejichž průměrný věk byl 62 let.
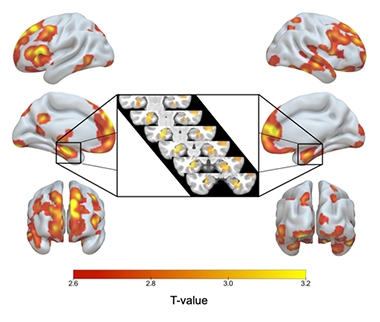
ApoE2/2 Nad 3/3. Zjistila, že se jednalo o osoby s genotypem ApoE2. Červené až žluté stínování označuje oblasti mozku, kde měli homozygoti ApoE2 více šedé hmoty než homozygoti E3, včetně obou hipokampů (vložka).
V porovnání se svými protějšky E3/3 měli E2/2 větší objem šedé hmoty v hipokampu a dalších oblastech charakteristických pro AD, včetně mediální temporální kůry, dolního temporálního, temporálního pólu, precuneu a horní parietální oblasti. Homozygoti E2 měli také více šedé hmoty v oblastech souvisejících s kognitivní odolností ve stáří, konkrétně v předním cingulátu a mediálních prefrontálních oblastech (Arenaza-Urquijo et al., 2019; Harrison et al., 2018). Ve srovnání s heterozygoty E2/3 se homozygoti E2 mohli pochlubit jen málo významnými rozdíly v šedé hmotě, ale měli ještě větší hipokampy než 2/3. V porovnání s heterozygoty E2/3 se homozygoti E2 mohli pochlubit ještě většími hipokampy.
Salvadó zaznamenal stupňovitý, s genotypem související nárůst objemu šedé hmoty, přičemž homozygoti E4/4 měli nejmenší, E3/3 střední, E2/3 vyšší a E2/2 největší objem (viz obrázek níže).

ApoE2/2 nad 2/3. Ve srovnání s dalším protektivním genotypem, ApoE2/3, mají homozygoti E2 více šedé hmoty pouze v několika malých oblastech.
Podle ní může větší množství šedé hmoty ve strategických oblastech mozku pomoci homozygotům E2 vyrovnat se s patologií AD, pokud a kdy se objeví. Protože ApoE2 zvětšuje entorhinální kůru již v dětství, může podle ní odolnost pramenit z vývojových procesů.
„Jsou to velmi důležitá zjištění,“ komentoval Reiman. „Naznačují, že pokud je atrofie jako erodování běhounu v pneumatikách, homozygoti E2 mohou začínat s větším běhounem,“ řekl. Salvadó se snaží studii rozšířit a zkoumat více homozygotů z dalších kohort a další způsoby zobrazování.
Terry Goldberg z Kolumbijské univerzity v New Yorku se již několik let zabývá možnými mechanismy neuroprotekce zprostředkované ApoE2 (Conejero-Goldberg et al., 2014). Na AAIC Goldberg prezentoval výsledky týkající se vztahu alel ApoE s neuropatologií u AD a rozšířil analýzu na další onemocnění.
Použil údaje o 1 557 mozcích z databáze Národního koordinačního centra pro Alzheimerovu chorobu, které měly klinické i neuropatologické hodnocení. Protože měl tak málo homozygotů E2, Goldberg seskupil genotypy E2/E2 a E2/E3 dohromady, čímž získal vzorek 130 osob. V této kombinované skupině měl každý čtvrtý mozek AD neuropatické změny, zatímco u E3/3 to bylo 40 %, u E3/4 65 % a u E4/4 85 %. V souladu s předchozími pracemi měli nositelé E2 nejmírnější patologii amyloidu, nejméně neuritických plaků a nejmírnější patologii tau. Statistická mediační analýza naznačila, že souvislost ApoE2 se sníženým výskytem tanglů probíhala částečně prostřednictvím jeho vlivu na amyloid a částečně byla na amyloidu nezávislá. To se shoduje s Reimanovými výsledky.
I v tomto souboru dat ApoE2 silně chránil, i když Goldberg nerozlišoval homozygoty: E2 snížil riziko amyloidové a tauové patologie o polovinu ve srovnání s E3 a o 90 % ve srovnání s E4.
Který je silnější, E2 nebo E4? Při srovnání genotypů E2/E4 a E3/E4 zjistil Goldberg srovnatelnou úroveň patologie. Pokud něco, tak dvojice E2/E4 byla horší. To naznačuje, že E4 přebíjí ochranné účinky E2. „Dalo by se říci, že E4 je toxický,“ uzavřel Goldberg. To podle něj naznačuje, že terapie využívající virové konstrukty k zavedení E2 do mozkové tkáně exprimující E4 nemusí být užitečná.
Co ostatní neurodegenerativní onemocnění?
Literatura nabízí smíšené výsledky týkající se E2 a E4 u frontotemporální demence. Některé studie naznačují, že E2 podporuje riziko (zpráva z března 2016), zatímco jiné mu připisují ochranu a riziko přičítají E4 (Mishra et al., 2017). Na AAIC Goldberg uvedl, že E2 byl spojen se závažnější patologií TDP-43 u 103 případů frontotemporální demence a s větší patologií tau u 28 případů Pickovy choroby a 51 případů progresivní supranukleární paralýzy. Upozornil, že tato čísla jsou tak malá, že výsledky mohou být falešné. Goldberg neví, zda tito pacienti měli mutace C9ORF72 nebo progranulinu, a akumulace TDP-43 může souviset s věkem. V případě patologie α-synukleinu Goldberg zjistil, že ApoE4 podporuje a E2 snižuje šíření patologie Lewyho tělísek mimo jejich původ ve středním mozku, do limbických a neokortikálních oblastí
Souhrnně tyto studie poukazují na obnovené uznání obrovského vlivu ApoE na patogenezi AD (viz například Wu a Zhao, 2016). Hluboká ochrana poskytovaná E2 pravděpodobně znovu vzbudí zájem vývojářů léků, kteří to již dříve zkoušeli a neuspěli, ale nyní možná uznají za vhodné se k tomuto cíli vrátit.-Pat McCaffrey
Novinky Citace
- ApoE: Společný mikrogliální viník stárnutí, Alzheimerovy choroby a tauopatie? 11. 8. 2018
- ApoE4 zhoršuje vše, co se týká Tau, od začátku do konce 20. 9. 2017
- Et Tu, ApoE2? Paper Claims Alle Boosts Risk for Dementia-in ALS 1 Mar 2016
Paper Citations
- Feussner G, Funke H, Weng W, Assmann G, Lackner KJ, Ziegler R.Severe type III hyperlipoproteinemia associated with unusual apolipoprotein E1 phenotype and epsilon 1/’null‘ genotype. Eur J Clin Invest. 1992 Sep;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST.A novel mutation in the apolipoprotein E gene (APOE*4 Pittsburgh) is associated with the risk of late-onset Alzheimer’s disease. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoprotein E2-Christchurch (136 Arg—-Ser). Nová varianta lidského apolipoproteinu E u pacienta s hyperlipoproteinémií typu III. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.ApoE4 výrazně zhoršuje neurodegeneraci zprostředkovanou tau v myším modelu tauopatie. Nature. 2017 Sep 28;549(7673):523-527. Epub 2017 Sep 20 PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Prevalence mozkové amyloidní patologie u osob bez demence: metaanalýza. JAMA. 2015 May 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE investigators.Vliv genotypu APOE na přežití: Výsledky 38 537 účastníků ze šesti populačních kohort (E2-CHARGE). PLoS One. 2019;14(7):e0219668. Epub 2019 Jul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .hippocampal atrophy rates and CSF biomarkers in elderly APOE2 normal subjects. Neurology. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.Presence of ApoE ε4 allele associated with thinner frontal cortex in middle age. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN.Cortical morphology in children and adolescents with different apolipoprotein E gene polymorphisms: an observational study. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.The ALFA project: Výzkumná platforma pro identifikaci časných patofyziologických rysů Alzheimerovy choroby. Alzheimers Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3 PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P. The metabolic brain signature of cognitive resilience in the 80+: beyond Alzheimer pathologies. Brain. 2019 Apr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ.Brain morphology, cognition, and β-amyloid in older adults with superior memory performance [Morfologie mozku, kognice a β-amyloid u starších dospělých s vynikající výkonností paměti]. Neurobiol Aging. 2018 Jul;67:162-170. Epub 2018 Mar 27 PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE.APOE2 zvyšuje neuroprotekci proti Alzheimerově chorobě prostřednictvím více molekulárních mechanismů. Mol Psychiatry. 2014 Feb 4; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium. gene-based association studies report genetic links for clinical subtypes of frontotemporal dementia. Brain. 2017 Apr 5; PubMed.
- Wu L, Zhao L.ApoE2 and Alzheimer’s disease: time to take a closer look. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
Další literatura
Není k dispozici další literatura
.