 Alt stof, hvad enten det er levende eller ej, er sammensat af kemiske grundstoffer; disse er grundlæggende kemiske stoffer i den forstand, at de er, hvad de er – de kan ikke ændres til et andet grundstof. Hvert grundstof er kendetegnet ved antallet af protoner
Alt stof, hvad enten det er levende eller ej, er sammensat af kemiske grundstoffer; disse er grundlæggende kemiske stoffer i den forstand, at de er, hvad de er – de kan ikke ændres til et andet grundstof. Hvert grundstof er kendetegnet ved antallet af protoner , neutroner
, neutroner og elektroner
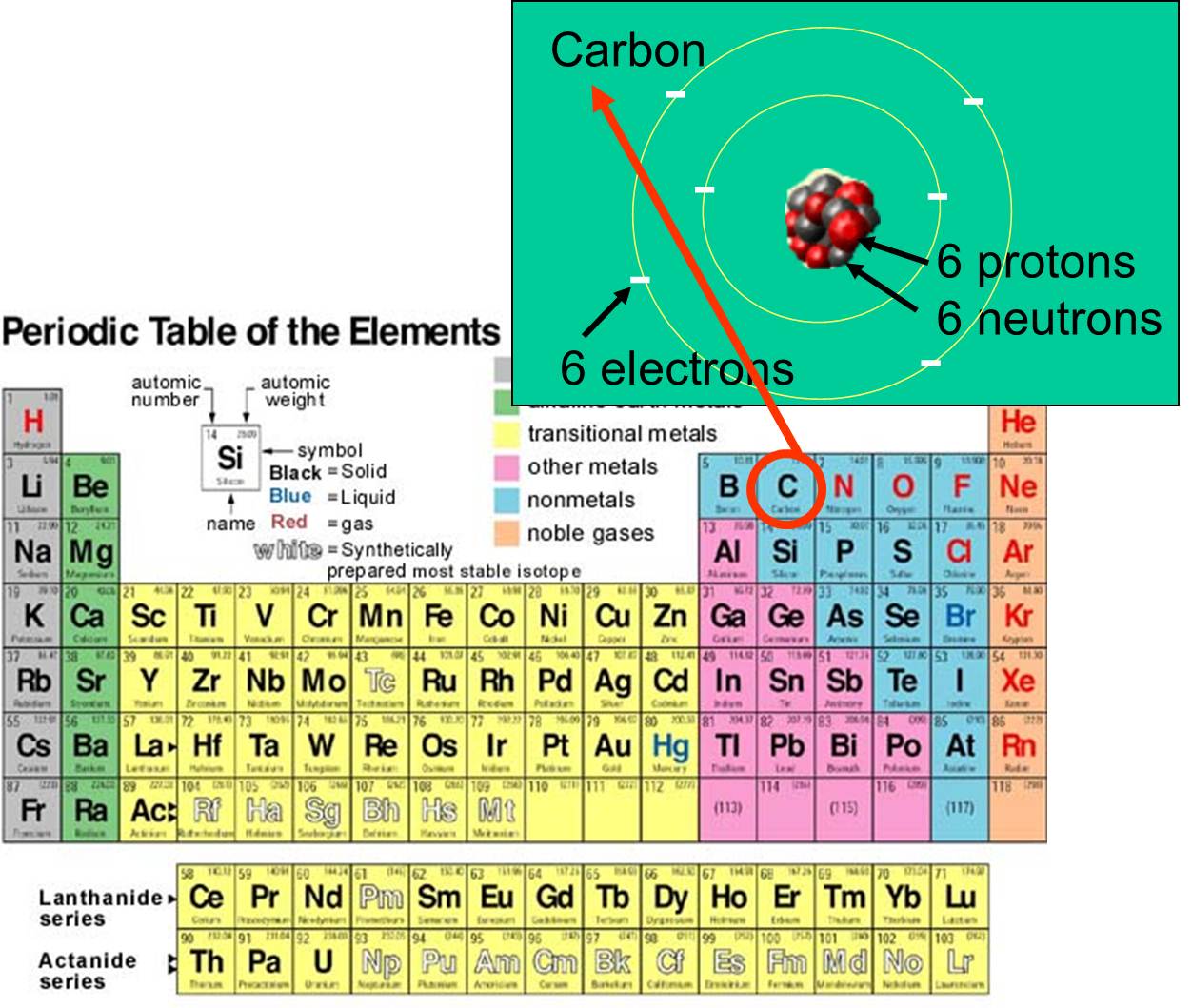
og elektroner , som det besidder. F.eks. er kulstofs atomnummer 6 og har en atommasse på ca. 12, fordi det har 6 positivt ladede protoner og 6 ikke-ladede neutroner. De 6 ladede elektroner bidrager kun meget lidt til atommassen. Der findes 92 naturligt forekommende grundstoffer på jorden. Rækken af grundstoffer og deres subatomare struktur er opsummeret i det periodiske system af grundstoffer, som er vist til højre.
, som det besidder. F.eks. er kulstofs atomnummer 6 og har en atommasse på ca. 12, fordi det har 6 positivt ladede protoner og 6 ikke-ladede neutroner. De 6 ladede elektroner bidrager kun meget lidt til atommassen. Der findes 92 naturligt forekommende grundstoffer på jorden. Rækken af grundstoffer og deres subatomare struktur er opsummeret i det periodiske system af grundstoffer, som er vist til højre.
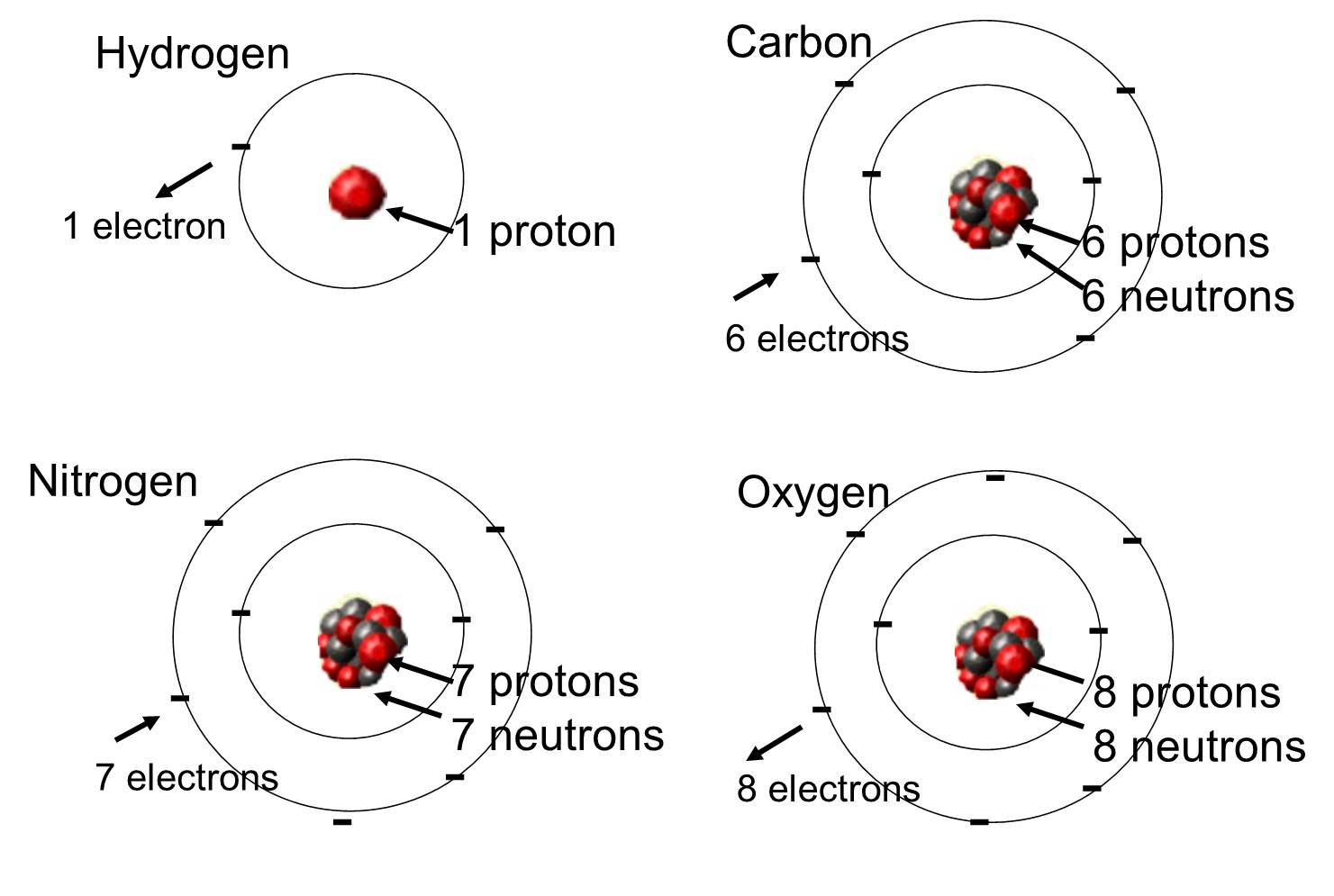
I levende organismer er de hyppigst forekommende grundstoffer kulstof, brint og ilt. Disse tre grundstoffer udgør sammen med nitrogen, fosfor og en håndfuld andre grundstoffer langt størstedelen af det levende stof. Et atom er en enkelt enhed af et kemisk grundstof. Nogle af disse grundstoffer, der forekommer hyppigt i organiske molekyler, er vist nedenfor.
 Atomer kan kombinere sig med andre atomer ved at danne kemiske bindinger.
Atomer kan kombinere sig med andre atomer ved at danne kemiske bindinger.
Kovalente bindinger
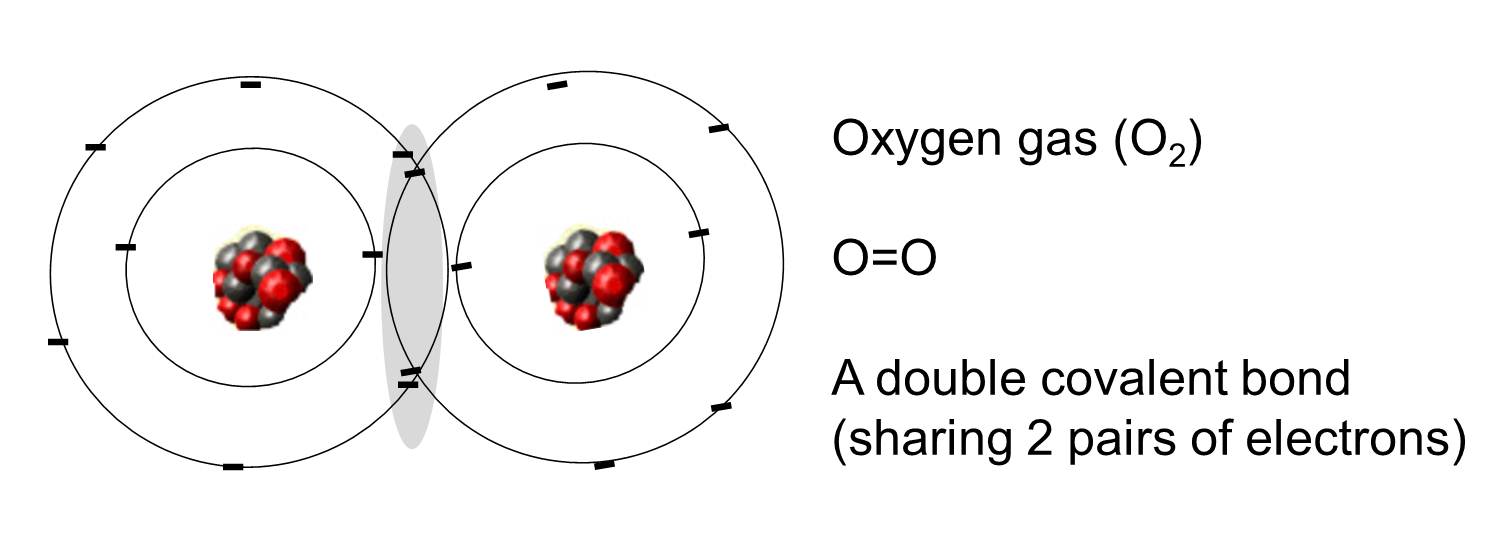
En kovalent binding er en binding, hvor et eller flere elektronpar deles af to atomer. Illustrationen til højre viser to oxygenatomer, der er kovalent bundet ved at dele to elektronpar som illustreret i det skraverede område.
Figuren nedenfor viser en række molekyler, der dannes ved kovalent binding. Hold musen over hvert molekyle for at se en kort beskrivelse.
, 
Vand er et polært molekyle
Bemærk også, at delingen af elektroner ikke altid er lige stor. For eksempel tilbringer de negativt ladede elektroner i et vandmolekyle mere tid i nærheden af det tungere oxygenatom.
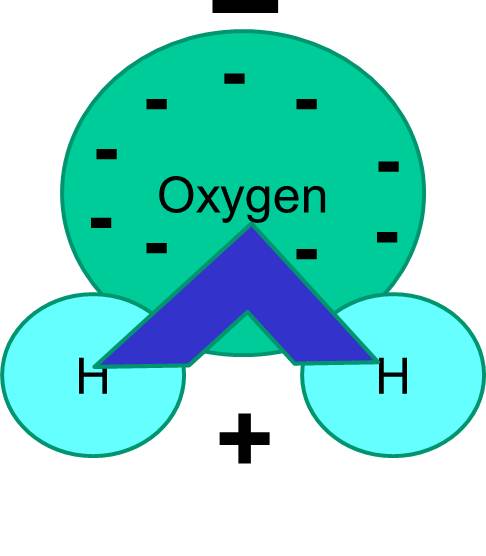
Netto resultatet er, at vandmolekylet har den ene ende, der er mere negativ i forhold til den anden ende. Vand er derfor et “polært” molekyle. Vi vil se, at denne polaritet har vigtige konsekvenser for mange biologiske fænomener, herunder cellestrukturen. Du har måske hørt udtrykket “det samme opløser det samme”. Det betyder, at polære molekyler opløses godt i polære væsker som f.eks. vand. Sukkerstoffer (f.eks. glukose) og salte er polære molekyler, og de opløses i vand, fordi de positive og negative dele af de to typer molekyler kan fordele sig behageligt mellem hinanden.
Ioniske bindinger
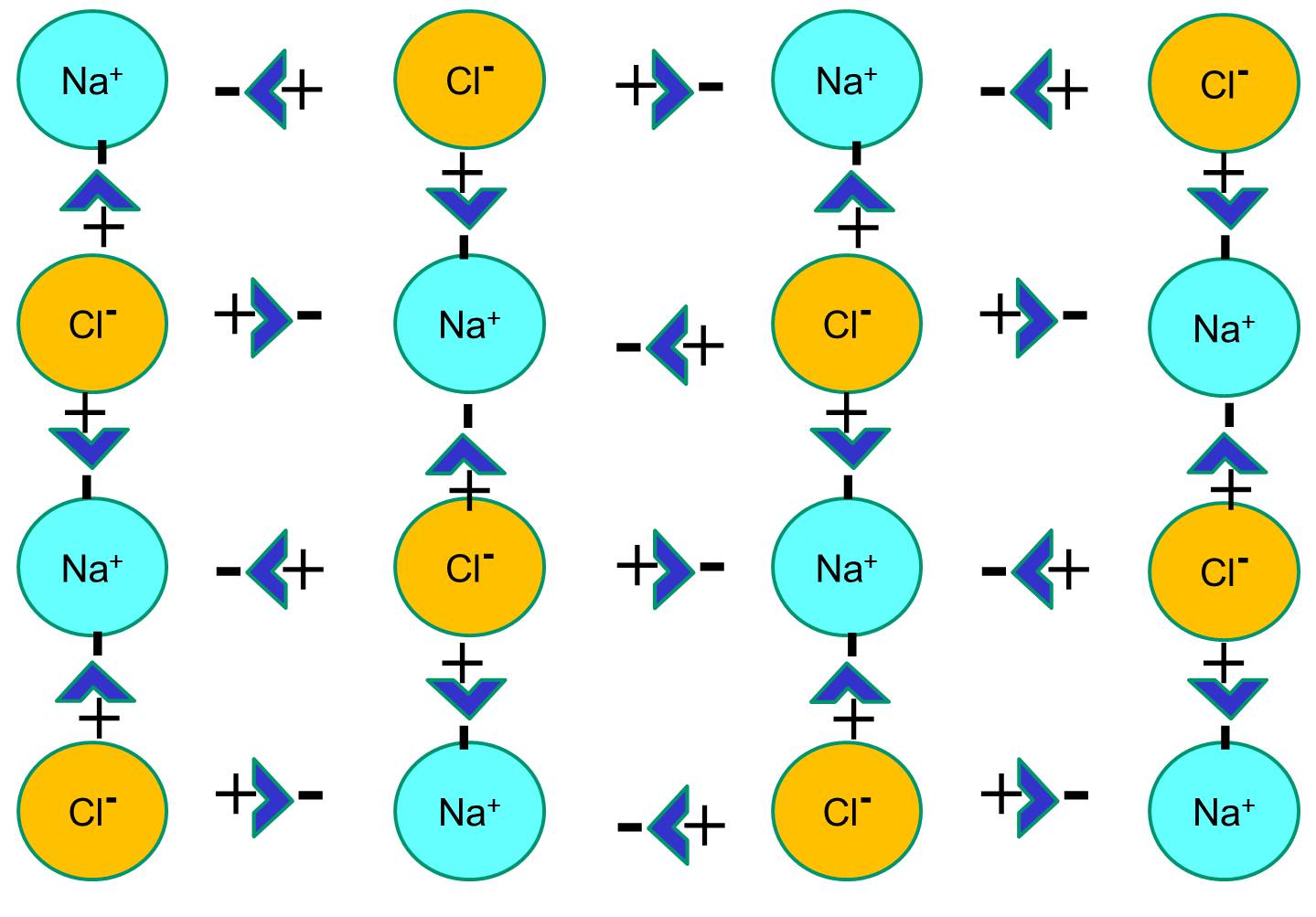
Natrium har en enkelt elektron i sin yderste orbitalskal, og det er termodynamisk mere stabilt, hvis det afgiver denne elektron. Dette tab af en negativ elektron resulterer i en positivt ladet natriumion, som forkortes Na+. Klor har på den anden side syv elektroner i sin yderste orbitalskal, og det er termodynamisk mere stabilt, hvis det får en ekstra elektron for at fuldende den yderste orbitalskal. Dette resulterer i en negativt ladet chloridion, som forkortes Na+. De positivt ladede natriumioner og de negativt ladede kloridioner tiltrækker hinanden og resulterer i dannelsen af en ionbinding. I fravær af vand danner natrium og klorid et krystalgitter på grund af tiltrækningen af negative og positive ioner.
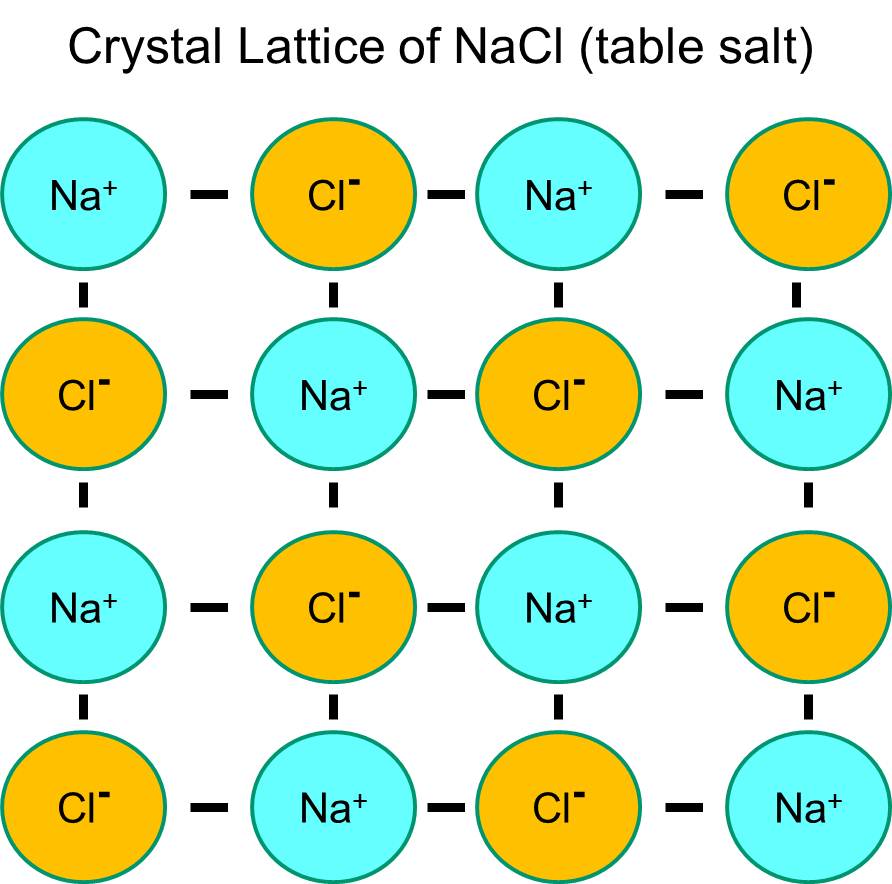
Hvis natriumkloridkrystaller imidlertid placeres i vand, vil de polære vandmolekyler “hydrere” natrium- og kloridatomerne, fordi vandmolekylerne er polære. I illustrationen nedenfor repræsenterer de mørkeblå V-formede figurer vandmolekyler, som er polære. De positive ender af vandmolekylerne tiltrækkes af de negativt ladede kloridioner, mens vandmolekylets negative pol tiltrækkes af de positive natriumioner. Som følge heraf bliver ionerne hydreret, og krystalgitteret opløses i den vandige opløsning. Dette er præcis, hvad der sker, når man tilsætter krystallinsk bordsalt til et glas vand.