 Tutta la materia, viva o no, è composta da elementi chimici; questi sono elementi chimici fondamentali nel senso che sono quello che sono – non possono essere cambiati in un altro elemento. Ogni elemento si distingue per il numero di protoni
Tutta la materia, viva o no, è composta da elementi chimici; questi sono elementi chimici fondamentali nel senso che sono quello che sono – non possono essere cambiati in un altro elemento. Ogni elemento si distingue per il numero di protoni , neutroni
, neutroni ed elettroni
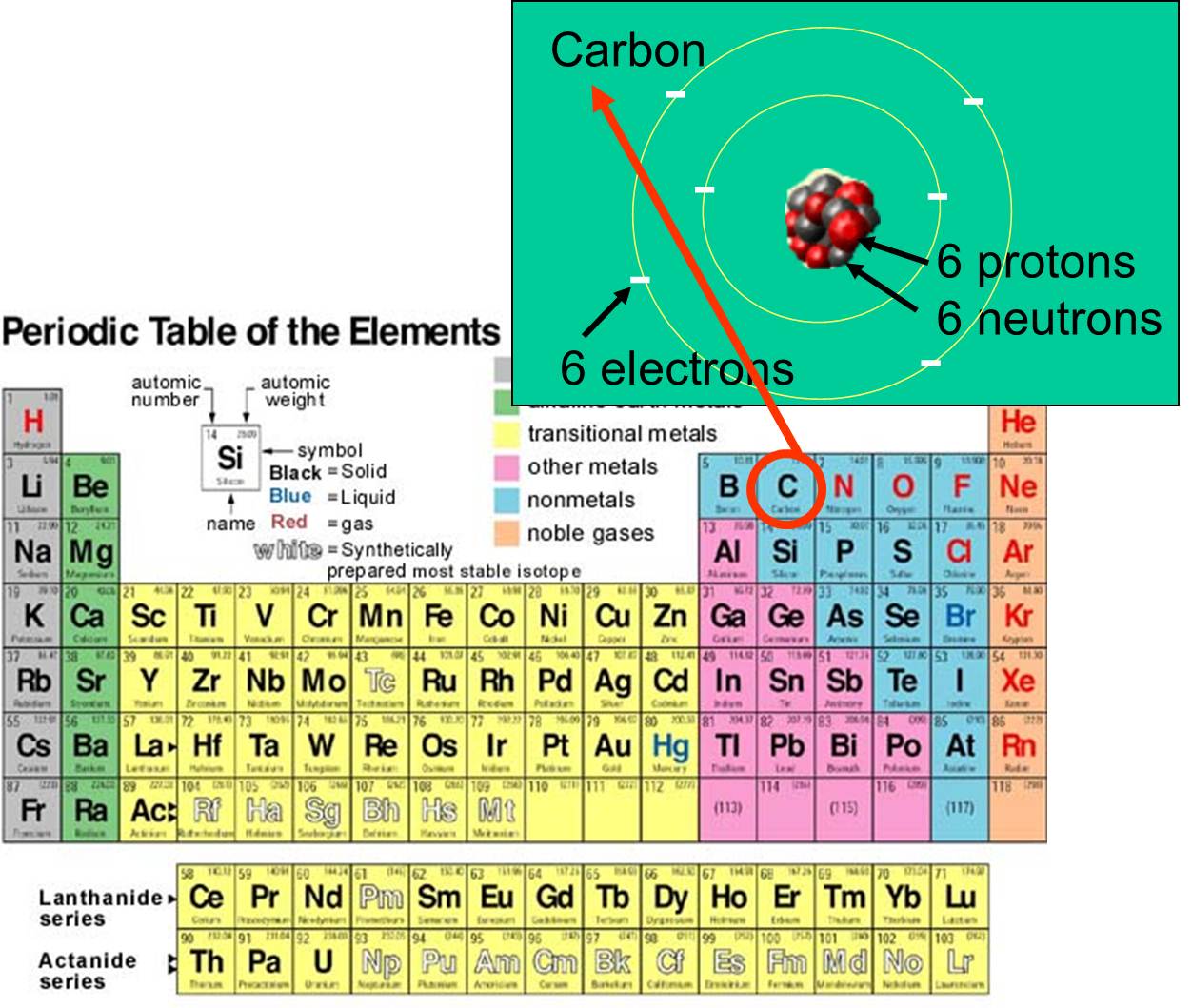
ed elettroni che possiede. Per esempio, il numero atomico del carbonio è 6 e ha una massa atomica di circa 12, perché ha 6 protoni carichi positivamente e 6 neutroni non carichi. I 6 elettroni carichi contribuiscono molto poco alla massa atomica. Ci sono 92 elementi presenti in natura sulla terra. La serie di elementi e la loro struttura subatomica sono riassunti dalla tavola periodica degli elementi, mostrata a destra.
che possiede. Per esempio, il numero atomico del carbonio è 6 e ha una massa atomica di circa 12, perché ha 6 protoni carichi positivamente e 6 neutroni non carichi. I 6 elettroni carichi contribuiscono molto poco alla massa atomica. Ci sono 92 elementi presenti in natura sulla terra. La serie di elementi e la loro struttura subatomica sono riassunti dalla tavola periodica degli elementi, mostrata a destra.
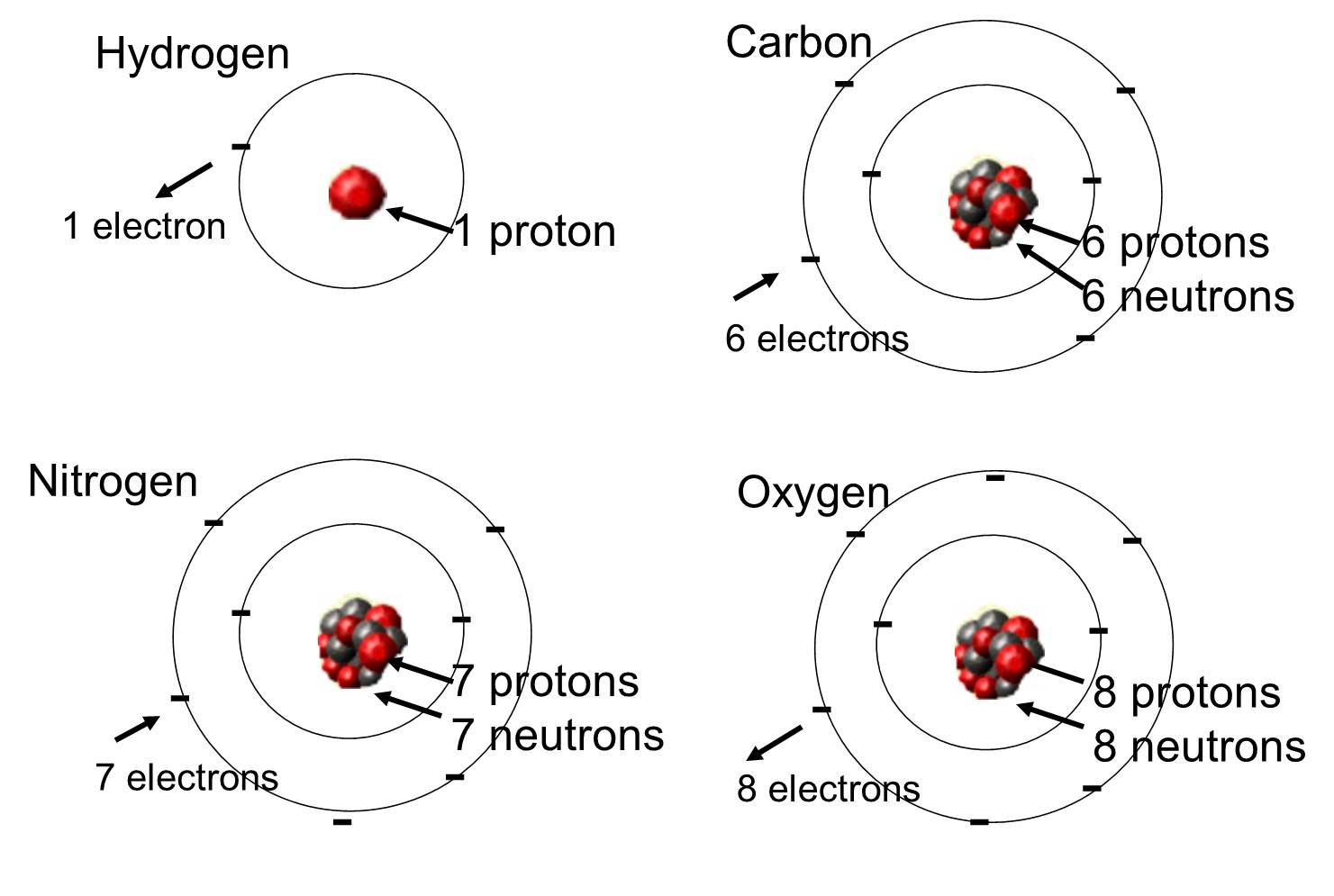
Negli organismi viventi gli elementi più abbondanti sono carbonio, idrogeno e ossigeno. Questi tre elementi insieme all’azoto, al fosforo e ad una manciata di altri elementi costituiscono la maggior parte della materia vivente. Un atomo è una singola unità di un elemento chimico. Alcuni di questi elementi che sono abbondanti nelle molecole organiche sono mostrati qui sotto.
 Gli atomi possono combinarsi con altri atomi formando legami chimici.
Gli atomi possono combinarsi con altri atomi formando legami chimici.
Legami covalenti
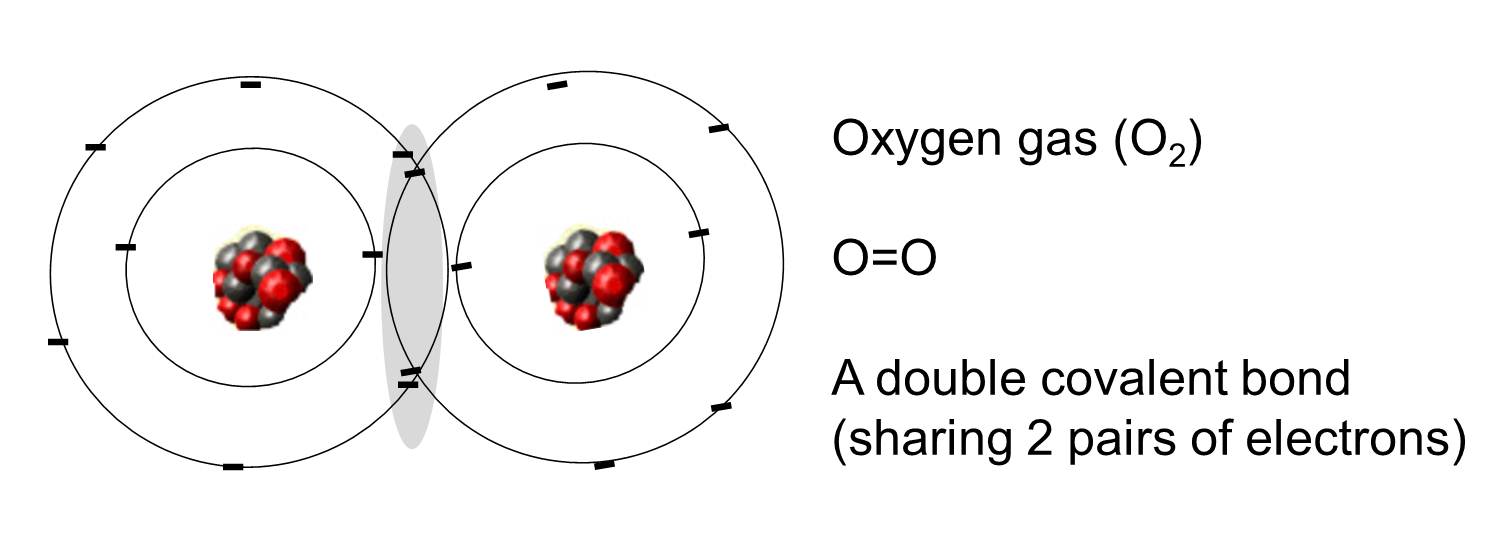
Un legame covalente è quello in cui una o più coppie di elettroni sono condivise da due atomi. L’illustrazione a destra mostra due atomi di ossigeno che sono legati covalentemente dalla condivisione di due coppie di elettroni come illustrato nell’area ombreggiata.
La figura sottostante mostra una serie di molecole formate dal legame covalente. Passa il mouse su ogni molecola per vedere una breve descrizione.
, 
L’acqua è una molecola polare
Nota anche che la condivisione degli elettroni non è sempre uguale. Per esempio, in una molecola d’acqua, gli elettroni carichi negativamente passano più tempo in prossimità dell’atomo di ossigeno più pesante.
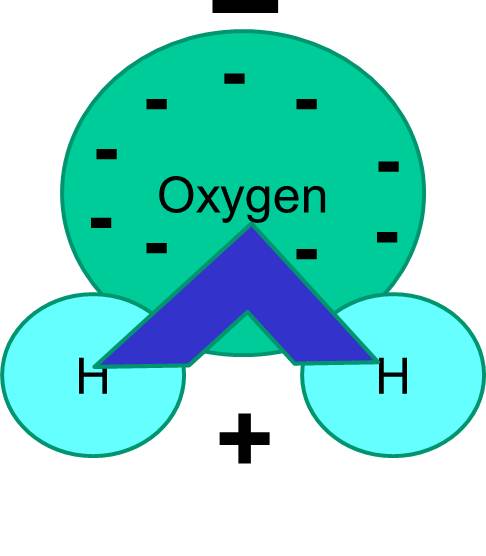
Il risultato netto è che la molecola d’acqua ha un’estremità più negativa rispetto all’altra. L’acqua è quindi una molecola “polare”. Vedremo che questa polarità ha importanti implicazioni per molti fenomeni biologici, compresa la struttura cellulare. Potreste aver sentito l’espressione “il simile si dissolve come il simile”. Ciò significa che le molecole polari si dissolvono bene in fluidi polari come l’acqua. Gli zuccheri (ad esempio, il glucosio) e i sali sono molecole polari, e si dissolvono in acqua, perché le parti positive e negative dei due tipi di molecole possono distribuirsi comodamente tra loro.
Legami ionici
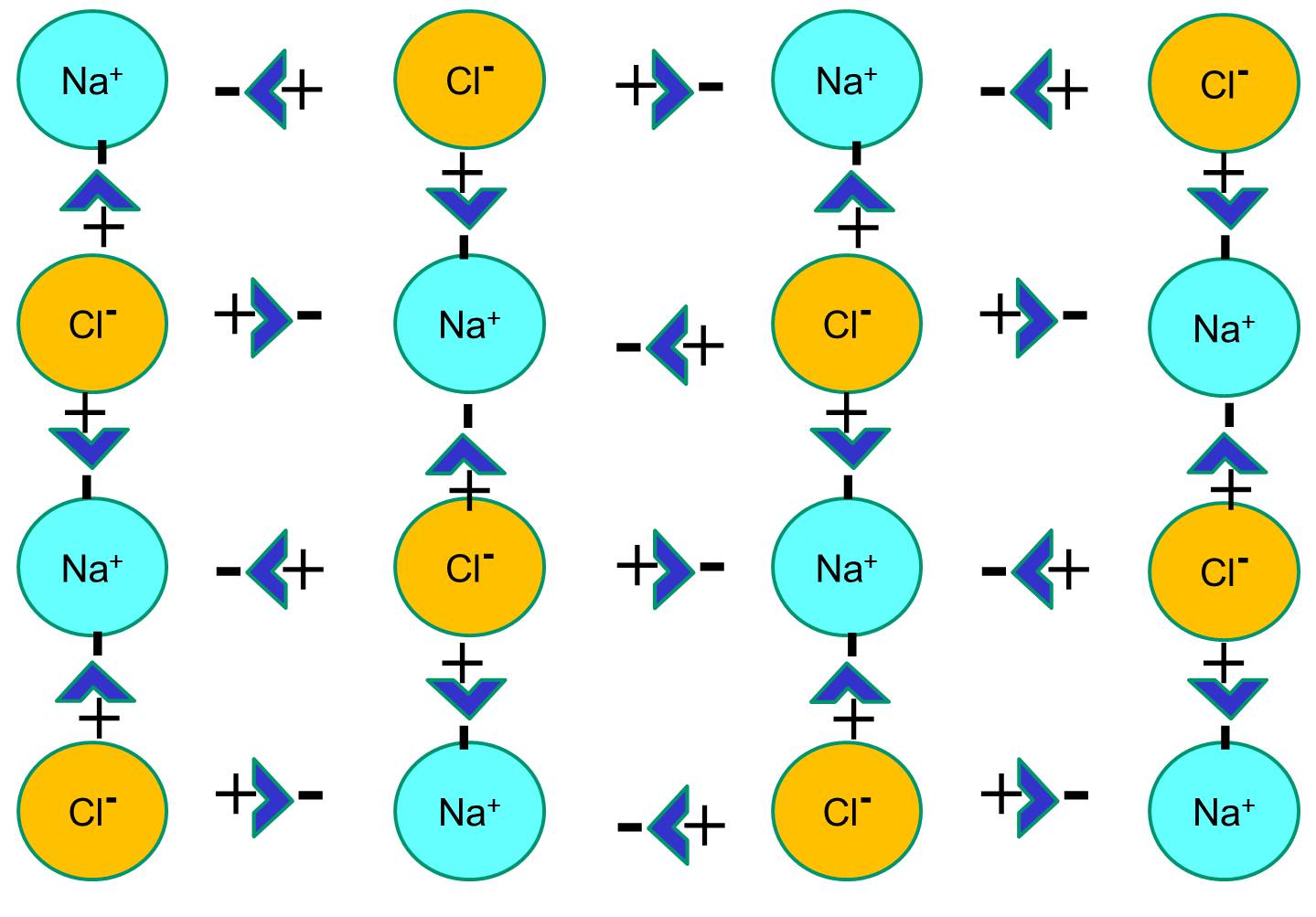
Il sodio ha un solo elettrone nel suo guscio orbitale più esterno, ed è termodinamicamente più stabile se cede questo elettrone. Questa perdita di un elettrone negativo risulta in uno ione sodio caricato positivamente, abbreviato Na+. Il cloro, d’altra parte, ha sette elettroni nel suo guscio orbitale più esterno, ed è termodinamicamente più stabile se acquisisce un elettrone extra per completare il guscio orbitale esterno. Questo risulta in uno ione cloruro caricato negativamente, abbreviato Na+. Gli ioni di sodio caricati positivamente e gli ioni di cloruro caricati negativamente si attraggono a vicenda e danno luogo alla formazione di un legame ionico. In assenza di acqua, il sodio e il cloruro formano un reticolo cristallino a causa dell’attrazione degli ioni negativi e positivi.
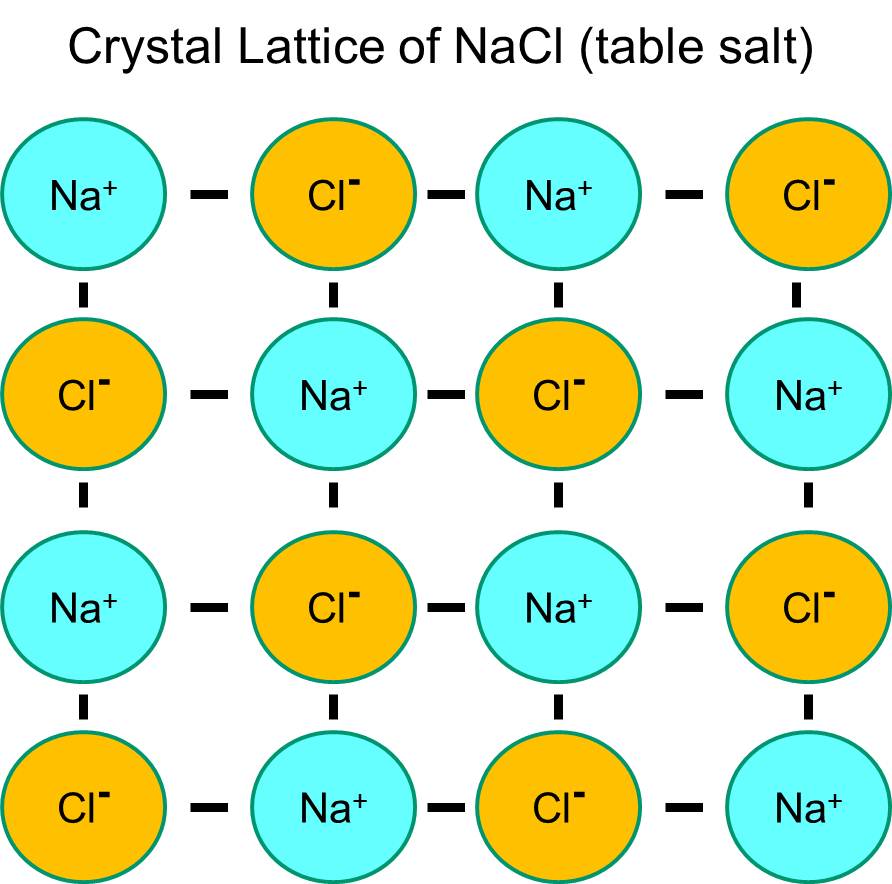
Tuttavia, se i cristalli di cloruro di sodio sono posti in acqua, le molecole polari dell’acqua “idratano” gli atomi di sodio e cloruro perché le molecole di acqua sono polari. Nell’illustrazione qui sotto, le figure blu più scure a forma di V rappresentano le molecole d’acqua, che sono polari. Le estremità positive delle molecole d’acqua sono attratte dagli ioni di cloruro caricati negativamente, mentre il polo negativo della molecola d’acqua è attratto dagli ioni di sodio positivi. Come risultato, gli ioni sono idratati e il reticolo cristallino si dissolve nella soluzione acquosa. Questo è esattamente ciò che accade quando si aggiunge sale da cucina cristallino a un bicchiere d’acqua.