Introduzione
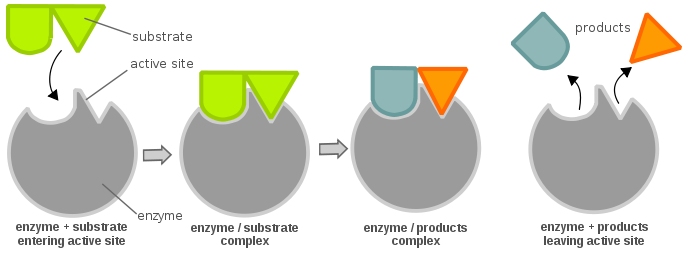
I siti attivi di un enzima sono solitamente composti da residui di amminoacidi; a seconda di quali residui di amminoacidi sono presenti, la specificità del substrato può variare notevolmente. A seconda del livello di pH, le proprietà fisiche (principalmente la carica elettrica) di un enzima possono cambiare. Un cambiamento nella carica elettrica può alterare l’interazione tra i residui aminoacidici del sito attivo e il substrato in arrivo. Detto questo, il substrato può legarsi al sito attivo attraverso il legame a idrogeno o le forze di van der Waals. Una volta che il substrato si lega al sito attivo, forma un complesso enzima-substrato che è poi coinvolto in ulteriori reazioni chimiche.
Perché un enzima sia attivo e sia energeticamente favorevole per permettere a una reazione chimica di procedere, un substrato deve legarsi al “sito attivo” di un enzima. Un sito attivo può essere pensato come una serratura e il substrato come una chiave; questo è noto come il modello della serratura e della chiave. Una chiave (substrato) deve essere inserita e girata (reazione chimica), poi la serratura (enzima) si apre (produzione di prodotti). Si noti che un enzima potrebbe avere più di un sito attivo. Un’altra teoria sulla relazione sito attivo-substrato è la teoria dell’adattamento indotto, che è abbastanza opposta alla teoria della serratura e della chiave (dove il sito attivo è apparentemente inflessibile). Nella teoria dell’adattamento indotto, il sito attivo dell’enzima è molto flessibile, e cambia la sua conformazione solo quando il substrato vi si lega.
Gli enzimi funzionano come un catalizzatore abbassando l’energia libera di Gibbs di attivazione del complesso enzima-substrato. Qui sotto ci sono due figure che mostrano una reazione enzimatica di base con e senza catalizzatore:
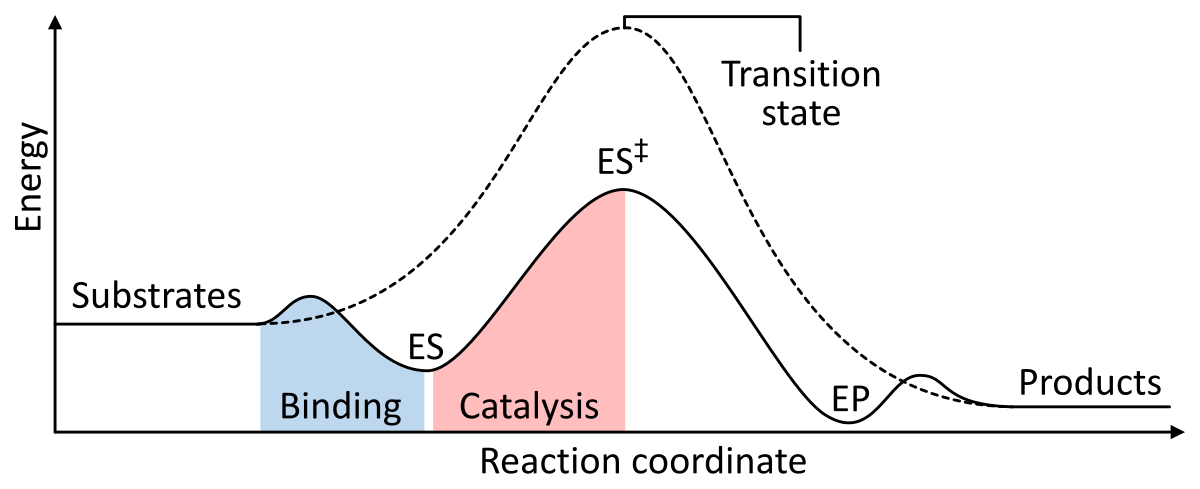
Figura 1: Le energie delle fasi di una reazione chimica. Non catalizzati (linea tratteggiata), i substrati hanno bisogno di molta energia di attivazione per raggiungere uno stato di transizione, che poi decade in prodotti a più bassa energia. Quando l’enzima è catalizzato (linea continua), l’enzima lega i substrati (ES), poi stabilizza lo stato di transizione (ES‡) per ridurre l’energia di attivazione richiesta per produrre prodotti (EP) che vengono infine rilasciati. da Wikipedia.
L’efficienza dell’enzima può essere determinata come segue: si consideri una semplice reazione enzimatica:
Il biochimico tedesco Leonor Michaelis e la biochimica canadese Maud Menten hanno derivato un’equazione che descrive questo sistema, conosciuta in seguito come “Equazione di Michaelis-Menten”, mostrata qui sotto:
}{K_M + }
Questa equazione dà la velocità della reazione ad una data concentrazione di substrato, assumendo una Vmax nota, che è la velocità massima alla quale la reazione può procedere, e KM, la costante di Michaelis. Tuttavia, in un’applicazione pratica del Michaelis-Menten, V0 è spesso misurato, e Vmax è osservato come una saturazione o un plateau in un grafico di dati. Poiché la concentrazione del substrato è nota, KM è di solito il valore calcolato di interesse.
Per \(K_M\), assumere \(V_0= \dfrac{V_{max}{2}}):
}{K_M + } \tag{2}}]
) \dfrac{V_{max}{2} = V_{max} \tag{3}]
= \dfrac{V_max}}{dfrac{V_{max}}{V_max}{2} \tag{4} \La costante di Michaelis può essere pensata come il tasso al quale il substrato viene slegato dall’enzima, che può verificarsi sia negli eventi del complesso substrato-enzima che diventa il prodotto, o il substrato viene slegato dall’enzima. Il KM può essere mostrato come un’equazione.
Dove k-1 è la costante di velocità alla quale il substrato viene slegato dall’enzima, con conseguente dissociazione del complesso enzima-substrato, k2 è la costante di velocità in cui il complesso substrato-enzima scompare e si trasforma in prodotto, e K1 è la costante di velocità per la formazione del complesso substrato-enzima. Pertanto, KM può essere visto come il tasso di scomparsa del complesso substrato-enzima diviso per il tasso di formazione del complesso substrato-enzima, che è il livello in cui metà del substrato è legato all’enzima. Il KM è un indicatore utile per la presenza di un inibitore perché possiamo cercare cambiamenti nel KM e confrontarlo con il nostro controllo (sistemi biologici che sappiamo avere zero presenza di inibitori). Il KM è una variabile dipendente, e il suo valore può cambiare a causa di molte ragioni, incluso il livello di pH del sistema, la temperatura, o qualsiasi altra condizione che potrebbe influenzare una reazione chimica. Un piccolo KM indica che il substrato ha un’alta affinità per l’enzima.
L’equazione di Michaelis-Menten è più utile per misurare l’efficienza dell’enzima se v0 è tracciata contro , come segue:
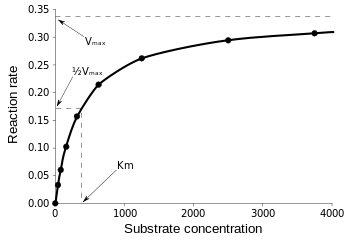
Figura 3: Diagramma della velocità di reazione e costante di Michaelis-Menten. da Wikipedia.
Vmax è la velocità massima alla quale la reazione può funzionare, indipendentemente da , il che significa che anche se si aggiunge più substrato, la reazione non può andare più veloce. Questo perché a Vmax tutti i siti attivi dell’enzima sono occupati. Dopo tutte le spiegazioni sulle varie forme di equazioni cinetiche degli enzimi, arriviamo alla nostra conclusione di efficienza catalitica. Riferendoci alla Fig. 3, abbiamo:
\o}{dfrac{k_{-1} + k_2}{k_1} + k1) \tag{8}]
Si noti che \(k_2\) descrive una reazione irreversibile al contrario di un’espressione di equilibrio, se confrontata con k-1 e k1. k2 qui è anche conosciuto come kcat, l’efficienza catalitica dell’enzima. Dalla discussione precedente, v0 è la velocità di reazione misurata, che è la formazione del prodotto nel tempo, quindi si può concludere che un’equazione sarebbe come la seguente:
{dt} = k_2_0 \tag{9}\]
dove 0 è la concentrazione totale dell’enzima.
Si sa anche che VMax si osserva quando tutto il complesso enzima-substrato scompare e si trasforma in prodotti, quindi possiamo fare la seguente assunzione:
\_0 \tag{10}
e dopo il riarrangiamento, abbiamo questa equazione:
\0}
Questa è l’equazione per calcolare l’efficienza catalitica, da usare dopo aver ottenuto dati dagli esperimenti e dopo aver usato l’equazione di Michaelis-Menten. Con un kcat più grande, l’enzima è efficiente perché è necessario meno enzima.