 Toda la materia, viva o no, está compuesta por elementos químicos; éstos son sustancias químicas fundamentales en el sentido de que son lo que son: no pueden transformarse en otro elemento. Cada elemento se distingue por el número de protones
Toda la materia, viva o no, está compuesta por elementos químicos; éstos son sustancias químicas fundamentales en el sentido de que son lo que son: no pueden transformarse en otro elemento. Cada elemento se distingue por el número de protones , neutrones
, neutrones y electrones
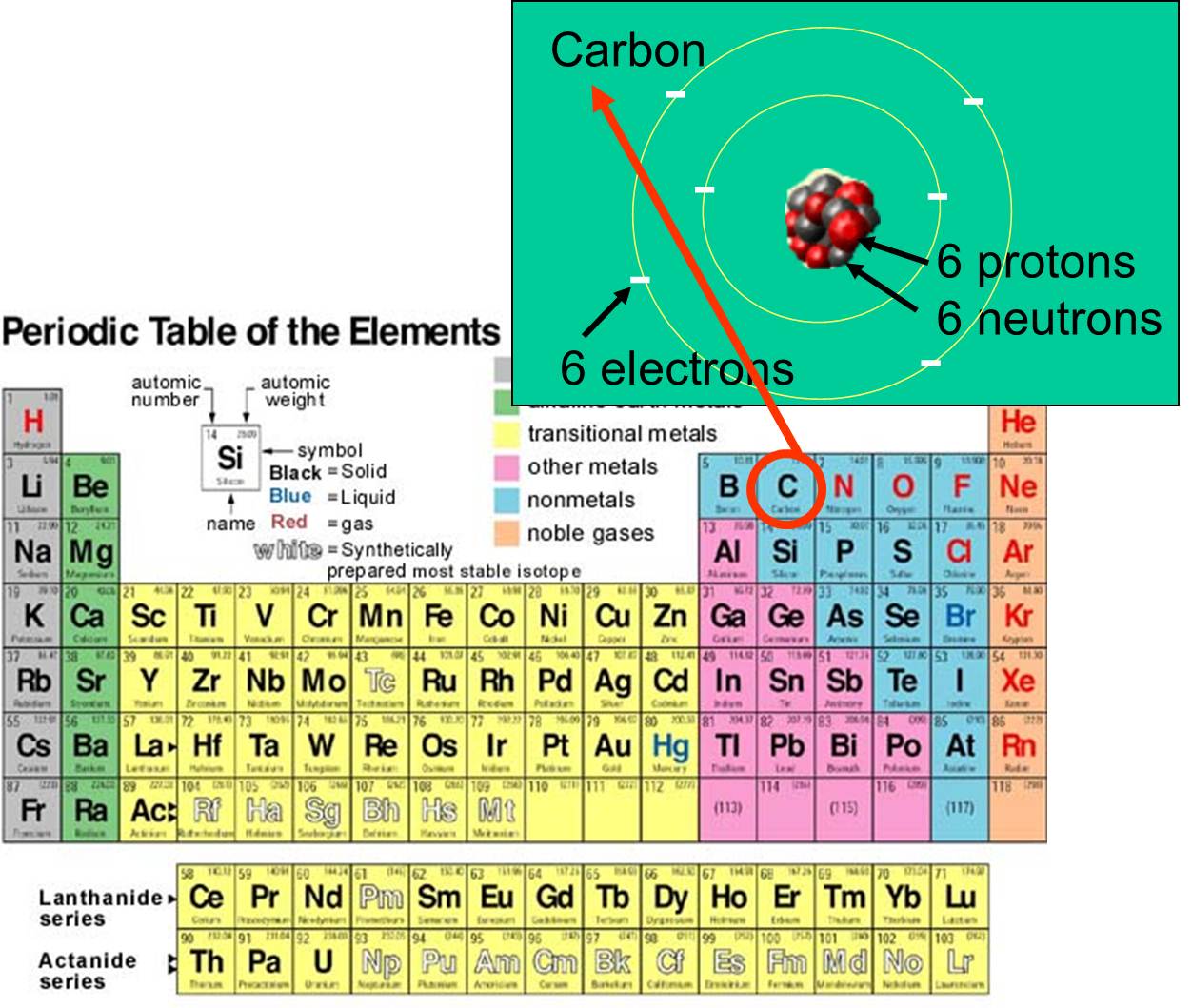
y electrones que posee. Por ejemplo, el número atómico del carbono es 6, y tiene una masa atómica de aproximadamente 12, porque tiene 6 protones con carga positiva y 6 neutrones sin carga. Los 6 electrones cargados contribuyen muy poco a la masa atómica. Existen 92 elementos naturales en la Tierra. El conjunto de elementos y su estructura subatómica se resume en la tabla periódica de los elementos, que se muestra a la derecha.
que posee. Por ejemplo, el número atómico del carbono es 6, y tiene una masa atómica de aproximadamente 12, porque tiene 6 protones con carga positiva y 6 neutrones sin carga. Los 6 electrones cargados contribuyen muy poco a la masa atómica. Existen 92 elementos naturales en la Tierra. El conjunto de elementos y su estructura subatómica se resume en la tabla periódica de los elementos, que se muestra a la derecha.
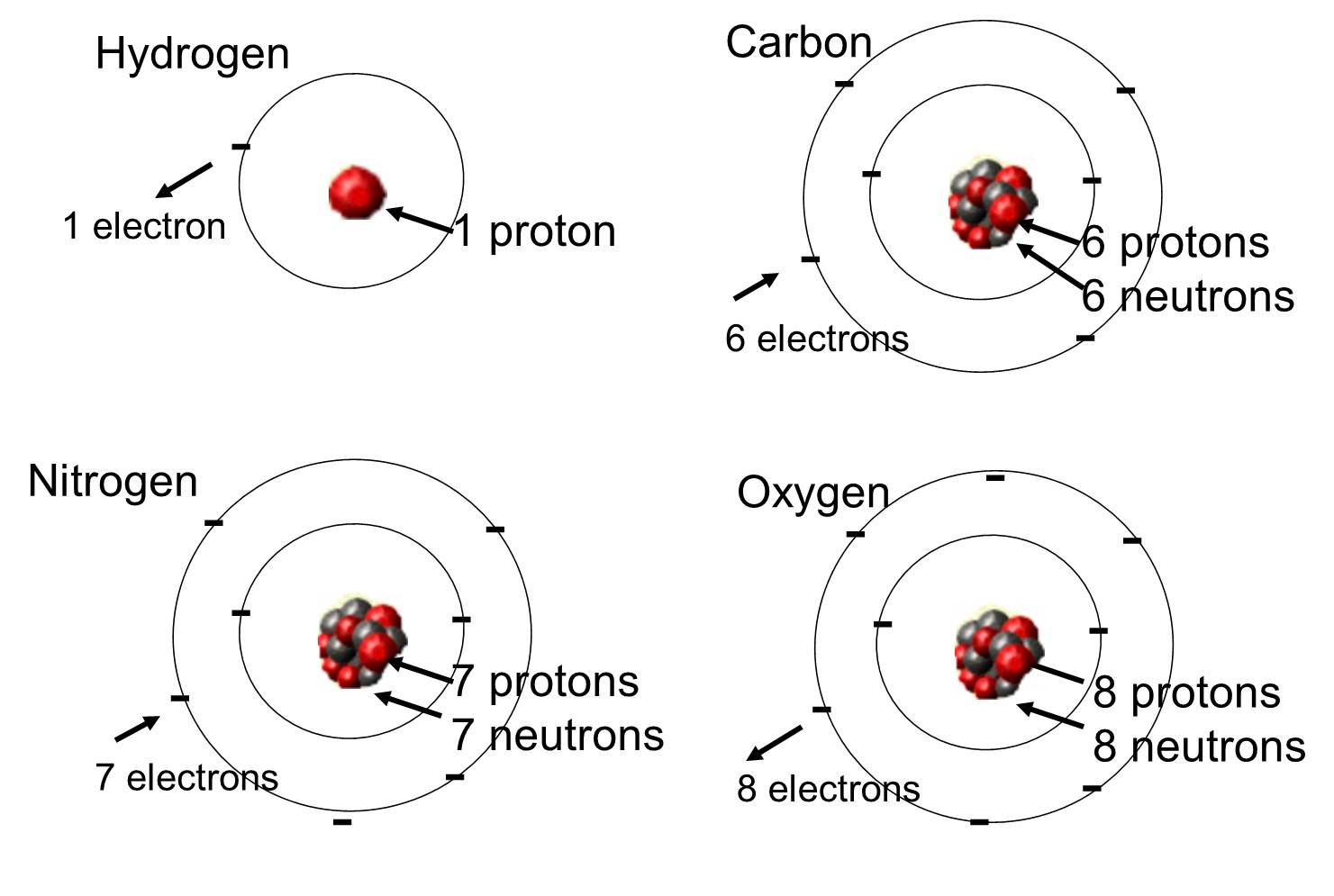
En los organismos vivos los elementos más abundantes son el carbono, el hidrógeno y el oxígeno. Estos tres elementos, junto con el nitrógeno, el fósforo y un puñado de otros elementos, constituyen la gran mayoría de la materia viva. Un átomo es una sola unidad de un elemento químico. A continuación se muestran algunos de estos elementos que abundan en las moléculas orgánicas.
 Los átomos pueden combinarse con otros átomos formando enlaces químicos.
Los átomos pueden combinarse con otros átomos formando enlaces químicos.
Enlaces covalentes
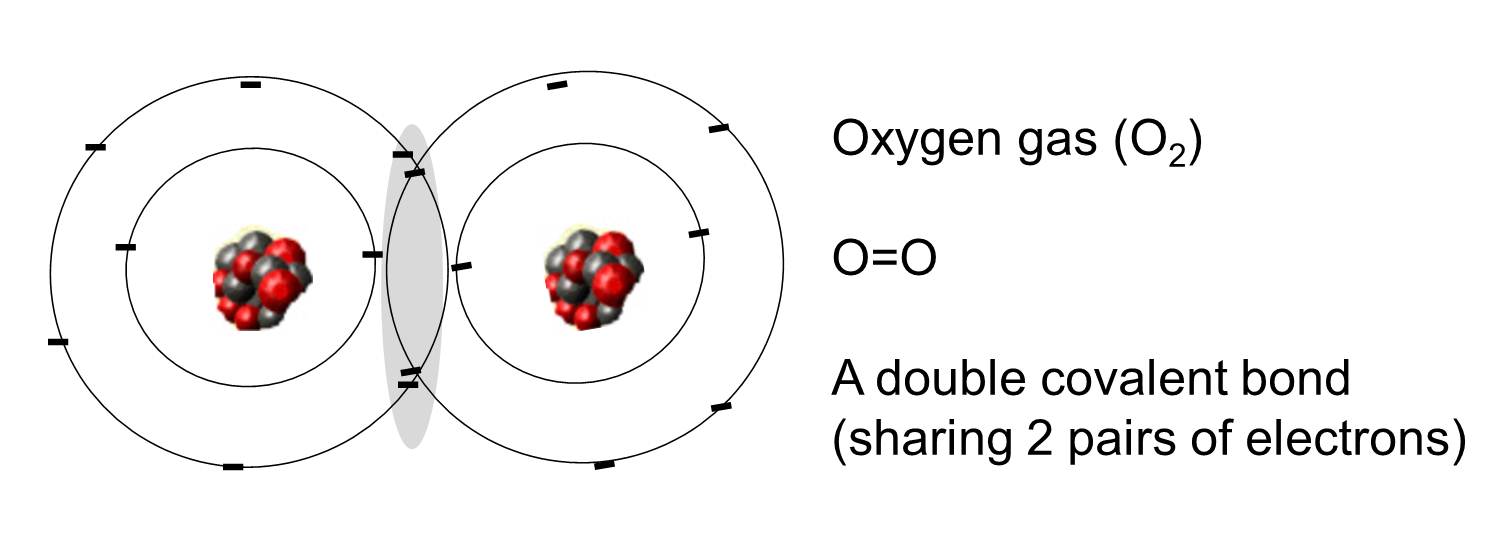
Un enlace covalente es aquel en el que dos átomos comparten uno o más pares de electrones. La ilustración de la derecha muestra dos átomos de oxígeno que están unidos covalentemente al compartir dos pares de electrones como se ilustra en el área sombreada.
La figura siguiente muestra una serie de moléculas formadas por enlace covalente. Pasa el ratón por encima de cada molécula para ver una breve descripción.
, 
El agua es una molécula polar
Nota también que el reparto de electrones no siempre es igual. Por ejemplo, en una molécula de agua, los electrones cargados negativamente pasan más tiempo cerca del átomo de oxígeno más pesado.
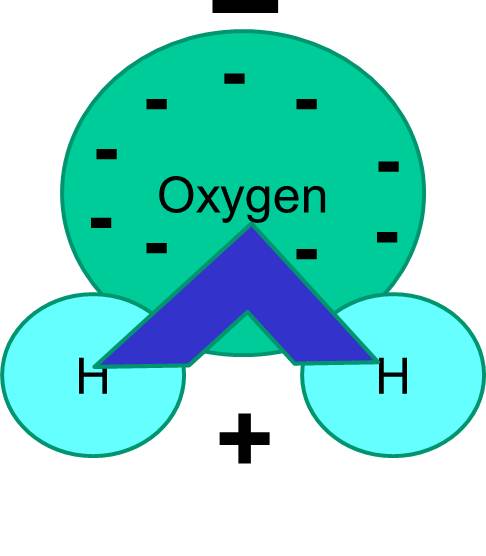
El resultado neto es que la molécula de agua tiene un extremo que es más negativo en relación con el otro extremo. El agua es, por tanto, una molécula «polar». Veremos que esta polaridad tiene importantes implicaciones en muchos fenómenos biológicos, incluida la estructura celular. Es posible que hayas oído la expresión «lo semejante se disuelve en lo semejante». Esto significa que las moléculas polares se disuelven bien en fluidos polares como el agua. Los azúcares (por ejemplo, la glucosa) y las sales son moléculas polares, y se disuelven en el agua, porque las partes positivas y negativas de los dos tipos de moléculas pueden distribuirse cómodamente entre ellas.
Enlaces iónicos
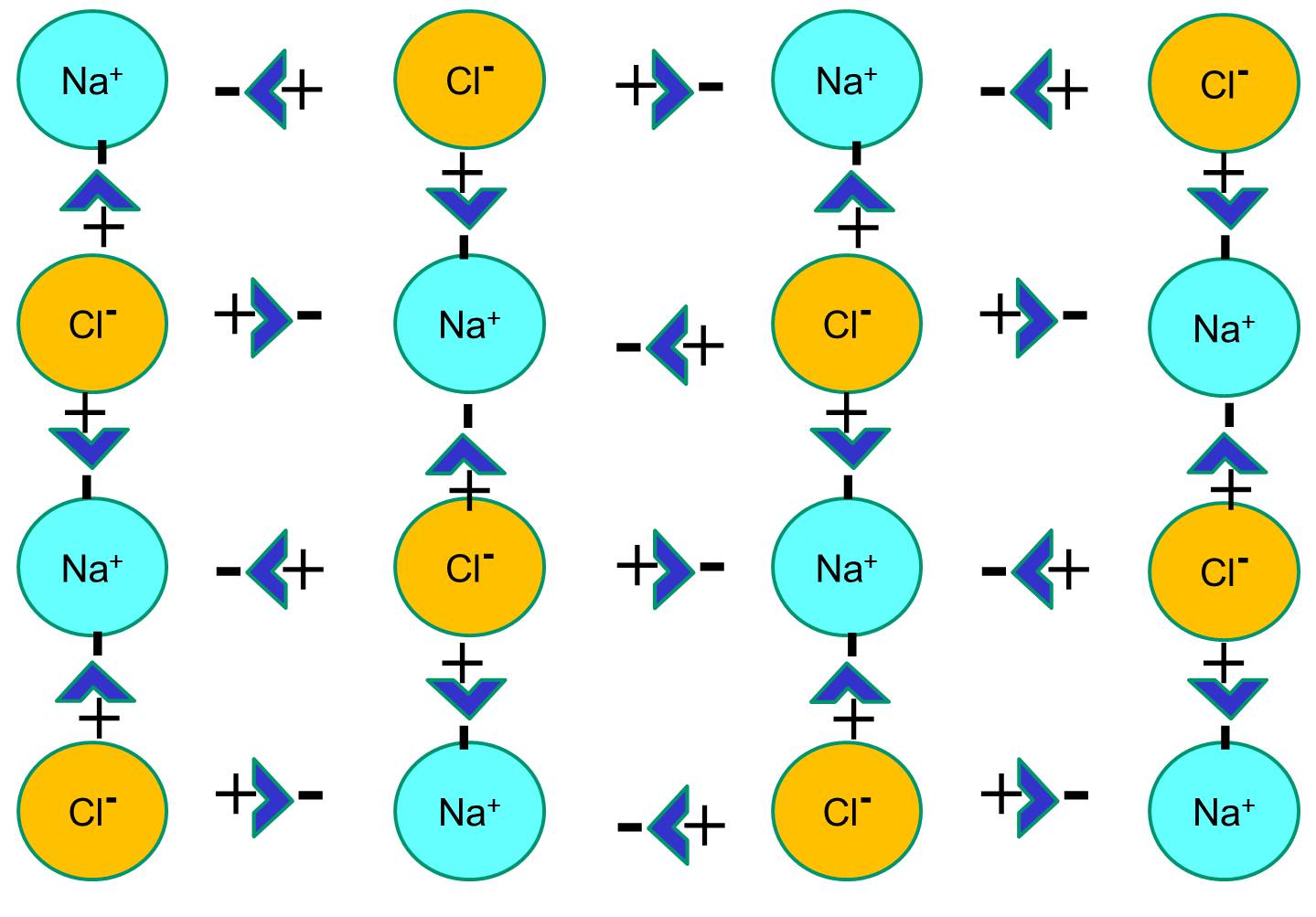
El sodio tiene un solo electrón en su capa orbital más externa, y es termodinámicamente más estable si cede este electrón. Esta pérdida de un electrón negativo da lugar a un ion de sodio con carga positiva, abreviado Na+. El cloro, por otro lado, tiene siete electrones en su capa orbital más externa, y es más estable termodinámicamente si adquiere un electrón extra para completar la capa orbital externa. Esto da lugar a un ion cloruro con carga negativa, abreviado Na+. Los iones de sodio con carga positiva y los iones de cloruro con carga negativa se atraen entre sí y dan lugar a la formación de un enlace iónico. En ausencia de agua, el sodio y el cloruro forman una red cristalina debido a la atracción de los iones negativos y positivos.
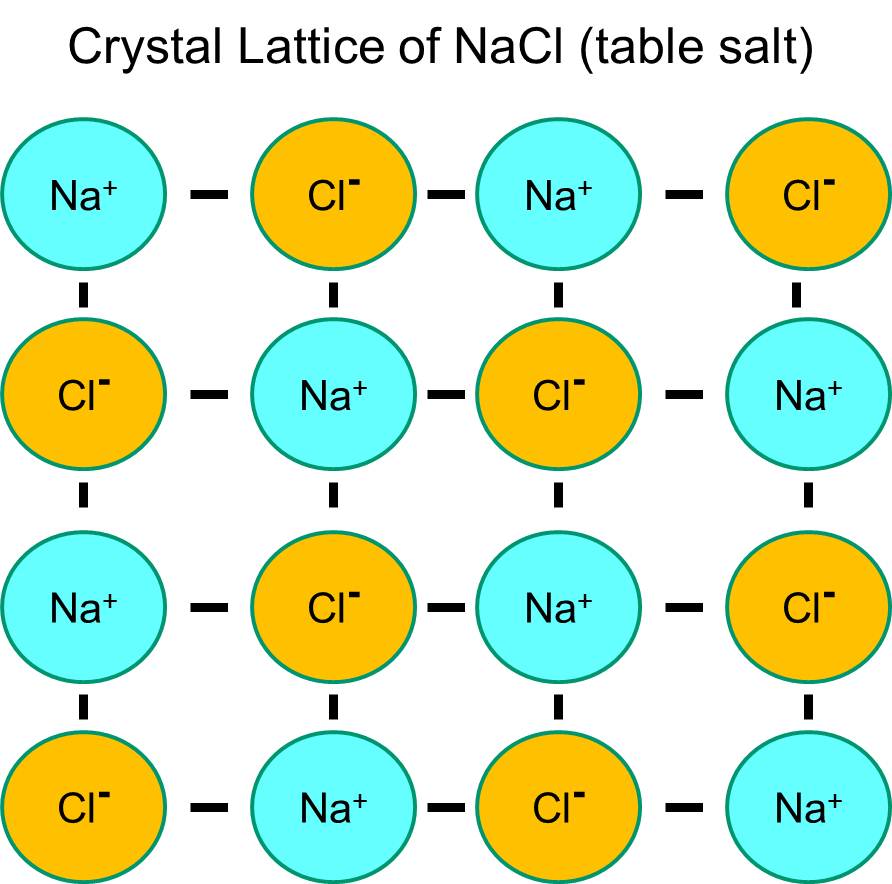
Sin embargo, si los cristales de cloruro de sodio se colocan en agua, las moléculas polares de agua «hidratarán» los átomos de sodio y cloruro porque las moléculas de agua son polares. En la siguiente ilustración, las figuras azules más oscuras en forma de V representan las moléculas de agua, que son polares. Los extremos positivos de las moléculas de agua son atraídos por los iones de cloruro cargados negativamente, mientras que el polo negativo de la molécula de agua es atraído por los iones de sodio positivos. Como resultado, los iones se hidratan y la red cristalina se disuelve en la solución acuosa. Esto es exactamente lo que ocurre cuando se añade sal de mesa cristalina a un vaso de agua.