Ciencia >Química >Estado sólido >Retículas de Bravais
En este artículo estudiaremos las estructuras de las Retículas de Bravais.
Un cristal es una porción homogénea de una sustancia sólida formada por un patrón regular de unidades estructurales unidas por superficies planas que forman un ángulo definido entre sí.
Célula unidad:
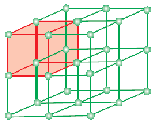
Una célula unidad es la unidad estructural más pequeña que se repite en un sólido cristalino (red espacial). Cuando las celdas unitarias de una misma sustancia cristalina se repiten en el espacio en todas las direcciones, se forma un sólido cristalino. La celda unitaria se representa sobre el papel trazando líneas que conectan los centros de las partículas constituyentes.
La forma geométrica que consiste únicamente en una serie regular de puntos en el espacio se denomina celosía o red espacial. Puede definirse como un conjunto de puntos que muestran cómo las moléculas, los átomos o los iones están dispuestos en diferentes sitios, en un espacio tridimensional. Cada punto de intersección de líneas en la celda unitaria representa una partícula constitutiva, es decir, una molécula, un átomo o un ion. Este punto de intersección de líneas en la celda unitaria se llama punto de red o sitio de red.
Nota: Cada punto de red en la red cristalina tiene el mismo entorno o ambiente. Dos o más sustancias cristalinas pueden tener el mismo espacio de red. Todas y cada una de las partículas de la red están siempre representadas por un punto de red en la red tridimensional.
Características de la red cristalina:
- La red cristalina es una disposición regular de las partículas constituyentes de un sólido cristalino en el espacio tridimensional.
- Está formada por un gran número de celdas unitarias.
- La red cristalina se define en términos de propiedades de la celda unitaria.
- Al romperse, forma numerosas celdas unitarias.
- Una red cristalina puede obtenerse, manipularse y estudiarse en un laboratorio durante los experimentos.
- Es una propiedad macroscópica.
Características de la celda unitaria:
- Una celda unitaria es la unidad estructural de repetición más pequeña del sólido cristalino.
- Es la unidad fundamental de la red cristalina que posee todas las propiedades del cristal.
- La celda unitaria define las propiedades fundamentales de la red cristalina.
- La celda unitaria es una unidad fundamental, por lo que no puede dividirse más.
- Una celda unitaria es un concepto hipotético, por lo que no puede obtenerse durante los experimentos.
- Es una propiedad microscópica.
Tipos de entramado espacial:
En un entramado unidimensional:
En este entramado, existe un conjunto de puntos dispuestos a distancias iguales a lo largo.

Retículas bidimensionales:
En este tipo se especifican dos lados y el ángulo entre ellos. Hay cinco tipos de celosía bidimensional.
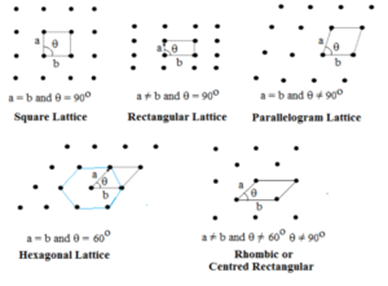
La red hexagonal es un rombo con θ = 60°
Retículas de Bravais:

Siendo las longitudes de tres aristas de la celda unidad a, b y c. Sea α el ángulo entre los lados b y c. Sea β el ángulo entre los lados a y c. Sea γ el ángulo entre los lados a y b.
El matemático francés Bravais dijo que para diferentes valores de a, b, c, y α, β, γ, son posibles un máximo de catorce (14) estructuras. Estos arreglos se denominan entramados de Bravais.
14 entramados de Bravais:
|
Sr. No. |
Cristal Sistema |
Enrejado espacial Tipo |
Diagrama |
Longitudes de los bordes |
Ángulos |
Ejemplos |
|
Cúbico |
Simple primitivo |
 |
a = b = c |
α = β = γ = 90° |
Polonio (Po) |
|
|
Cúbico |
Cuerpo centrado |
 |
a = b = c |
α = β = γ = 90° |
Hierro (Fe), Rubidio (Rb), Sodio (Na), Titanio (Ti), Tungsteno (W), Uranio (U), Zirconio (Zr) |
|
|
Cúbico |
Centrado de cara |
 |
a = b = c |
α = β = γ = 90° |
Cobre (Cu), Aluminio (Al), Níquel (Ni), Oro (Au), Plata (Ag), Platino (Pt) |
|
|
Tetragonal |
Simple primitivo |
 |
a = b ≠ c |
α = β = γ = 90° |
SnO2 |
|
|
Tetragonal |
Cuerpo centrado |
 |
a = b ≠ c |
α = β = γ = 90° |
Ti, O2, CaSO4 |
|
|
Ortorrómbica |
Simple primitivo |
 |
a ≠ b ≠ c |
α = β = γ = 90° |
Sulfuro rómbico |
|
|
Ortorrómbico |
Cuerpo centrado |
 |
a ≠ b ≠ c |
α = β = γ = 90° |
KNO3 |
|
|
Ortorrómbica |
Cara centrada |
 |
a ≠ b ≠ c |
α = β = γ = 90° |
BaSO4 |
|
|
Ortorrómbico |
Termino centrado |
 |
a ≠ b ≠ c |
α = β = γ = 90° |
MgSO4, 7H2O |
|
|
Monoclínico |
simple primitivo |
 |
a ≠ b ≠ c |
α =γ = 90° y β ≠ 90° |
Sulfuro monoclínico |
|
|
Monoclínico |
Termino centrado |
 |
a ≠ b ≠ c |
α =γ = 90° y β ≠ 90 |
Na2SO4. 10H2O |
|
|
Triclínico |
simple primitivo |
 |
a ≠ b ≠ c |
α =γ = 90° y β ≠ 90° |
K2Cr2O7, H3BO3 |
|
|
Hexagonal |
Simple primitiva |
 |
a = b ≠ c |
α = β = 90° y γ = 120° |
ZnO, BeO, CoS, SnS |
|
|
Rhombohedral |
Simple primitivo |
 |
a ≠ b ≠ c |
α = β = γ ≠ 90° |
Calcita, NaNO3, FeCO3 |
Partícula en la esquina:

La partícula en la esquina de la celda unitaria es compartida por 8 celdas unitarias (4 capas por debajo y 4 por encima). Por lo tanto, cada celda unitaria 1/8 de partícula.
Partícula en la cara:

La partícula en la cara de la celda unitaria es compartida por 2 celdas unitarias adyacentes. Por lo tanto, cada celda unitaria 1/2 partícula.
Partícula en el borde:

La partícula en el borde de la celda unitaria es compartida por 4 celdas unitarias (2 capas por debajo y 2 capas por encima). Por lo tanto, cada celda unitaria 1/4 de partícula.
Número de coordinación:
El número de coordinación de la partícula constituyente de la red cristalina es el número de partículas que rodean a una sola partícula en una red cristalina.
Cuanto mayor sea el número de coordinación, más apretadas estarán las partículas en la red cristalina. El número de coordinación es la medida de la dureza del cristal.
Número de partículas en la celda unitaria y número de coordinación
Estructura cúbica simple (scc):

Desde la estructura, podemos ver que hay 8 partículas en 8 esquinas de la celda unitaria. Por lo tanto, cada celda unitaria contiene 1/8 de la partícula en su esquina.
Número de esquinas = 8, Por lo tanto, número de partículas en la celda unitaria = 1/8x 8 = 1
Cada partícula en esta estructura está directamente en contacto con otras cuatro partículas en su plano y una partícula en la capa superior y en la capa inferior. El número de coordinación para la estructura cúbica simple es 4+ 1+ 1 = 6

Estructura cúbica centrada en el cuerpo (bcc):

Desde la estructura, podemos ver que hay 8 partículas en 8 esquinas de la celda unitaria.Cada partícula de las esquinas es compartida por 8 celdas unitarias vecinas. Por lo tanto, cada celda unitaria contiene 1/8 de la partícula en su esquina. Número de esquinas = 8, por lo que el número de partículas en la celda unitaria en las esquinas = 1/8 x 8 = 1
Al mismo tiempo, hay un átomo en el centro de la celda, por lo que el número de partículas en la celda unitaria 1 + 1 = 2
Cada partícula en esta estructura está directamente en contacto con otras cuatro partículas en la capa superior y cuatro partículas en la capa inferior. Por lo tanto, el número de coordinación de la estructura cúbica centrada en el cuerpo es 4 + 4 = 8

Estructura cúbica centrada en la cara (fcc):

Desde la estructura, podemos ver que hay 8 partículas en 8 esquinas de la celda unitaria. Cada partícula de las esquinas es compartida por otras 8 celdas unitarias vecinas. Por lo tanto, cada celda unitaria contiene 1/8 de la partícula en su esquina. El número de esquinas = 8. Por lo tanto el número de partículas en una celda unidad en las esquinas = 1/8 x 8 = 1
Hay 6partículas en 6 caras de la celda unidad. Cada partícula de la cara es compartida por 2 celdas unitarias vecinas. Por lo tanto, cada celda unitaria contiene 1/2 de la partícula en su cara.
El número de caras = 6. Por lo tanto, el número de partículas en la cara = 1/2 x 6 = 3
Por lo tanto, el número de partículas en la celda unitaria 1 + 3 = 4
Cada partícula en esta estructura está directamente en contacto con otras 4 partículas en su capa y con 4 partículas en la capa superior y 4 partículas en la capa inferior. Por lo tanto, el número de coordinación para la estructura cúbica centrada en la arista es 4 + 4 + 4 = 12

Notas:
Para la partícula centrada en la arista es compartida por 4 celdas unitarias. De ahí que cada celda unitaria esté formada por 1/4 de partícula El número de átomos por celda unitaria está en la misma proporción que la estequiometría del compuesto. Por lo tanto, ayuda a predecir la fórmula del compuesto.
Ciencia > Química > Estado Sólido > Retículas de Bravais