 Toute matière, qu’elle soit vivante ou non, est composée d’éléments chimiques ; ce sont des produits chimiques fondamentaux dans le sens où ils sont ce qu’ils sont – ils ne peuvent pas être changés en un autre élément. Chaque élément se distingue par le nombre de protons
Toute matière, qu’elle soit vivante ou non, est composée d’éléments chimiques ; ce sont des produits chimiques fondamentaux dans le sens où ils sont ce qu’ils sont – ils ne peuvent pas être changés en un autre élément. Chaque élément se distingue par le nombre de protons , de neutrons
, de neutrons et d’électrons
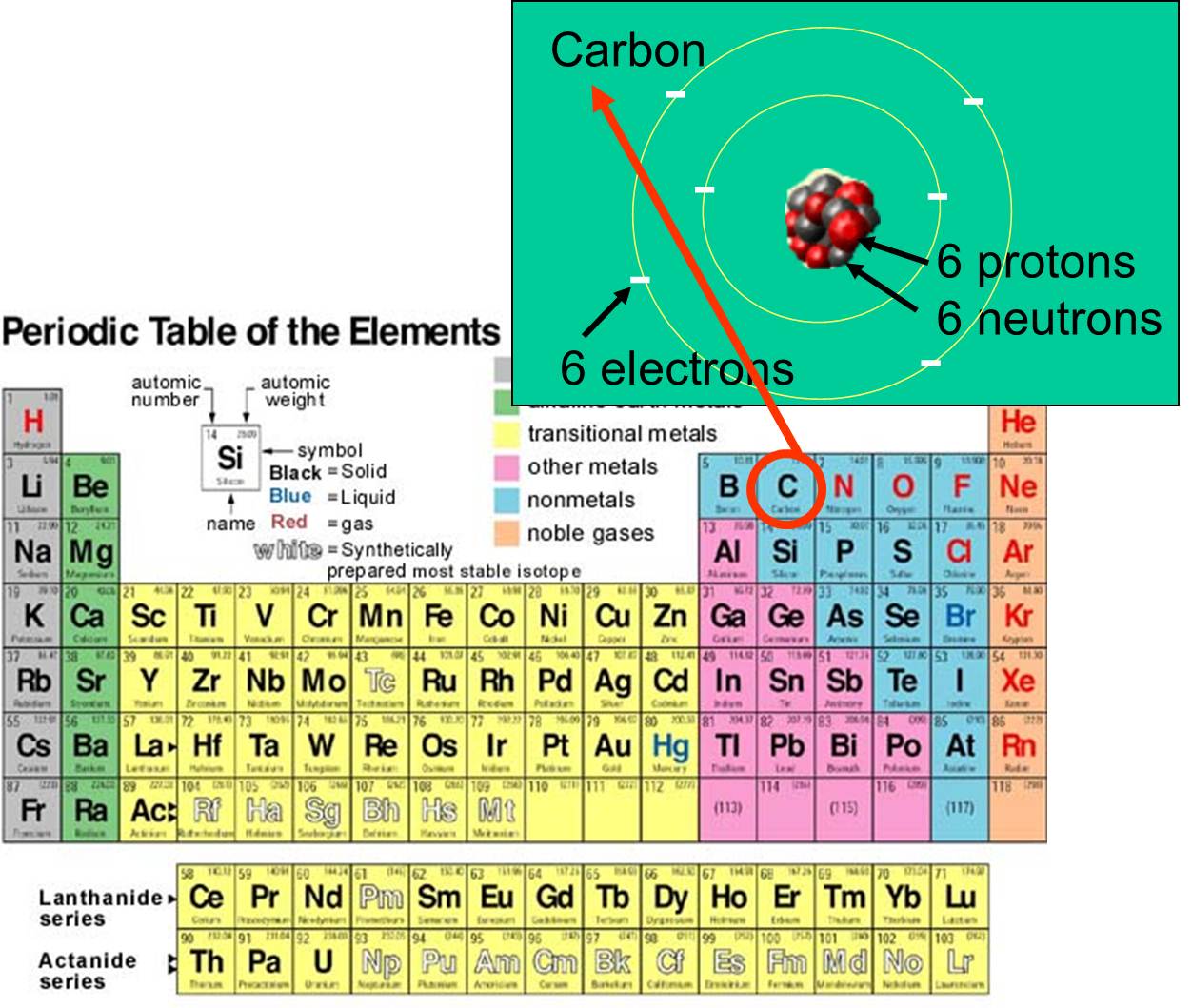
et d’électrons qu’il possède. Par exemple, le numéro atomique du carbone est 6, et sa masse atomique est d’environ 12, car il possède 6 protons chargés positivement et 6 neutrons non chargés. Les 6 électrons chargés contribuent très peu à la masse atomique. Il existe 92 éléments naturels sur terre. L’éventail des éléments et leur structure subatomique sont résumés par le tableau périodique des éléments, présenté à droite.
qu’il possède. Par exemple, le numéro atomique du carbone est 6, et sa masse atomique est d’environ 12, car il possède 6 protons chargés positivement et 6 neutrons non chargés. Les 6 électrons chargés contribuent très peu à la masse atomique. Il existe 92 éléments naturels sur terre. L’éventail des éléments et leur structure subatomique sont résumés par le tableau périodique des éléments, présenté à droite.
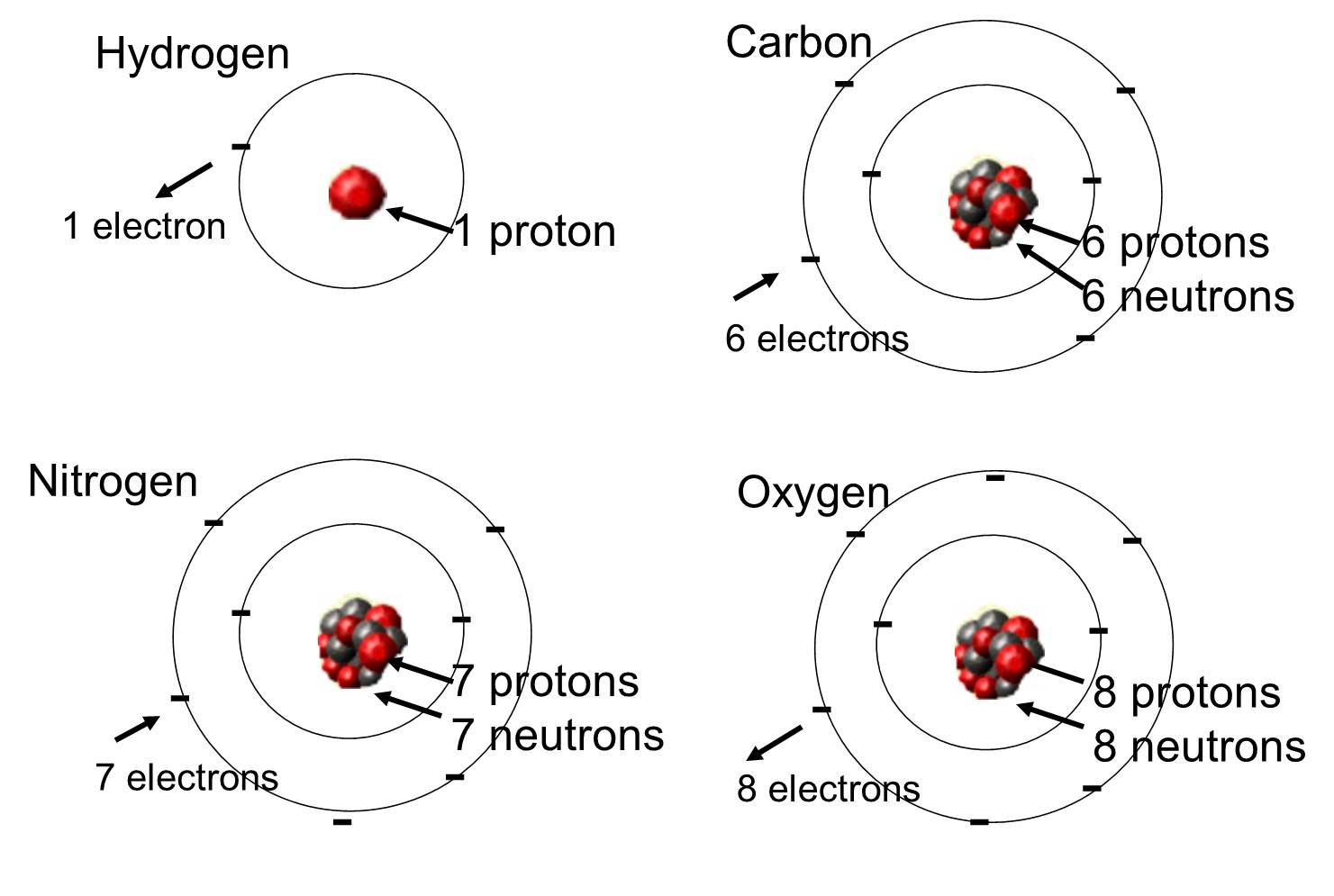
Dans les organismes vivants, les éléments les plus abondants sont le carbone, l’hydrogène et l’oxygène. Ces trois éléments ainsi que l’azote, le phosphore et une poignée d’autres éléments représentent la grande majorité de la matière vivante. Un atome est une unité unique d’un élément chimique. Certains de ces éléments qui sont abondants dans les molécules organiques sont présentés ci-dessous.
 Les atomes peuvent se combiner avec d’autres atomes en formant des liaisons chimiques.
Les atomes peuvent se combiner avec d’autres atomes en formant des liaisons chimiques.
Les liaisons covalentes
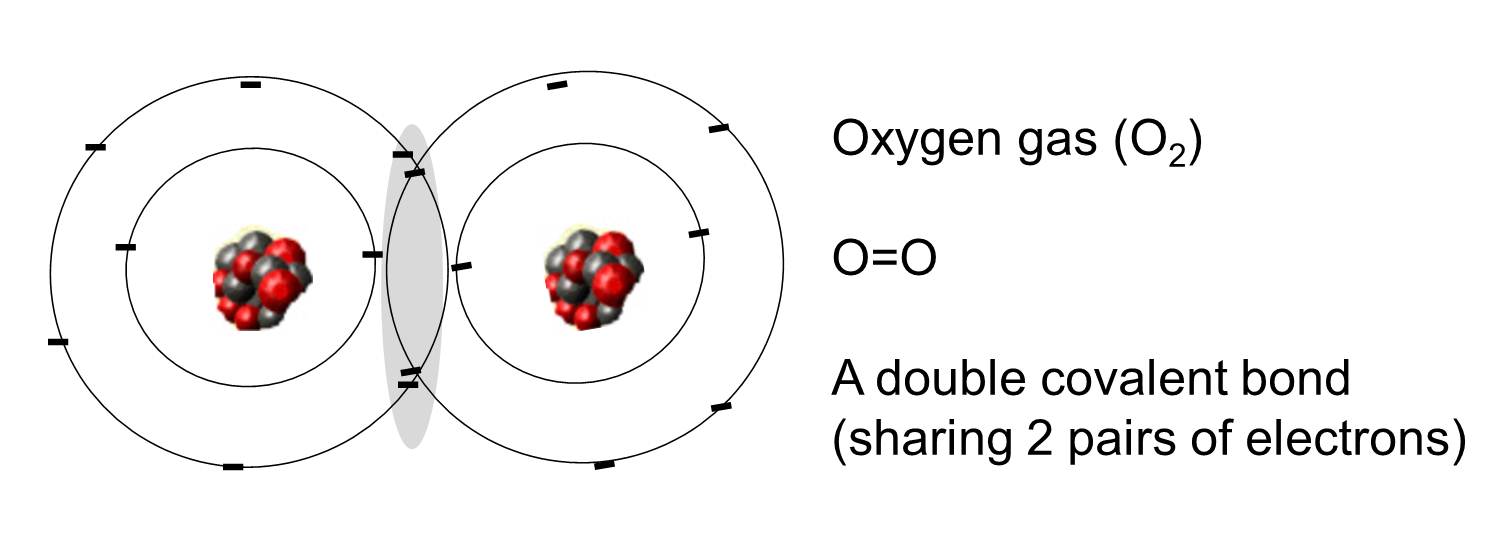
Une liaison covalente est une liaison dans laquelle une ou plusieurs paires d’électrons sont partagées par deux atomes. L’illustration de droite montre deux atomes d’oxygène qui sont liés de manière covalente par le partage de deux paires d’électrons, comme illustré dans la zone ombrée.
La figure ci-dessous montre une série de molécules formées par liaison covalente. Passez la souris sur chaque molécule pour voir une brève description.
, 
L’eau est une molécule polaire
Notez également que le partage des électrons n’est pas toujours égal. Par exemple, dans une molécule d’eau, les électrons chargés négativement passent plus de temps à proximité de l’atome d’oxygène plus lourd.
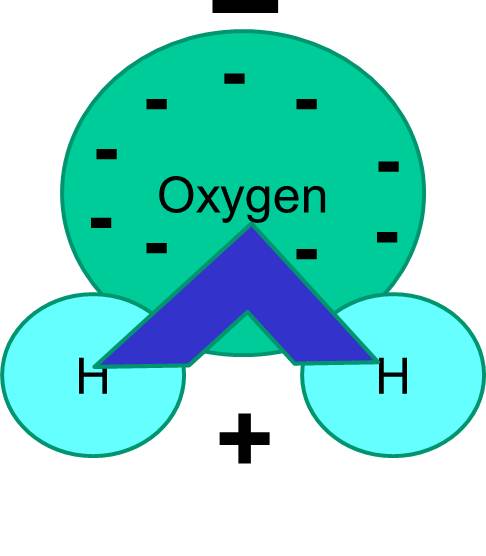
Le résultat net est que la molécule d’eau a une extrémité qui est plus négative par rapport à l’autre extrémité. L’eau est donc une molécule « polaire ». Nous verrons que cette polarité a des implications importantes pour de nombreux phénomènes biologiques, y compris la structure cellulaire. Vous avez peut-être déjà entendu l’expression « qui se ressemble s’assemble ». Cela signifie que les molécules polaires se dissolvent bien dans des fluides polaires comme l’eau. Les sucres (par exemple, le glucose) et les sels sont des molécules polaires, et ils se dissolvent dans l’eau, car les parties positives et négatives des deux types de molécules peuvent se répartir confortablement entre elles.
Les liaisons ioniques
Le sodium possède un électron unique dans sa coquille orbitale la plus externe, et il est thermodynamiquement plus stable s’il abandonne cet électron. Cette perte d’un électron négatif donne lieu à un ion sodium chargé positivement, abrégé en Na+. Le chlore, quant à lui, possède sept électrons dans sa couche orbitale la plus externe, et il est plus stable sur le plan thermodynamique s’il acquiert un électron supplémentaire pour compléter la couche orbitale externe. Il en résulte un ion chlorure chargé négativement, abrégé en Na+. Les ions sodium chargés positivement et les ions chlorure chargés négativement s’attirent mutuellement et entraînent la formation d’une liaison ionique. En l’absence d’eau, le sodium et le chlorure forment un réseau cristallin en raison de l’attraction des ions négatifs et positifs.
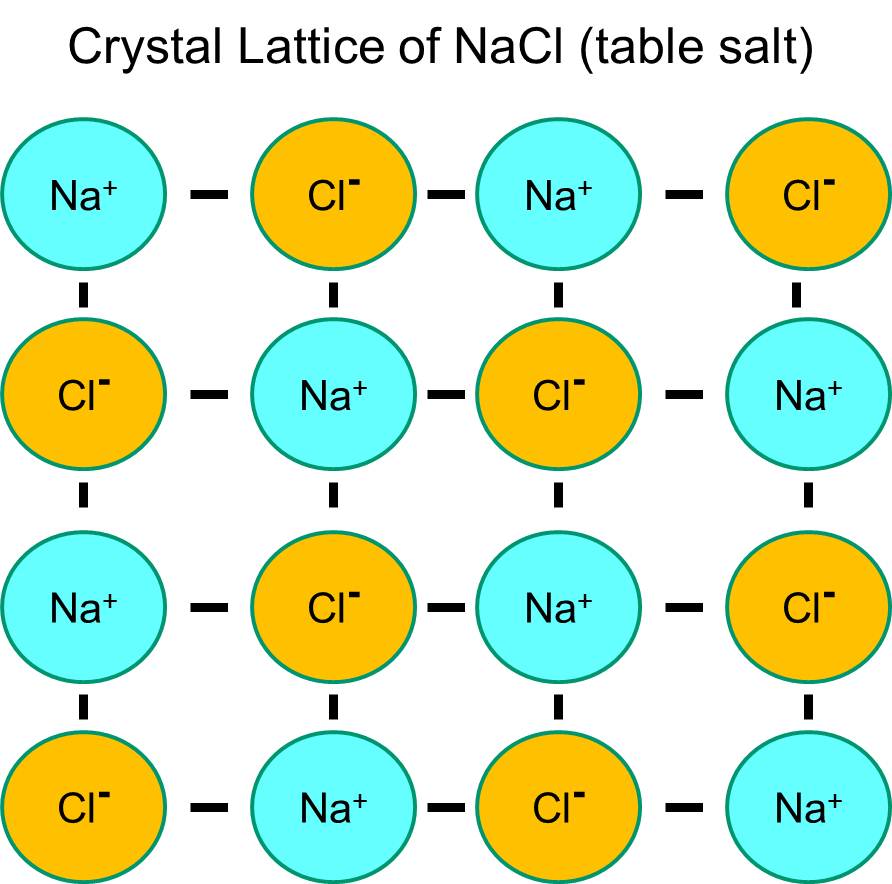
Cependant, si les cristaux de chlorure de sodium sont placés dans l’eau, les molécules d’eau polaires vont « hydrater » les atomes de sodium et de chlorure car les molécules d’eau sont polaires. Dans l’illustration ci-dessous, les figures en forme de V en bleu foncé représentent les molécules d’eau, qui sont polaires. Les extrémités positives des molécules d’eau sont attirées par les ions chlorure chargés négativement, tandis que le pôle négatif de la molécule d’eau est attiré par les ions sodium positifs. En conséquence, les ions sont hydratés et le réseau cristallin se dissout dans la solution aqueuse. C’est exactement ce qui se produit lorsque vous ajoutez du sel de table cristallin à un verre d’eau.
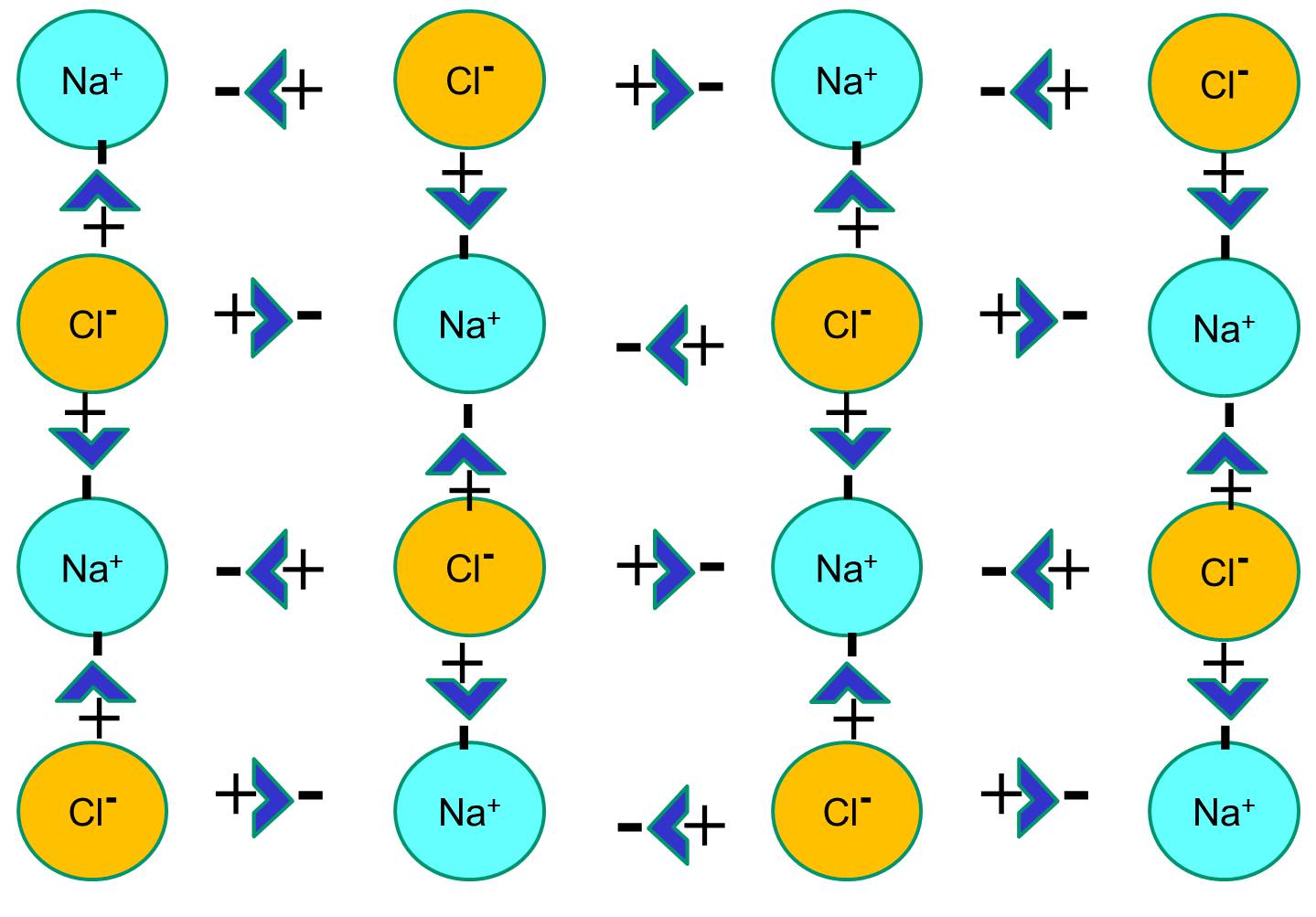
.