Introduzione
Gli antiossidanti naturali costituiscono una parte importante delle difese dell’ospite contro l’esposizione ambientale ad agenti nocivi (Davies, 1995). Gli stati pro-ossidanti sorgono quando le specie reattive dell’ossigeno (ROS) formate durante il metabolismo superano la capacità antiossidante cellulare (Davies, 1995). Sebbene le ROS agiscano come mediatori della regolazione omeostatica e della segnalazione cellulare (Forman et al., 2010), l’eccessiva produzione di ROS può contribuire alla patogenesi delle malattie umane, tra cui il cancro e le malattie cardiovascolari (CVD; Dröge, 2002; Valko et al., 2006; Sugamura e Keaney, 2011). Le cellule contengono sostanze chimiche solubili in acqua e lipidi ed enzimi antiossidanti che funzionano per limitare le reazioni ossidative dannose e preservare l’omeostasi dei tessuti (Halliwell e Gutteridge, 1999; Davies, 2000). Inoltre, molte sostanze alimentari possono essere assorbite e servire come antiossidanti sistemici (Kaliora et al., 2006; García-Lafuente et al., 2009). Così, molte ricerche sono state dirette verso lo sfruttamento dei composti antiossidanti naturali come terapeutici nella prevenzione o nel trattamento delle malattie umane (Kaliora et al., 2006; García-Lafuente et al., 2009; Sugamura e Keaney, 2011).
I pigmenti biliari biliverdina (BV) e bilirubina (BR) nascono come prodotti della degradazione dell’eme (Roy-Chowdhury et al., 2008; Figura 1). Questi pigmenti sono stati considerati dalla comunità medica come prodotti di scarto del metabolismo (Vitek e Ostrow, 2009). Tuttavia, BV/BR mostrano proprietà antiossidanti in sistemi modello (Stocker et al., 1987a). La BR circolante agisce come un potente antiossidante del siero e funge da fattore antiaterogeno naturale (Stocker et al., 1987b). Studi clinici retrospettivi e prospettici indicano che livelli leggermente elevati di BR (iperbilirubinemia lieve) sono associati a un ridotto rischio di CVD (Franchini et al., 2010). Effetti benefici della BR/BV farmacologica sono stati descritti in modelli preclinici di lesioni e malattie dei tessuti, tra cui il trapianto di organi, le malattie polmonari e la CVD (Ollinger et al., 2007; Ryter et al., 2007). Questi effetti coinvolgono meccanismi antiossidanti, anti-infiammatori, anti-apoptotici e anti-proliferativi (Ollinger et al., 2007; Ryter et al., 2007). Questa revisione discute l’applicazione terapeutica della BR/BV nella malattia, così come i dati clinici sul ruolo della BR endogena come fattore di rischio inverso per CVD.
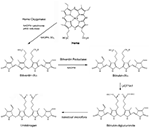
Figura 1. Sequenza di formazione e degradazione dei pigmenti biliari. L’eme ossigenasi (HO) degrada l’eme a biliverdina-IXα (BV), in una reazione che genera monossido di carbonio (CO) e ferro ferroso, a spese di NADPH e ossigeno molecolare. La BV viene ridotta a bilirubina-IXα (BR) dalla biliverdina reduttasi NAD(P)H (BVR). La BR viene coniugata con l’acido glucuronico alle sue catene laterali propioniliche dall’UDP-glucuronil-transferasi-1A1 (UGT1A1) epatica, per formare BR mono- e di-glucuronidi. La BR può essere ulteriormente metabolizzata a urobilinogeno dalla microflora intestinale.
Origine e destino metabolico della bilirubina
La bilirubina formata in vivo ha origine dal turnover dell’emoglobina (∼80%) durante la degradazione degli eritrociti da parte dei macrofagi reticoloendoteliali. Il resto della formazione di BR deriva dal turnover delle emoproteine nei tessuti sistemici. La biliverdina-IXα (BV-IXα), il precursore della BR, è un pigmento solubile in acqua che ha origine durante la degradazione dell’eme catalizzata dall’attività dell’eme ossigenasi (HO; E.C. 1:14:99:3), rappresentata da isozimi costitutivi (HO-2) e inducibili (HO-1) (Tenhunen et al., 1969; Maines, 1997).
L’attività dell’eme ossigenasi, il passo limitante nella degradazione dell’eme, richiede tre moli di O2 per ogni eme ossidato ed elettroni dalla citocromo-p450 reduttasi NADPH (Yoshida e Kikuchi, 1974; Noguchi et al., 1979; Yoshida et al., 1980). Ogni mole di BV-IXα formata produce una mole di monossido di carbonio (CO), derivato dal carbonio eme α-metene, e ferro ferroso (Tenhunen et al., 1969). BV-IXα viene ridotto a bilirubina-IXα (BR-IXα), un pigmento lipidico solubile, dalla biliverdina reduttasi NADH/NADPH-dipendente (BVR; E.C. 1.3.1.24; Tenhunen et al., 1970).
La bilirubina segue una sequenza di fasi di trasformazione ed eliminazione biologica (Figura 2). La BR formata in situ passa al siero dove circola in un complesso con l’albumina del siero (Roy-Chowdhury et al., 2008; Vitek e Ostrow, 2009). Una frazione di BR non coniugata nel siero circola liberamente (∼0,01%; Vitek e Ostrow, 2009). La BR non coniugata viene assorbita dal fegato per diffusione facilitata, coinvolgendo i trasportatori di ioni organici (per esempio, SLCO1B1; Kamisako et al., 2000; Cui et al., 2001). Il trasporto intracellulare degli epatociti di BR è assistito dalla ligandina, un complesso di subunità della glutatione-S-transferasi (GST), e dalla proteina-Z (Litwack et al., 1971). La BR è coniugata negli epatociti dalla glucuroniltransferasi dell’uridina difosfato (UDP) (UGT1A1; EC: 2.4.1.17; Chowdhury et al., 1979). La BR coniugata (mono- e di-glucuronidi) viene pompata dagli epatociti attraverso la membrana canalicolare dalla multidrug resistance protein-2 ed escreta attraverso la bile nell’intestino (Chowdhury e Chowdhury, 1983; Wang et al., 2006a).
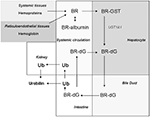
Figura 2. Biodistribuzione di BR. La BR è generata nei tessuti sistemici come prodotto della degradazione dell’emoproteina (cioè l’emoglobina). La BR formata nei tessuti passa liberamente alla circolazione, dove esiste principalmente in un complesso con l’albumina del siero. La BR viene assorbita dagli epatociti per diffusione facilitata. Nell’epatocita, la BR è trasportata dalla glutatione-S-transferasi (GST), e poi coniugata dalla UDP-glucuroniltransferasi-1A1 (UGT1A1) per formare bilirubina di-glucuronide (BR-dG). La BR coniugata (BR-dG) viene poi pompata nel dotto biliare e raggiunge l’intestino. La BR coniugata può essere riassorbita nell’intestino e rientrare in circolazione (Roy-Chowdhury et al., 2008; Vitek e Ostrow, 2009). Il metabolismo della BR nell’intestino per azione batterica genera l’urobilinogeno (UB) e il suo prodotto di ossidazione, l’urobilina, che viene eliminato nelle feci. L’urobilinogeno intestinale può essere riassorbito dall’intestino ed eliminato nelle urine come urobilina (Chowdhury e Chowdhury, 1983; Wang et al., 2006a).
Effetti antiossidanti dei pigmenti biliari
Il potenziale per l’uso dei pigmenti biliari come terapia è nato con la scoperta che queste sostanze agiscono come antiossidanti naturali. Stocker et al. hanno dimostrato che BV, BR e BR coniugato inibiscono la perossidazione lipidica in preparazioni liposomiche sottoposte a prove con sostanze chimiche iniziatrici di radicali liberi (Stocker e Ames, 1987; Stocker et al., 1987a; Stocker e Peterhans, 1989a). In questi sistemi modello, BR e BV hanno esercitato un’attività di rottura della catena e di cattura dei radicali perossili (Stocker e Ames, 1987; Stocker et al., 1987a). BV e BR coniugata hanno agito come co-antiossidanti con α-tocoferolo e hanno inibito il consumo di α-tocoferolo (Stocker e Peterhans, 1989a). La BR ha anche impedito il danno ossidativo alle proteine, come l’albumina del siero esposta a sistemi che generano ROS (Stocker et al., 1987b; Neuzil e Stocker, 1993). BR libero e legato all’albumina ha inibito l’ossidazione dei lipidi legati alle LDL, agendo come co-antiossidanti con l’α-tocoferolo legato alle LDL (Neuzil e Stocker, 1994).
La bilirubina può reagire con il radicale anione superossido, acido ipocloroso e ossigeno molecolare singoletto, inibire la foto-ossidazione delle proteine e inibire la chemiluminescenza nei macrofagi attivati (Stevens e Small, 1976; Pedersen et al, 1977; Stocker e Peterhans, 1989b). La BR può anche reagire con NO o specie di azoto reattivo (RNS; Kaur et al., 2003; Mancuso et al., 2003). Infine, la BR coniugata forma un complesso rameico che promuove la decomposizione degli idroperossidi, rappresentando un’attività pro-ossidante nella bile (Stocker e Ames, 1987).
La bilirubina serve come antiossidante circolante nel plasma umano. Il trattamento del plasma con agenti ossidanti ha portato all’esaurimento degli antiossidanti endogeni nell’ordine ubichinolo-10, ascorbato e bilirubina. L’aggiunta di BR al plasma umano dopo l’esaurimento degli antiossidanti naturali ha portato all’inibizione della perossidazione lipidica e alla riduzione del consumo di α-tocoferolo (Neuzil e Stocker, 1994). Campioni di siero di pazienti iperbilirubinemici con la sindrome di Gilbert erano resistenti all’ossidazione e mostravano una maggiore capacità antiossidante totale rispetto al siero di soggetti con una concentrazione di BR normale (Bulmer et al., 2008).
Il BR esogeno applicato farmacologicamente alle cellule coltivate può fornire una citoprotezione dose-dipendente contro lo stress ossidativo (Clark et al., 2000a). Per esempio, la BR (1-5 μM) ha protetto le cellule muscolari lisce vascolari coltivate contro la citotossicità dell’H2O2 generata dagli enzimi (Clark et al., 2000a). La BR applicata a concentrazioni nanomolari ha protetto i neuroni primari dalla citotossicità causata dall’H2O2 esogena (Doré et al., 1999).
Nonostante le prove che suggeriscono che la BR extracellulare può agire come un citoprotettore, il ruolo della BR come antiossidante cellulare rimane poco chiaro. La BR prodotta in situ è secreta nella circolazione, coniugata nel fegato ed escreta (Roy-Chowdhury, 1996). Tuttavia, la frazione di BR che viene trattenuta nelle cellule per servire una funzione antiossidante di membrana è sconosciuta. Un argomento comune contro un ruolo antiossidante cellulare per la BR è che l’ambiente cellulare contiene efficienti e abbondanti composti antiossidanti endogeni, comprese quantità millimolari di glutatione ridotto (GSH; Meister e Anderson, 1983), ascorbato, β-carotene e α-tocoferolo (Halliwell e Gutteridge, 1999). Dato che la BR viene esportata ed eliminata, il contributo relativo della BR alla capacità antiossidante cellulare in presenza di altri antiossidanti endogeni rimane poco chiaro.
Le prove attuali del ruolo della BR come antiossidante cellulare si basano su prove che utilizzano studi siRNA che prendono di mira BVR, l’enzima responsabile della formazione della BR. Il knockdown di BVR ha sensibilizzato le cellule ad alte concentrazioni di H2O2 (Baranano et al., 2002), e all’apoptosi mediata dall’arsenito (Miralem et al., 2005). In quest’ultimo caso, effetti simili non sono stati raggiunti con HO-1 knockdown, suggerendo effetti di BVR indipendenti dalla generazione di BR (Miralem et al., 2005).
Snyder et al. hanno osservato che BV si forma durante l’ossidazione di BR (Baranano et al., 2002). Gli autori hanno proposto che la BV formata dall’ossidazione della BR funga da substrato per la BVR, per rigenerare la BR, e quindi rappresenti un sistema antiossidante autoperpetuante, “il ciclo antiossidante BVR”. Le prove a favore e contro questo percorso sono state discusse altrove (Maghzal et al., 2009; Sedlak e Snyder, 2009; Stocker e Maghzal, 2009). Rimane poco chiaro se la BV rigenerata durante l’ossidazione della BR superi solo una frazione minore, e se questa contribuisca significativamente alla capacità antiossidante cellulare come proposto.
Tossicità della bilirubina
L’accumulo di bilirubina può essere dannoso, specialmente nei neonati con iperbilirubinemia neonatale. La tossicità selettiva della BR per il neonato è dovuta alla costituzione incompleta della barriera emato-encefalica. L’iperbilirubinemia neonatale non coniugata è associata a gravi effetti collaterali neurologici, che includono encefalopatia neurologica e kernicterus (Vitek e Ostrow, 2009). Per evitare il rischio di neurotossicità, la fototerapia viene applicata per ridurre i livelli di BR non coniugata nei neonati itterici (Blanckaert e Fevery, 1990). I meccanismi della tossicità della BR nel cervello sono stati rivisti altrove (Brito et al., 2008; Ghersi-Egea et al., 2009; Tell e Gustincich, 2009; Vitek e Ostrow, 2009).
Effetti protettivi dei pigmenti biliari in modelli animali di lesione dei tessuti
Esclusa la tossicità neonatale, una lieve iperbilirubinemia, dovuta all’elevata capacità antiossidante del siero, può conferire benefici all’ospite. In un modello murino di iperbilirubinemia, i ratti Gunn itterici hanno mostrato indici più bassi di stress ossidativo nel siero rispetto ai topi wild-type quando sono stati sfidati con l’iperossia (Dennery et al., 1995).
L’applicazione terapeutica di BR ha preservato la funzione miocardica durante il danno da ischemia/riperfusione (I/R) cardiaca (Clark et al., 2000b). In un modello di cuore perfuso isolato, il precondizionamento con eme ha protetto dall’infarto miocardico dopo la lesione I/R, associato all’aumento dell’espressione HO-1 e alla formazione di BR. La somministrazione di BR a concentrazioni nanomolari ha migliorato le prestazioni cardiache e ridotto le dimensioni dell’infarto e la disfunzione mitocondriale dopo lesioni I/R (Clark et al., 2000b)
L’iniezione di BV ha diminuito la produzione di citochine pro-infiammatorie (cioè, IL-6), ha aumentato i livelli di IL-10 e ha ridotto il danno infiammatorio ai polmoni nei ratti sottoposti a lipopolisaccaridi (LPS). Così, BV protetto contro l’infiammazione sistemica e lesioni polmonari dopo l’esposizione letale a LPS. Gli effetti protettivi di BV contro le lesioni indotte da LPS sono stati osservati nelle cellule endoteliali polmonari coltivate e nei macrofagi (Sarady-Andrews et al., 2005). Ulteriori effetti antinfiammatori di BR sono stati riportati in coltura cellulare. Per esempio, BR ha inibito l’espressione dipendente da TNF-α delle molecole di adesione (cioè, E-selectin, VCAM-1, ICAM-1) nelle cellule endoteliali (Mazzone et al., 2009). Recentemente, una maggiore traslocazione nucleare di BVR è stata implicata negli effetti antinfiammatori di BV (Wegiel et al., 2011).
Bilirubina può agire come un inibitore della proliferazione delle cellule muscolari lisce (Nakao et al., 2005; Ollinger et al., 2005). La somministrazione esogena di BV ha inibito l’iperplasia neointimale associata a lesioni vascolari nei ratti (Nakao et al., 2005; Ollinger et al., 2005). Questi effetti sono stati attribuiti alla downregulation di JNK e all’inibizione dell’apoptosi delle cellule endoteliali (Nakao et al., 2005). Allo stesso modo, gli animali iperbilirubinemici erano resistenti alle lesioni vascolari (Ollinger et al., 2005). Gli effetti antiproliferativi di BV e BR sono stati dimostrati in colture di cellule muscolari lisce vascolari. BV/BR esogena ha arrestato le cellule in fase G1 dopo la stimolazione del siero, associata all’inibizione della fosforilazione della proteina p38 MAPK e retinoblastoma (Ollinger et al., 2005).
L’iperbilirubinemia sperimentale (3-10 mg/dl) indotta per infusione ha protetto dalla fibrosi polmonare indotta dalla bleomicina nei ratti (Wang et al., 2002). I ratti infusi di BR hanno mostrato una ridotta lesione polmonare in risposta alla sfida della bleomicina, compreso un ridotto contenuto di idrossiprolina polmonare, un ridotto numero di linfociti polimorfonucleati e leucociti, e ridotti livelli di fattore di crescita trasformante-β nel lavaggio broncoalveolare (Wang et al., 2002). Così, gli effetti anti-fibrotici di BR possono riferirsi sia agli effetti antiossidanti che anti-proliferativi di questo pigmento.
Studi recenti hanno anche implicato un effetto protettivo di BV/BR nel diabete. L’applicazione di BV a ratti diabetici indotti da streptozotocina ha ridotto gli isoprostani urinari e ha protetto contro lo sfaldamento delle cellule endoteliali (Rodella et al., 2006). La BR ha migliorato la nefropatia diabetica, attraverso la riduzione della generazione di ROS citosolico e gli effetti antinfiammatori (Fujii et al., 2010). Topi iperbilirubinemici, o topi diabetici trattati con BV, hanno mostrato una ridotta albuminuria, e marcatori urinari di stress ossidativo rispetto ai controlli wild-type o non trattati, rispettivamente. Applicazione di BV o BR inibito la produzione di ROS in cellule endoteliali e mesangiale indotta da glucosio alto o l’esposizione angiotensina-II (Fujii et al., 2010).
Effetti protettivi dei pigmenti biliari nel trapianto d’organo
Gli effetti terapeutici dei pigmenti biliari applicati esogenamente sono stati descritti in modelli animali di trapianto d’organo e di rigetto acuto dell’innesto, compreso il trapianto di fegato (Fandevila et al., 2004), rene (Adin et al., 2005) e cuore (Yamashita et al., 2004). Nel rene isolato e perfuso, la perfusione con BR ha protetto dal danno tissutale caldo indotto da I/R e ha preservato la funzione renale (Adin et al., 2005). BV ha fornito una protezione dei tessuti in un modello ex vivo di lesione epatica I/R a freddo. Inoltre, l’inclusione di BV nel perfusato ha aumentato la sopravvivenza nei ratti sottoposti a trapianto epatico ortotopico preservando la funzione epatica (Fandevila et al., 2004). Questa protezione conferita da BV è stata associata a una diminuzione dell’espressione degli indici pro-infiammatori, tra cui l’afflusso di neutrofili, l’espressione di citochine pro-infiammatorie e l’attivazione di iNOS (Fondevila et al., 2004). Il trattamento con BV ha migliorato la sopravvivenza degli allotrapianti cardiaci di ratto, riducendo l’infiltrazione di leucociti e inibendo la proliferazione delle cellule T (Yamashita et al., 2004). Nel danno I/R a freddo associato al trapianto di innesti cardiaci e renali, l’applicazione di BV contemporaneamente a CO ha fornito una protezione sinergica dei tessuti, mentre effetti minori sono stati osservati con uno dei due agenti di prova da soli (Nakao et al., 2000). La BV ha anche impedito il rigetto degli innesti polmonari da donatori cerebralmente morti, che sono più inclini al rigetto (Zhou et al., 2011). Nel trapianto allogenico di isole, il trattamento del donatore o dell’innesto del donatore ex vivo con BR ha migliorato la sopravvivenza dell’innesto di isole. Anche il trattamento del ricevente con BR ha migliorato la sopravvivenza degli innesti di isole (Wang et al., 2006b; Zhu et al., 2010). La BR ha conferito la tolleranza del trapianto agli innesti di isole attraverso l’up-regolazione delle cellule T regolatrici (Lee et al., 2007). Gli effetti anti-apoptotici e anti-infiammatori di BV/BR osservati in modelli di lesioni I/R possono contribuire alla protezione durante le lesioni I/R associate al trapianto. Questi esperimenti suggeriscono anche che la BR farmacologica può avere funzioni immunomodulanti che contribuiscono agli effetti terapeutici nell’impostazione del rigetto dell’innesto (Ollinger et al., 2007).
Bilirubina nelle malattie cardiovascolari e polmonari
Recenti studi clinici hanno riportato associazioni inverse tra i livelli sierici di BR e i fattori di rischio associati alla CVD. Questi studi suggeriscono collettivamente che gli aumenti naturali di BR nel siero conferiscono protezione contro CVD, tra cui aterosclerosi, malattia coronarica (CAD)/cardiopatia ischemica (IHD), diabete e ictus (Novotný e Vítek, 2003; Franchini et al, 2010).
In uno dei primi studi che riportano associazioni tra BR e CVD, uno studio di 619 maschi aggiustati per i fattori di rischio dipendenti dall’età, il livello di BR sierica è stato descritto come un fattore di rischio inverso per CAD (Schwertner et al., 1994). La BR era debolmente predittiva per la CAD rispetto ai marcatori lipoproteici (Levinson, 1997). Tuttavia, è stata riportata una forte correlazione tra i livelli di BR e i livelli di apolipoproteina B, un fattore di rischio per l’aterosclerosi (Levinson, 1997). I livelli sierici di BR rappresentavano un fattore di rischio inverso per la CAD in soggetti con CAD familiare precoce (Hopkins et al., 1996).
In uno studio prospettico su larga scala (7.685 uomini), i soggetti nella fascia media della concentrazione di BR nel siero mostravano un rischio ridotto di IHD, rispetto ai soggetti nel quintile più basso della distribuzione di BR nel siero (Breimer et al., 1995). I soggetti nel quintile più basso di BR presentavano una riduzione del colesterolo delle lipoproteine ad alta densità (HDL) e una ridotta funzione polmonare. Anche se il BR sierico di livello medio era associato a un rischio ridotto di CVD, gli individui iperbilirubinemici (quintile più alto) presentavano un rischio di IHD simile a quello degli individui nel quintile più basso di BR sierico (Breimer et al., 1995).
I livelli di BR sierico sono stati indicati come un fattore di rischio indipendente e inverso per la malattia vascolare periferica (Breimer et al., 1994). In studi trasversali su larga scala, i livelli sierici di BR nella norma sono stati inversamente associati al rischio di malattia vascolare periferica (Perlstein et al., 2008a) e di ictus (Perlstein et al., 2008b). Un aumento di 1,71 μM del livello di BR era associato a una riduzione del 6% delle probabilità di malattia vascolare periferica (7.075 partecipanti; Perlstein et al., 2008a) e una riduzione del 9% delle probabilità di ictus (13.214 partecipanti; Perlstein et al., 2008b).
In 72 soggetti sani, i livelli sierici di BR erano inversamente correlati a indicatori di aterosclerosi (Erdogan et al., 2005). Bassi livelli sierici di BR sono stati associati a un aumento dello spessore intimale-mediale dell’arteria carotidea e a un’alterata vasodilatazione mediata dal flusso, indicativa di disfunzione endoteliale (Erdogan et al., 2005). Inoltre, i livelli di BR erano inversamente correlati alla formazione di placca carotidea in 1.774 soggetti, con un rapporto di probabilità riportato di 0,37 per un aumento di 17,1 μM aumento di BR (Ishizaka et al., 2001).
In uno studio trasversale di 2.307 coreani, livelli totali e diretti BR erano inversamente correlati ai livelli plasmatici di proteina C-reattiva (CRP), un indicatore di infiammazione vascolare (Hwang et al., 2011). Simili associazioni inverse sono state riportate tra BR e livelli di alta sensibilità (hs)-CRP (Gullu et al., 2005; Yoshino et al., 2011). BR era inversamente correlato con CVD in pazienti con ipercolesterolemia, ed elevato in pazienti che ricevono statine (Nolting et al., 2011).
Uno studio prospettico (Framingham offspring study, 5.124 partecipanti) ha concluso che una maggiore concentrazione di BR totale del siero è stato associato con un rischio inferiore di CVD negli uomini, con associazione non chiara per le donne (Djousse et al., 2001). Questo studio ha rivelato un rischio più elevato di infarto del miocardio sia per gli uomini che per le donne associato a BR sierica bassa e albumina sierica bassa (Djoussé et al., 2003).
I livelli di bilirubina sono stati esaminati come un predittore indipendente di mortalità CVD. Nessuna associazione è stata trovata tra BR sierica e mortalità CVD per tutte le cause in uno studio di 10 anni della popolazione belga, anche se un aumento di BR è stato associato a una ridotta mortalità per cancro nei maschi (Temme et al., 2001). Tuttavia, in uno studio recentemente pubblicato su 1.279 uomini, i livelli di BR e il livello di fitness cardiopolmonare era indipendentemente e negativamente correlato alla mortalità per tutte le cause e CVD (Ajja et al, 2011).
Altri studi hanno analizzato le potenziali associazioni tra i livelli di BR e malattie correlate a CVD come il diabete (Ko et al., 1996; Fukui et al., 2008, 2011; Cheriyath et al., 2010) e la sindrome metabolica (Jo et al., 2011; Kwon et al., 2011). Un grande studio trasversale (15.876 soggetti) ha riportato un’associazione inversa tra BR totale e rischio di diabete (Cheriyath et al., 2010). I pazienti con diabete di tipo II in emodialisi hanno mostrato un aumentato rischio di CVD associato a basso BR sierico, rispetto ai pazienti diabetici non in emodialisi (Fukui et al., 2011). Il BR sierico era inversamente correlato all’albuminuria nei pazienti diabetici di tipo II (Fukui et al., 2008). In una coorte cinese (1.508 soggetti), un basso BR sierico è stato associato ad aberrazioni nella tolleranza al glucosio e ad aumenti dei fattori di rischio CVD tra cui trigliceridi, lipoproteine a bassissima densità ed emoglobina glicata (Ko et al., 1996).
Altri studi hanno esaminato le associazioni di BR con CVD in iperbilirubinemia originata da disturbi metabolici del metabolismo BR. Un polimorfismo di ripetizione TA del promotore del gene UTG1A1 (designato UGT1A1*28, o TA7) provoca una ridotta trascrizione di UTG1A e un deficit nella coniugazione e clearance epatica della BR (Schwertner e Vítek, 2008). Gli individui omozigoti per UGT1A1*28 (TA7/TA7) mostrano un’iperbilirubinemia, denominata sindrome di Gilbert, rispetto ai soggetti wild-type (TA6/TA6) o eterozigoti. Un rischio sei volte inferiore di IHD e colesterolo HDL elevato è stato riportato in uno studio su 50 pazienti di Gilbert rispetto alla popolazione generale (Vítek et al., 2002). Nei pazienti di Gilbert, BR non coniugato era negativamente correlato con piccolo colesterolo lipoproteico denso a bassa densità sd-LDL-C, LDL ossidato e hs-CRP (Tapan et al., 2011).
Nello studio Framingham Heart portatori omozigoti per l’allele UGT1A1*28 con elevate concentrazioni di BR nel siero visualizzato una forte associazione con rischio CVD inferiore (Lin et al., 2006). Queste osservazioni sono state ulteriormente convalidate da studi di associazione condizionale e genome-wide. Questi studi hanno concluso che UTG1A è un gene importante collegato a CVD, e che il polimorfismo TA repeat è fortemente associato a un ridotto rischio di CVD (Lin et al., 2009). In uno studio sulla malattia arteriosa periferica, non è stata osservata alcuna associazione dei polimorfismi UGT1A1, nonostante la correlazione inversa del rischio CVD con i livelli di BR (Rantner et al., 2008). Recenti studi post mortem hanno anche riportato che i polimorfismi UGT1A1 non erano correlati alla gravità della CAD (Papez et al., 2009).
Infine, BR era inversamente associato al rischio di malattie polmonari. In uno studio di coorte (504.206 soggetti) ogni aumento di 0,1 mg/dl di BR nei maschi era associato al 9% e al 6% di diminuzione del rischio di cancro ai polmoni e di malattia polmonare ostruttiva cronica, rispettivamente (Horsfall et al., 2011).
Conclusione
La biliverdina e la BR sono sostanze naturali derivate dal catabolismo dell’eme che possiedono proprietà antiossidanti. Inoltre, la BR circolante può contribuire alla capacità antiossidante del siero. In studi pre-clinici, l’applicazione farmacologica della BR conferisce protezione contro il danno I/R, il danno polmonare acuto, la fibrosi polmonare, il danno renale e il rigetto dell’innesto. Diverse limitazioni delle applicazioni terapeutiche dei pigmenti biliari devono essere considerate. Anche se BV è solubile in mezzi acquosi, BR è lipofilo e solubile solo in solventi organici, ponendo così sfide per la consegna terapeutica.
Bilirubina è il sottoprodotto della via di degradazione eme, e quindi può mediare le proprietà citoprotettive di HO-1 (Foresti et al., 2004). Approcci farmacologici o di terapia genica che coinvolgono l’espressione mirata di HO-1 sono in fase di sviluppo (Abraham et al., 2007). Tuttavia, questi approcci non sono specifici per la generazione di BV/BR, poiché la modulazione di HO-1 ha effetti pleiotropici che hanno un impatto sul metabolismo sistemico del ferro e sulla generazione di CO. Allo stesso modo, l’espressione mirata di BVR può influenzare le vie di segnalazione cellulare indipendentemente dal suo ruolo nella generazione di pigmenti biliari (Kapitulnik e Maines, 2009). Studi clinici hanno suggerito associazioni inverse tra BR sierica e rischio CVD. L’iperbilirubinemia lieve può ridurre il rischio di CVD, ma questo attende ulteriori convalide. Ad oggi, non ci sono ancora metodologie pratiche per indurre l’iperbilirubinemia per un beneficio clinico. Nonostante il beneficio terapeutico in modelli animali di lesioni tissutali, il potenziale terapeutico della BR rimane non testato nell’uomo.
Conflict of Interest Statement
L’autore dichiara che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Acknowledgments
Il dottor Ryter desidera riconoscere i colleghi attuali e precedenti che hanno contribuito ad alcuni dei lavori di riferimento qui descritti. Il dottor Ryter ha attualmente un incarico di facoltà presso il Brigham and Women’s Hospital (BWH), Boston, ed è uno scienziato aggiunto del Lovelace Respiratory Research Institute (LRRI), Albuquerque, New Mexico. In questa veste, il Dr. Ryter ha ricevuto un sostegno salariale dal consorzio LRRI/BWH per la ricerca polmonare.
Abraham, N. G., Asija, A., Drummond, G., e Peterson, S. (2007). Terapia genica dell’eme ossigenasi-1: progressi recenti e applicazioni terapeutiche. Curr. Gene Ther. 7, 89-108.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Adin, C. A., Croker, B. P., and Agarwal, A. (2005). Effetti protettivi della bilirubina esogena sul danno da ischemia-riperfusione nel rene di ratto isolato e perfuso. Am. J. Physiol. Renal Physiol. 288, F778-F784.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ajja, R., Lee, D. C., Sui, X., Church, T. S., e Steven, N. B. (2011). Utilità di bilirubina sierica e fitness cardiorespiratorio come predittori di mortalità negli uomini. Am. J. Cardiol. 108, 1438-1442.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Baranano, D. E., Rao, M., Ferris, C. D., e Snyder, S. H. (2002). Biliverdina reduttasi: un importante citoprotettore fisiologico. Proc. Natl. Acad. Sci. U.S.A. 99, 16093-16098.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Blanckaert, N., and Fevery, J. (1990). “Fisiologia e fisiopatologia del metabolismo della bilirubina”, in Hepatology. A Textbook of Liver Disease, 2nd Edn, Vol. 1, eds D. Zakim and T. D. Boyer (Philadelphia: W. D. Saunders), 254-302.
Breimer, L. H., Spyropolous, K. A., Winder, A. F., Mikhailidis, D. P., and Hamilton, G. (1994). La bilirubina è protettiva contro la malattia coronarica. Clin. Chimica. 40, 1987-1988.
Pubmed Abstract | Pubmed Full Text
Breimer, L. H., Wannamethee, G., Ebrahim, S., e Shaper, A. G. (1995). Bilirubina sierica e rischio di cardiopatia ischemica in uomini britannici di mezza età. Clin. Chem. 41, 1504-1508.
Pubmed Abstract | Pubmed Full Text
Brito, M. A., Lima, S., Fernandes, A., Falcão, A. S., Silva, R. F., Butterfield, D. A., e Brites, D. (2008). Lesioni da bilirubina ai neuroni: contributo dello stress ossidativo e salvataggio da parte dell’acido glicorodesossicolico. Neurotoxicology 29, 259-269.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bulmer, A. C., Blanchfield, J. T., Toth, I., Fassett, R. G., e Coombes, J. S. (2008). Migliore resistenza all’ossidazione del siero nella sindrome di Gilbert: un meccanismo di protezione cardiovascolare. Atherosclerosis 199, 390-396.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cheriyath, P., Gorrepati, V. S., Peters, I., Nookala, V., Murphy, M. E., Srouji, N., and Fischman, D. (2010). Bilirubina totale elevata come fattore protettivo per il diabete mellito: un’analisi dei dati NHANES dal 1999-2006. J. Clin. Med. Res. 2, 201-216.
Pubmed Abstract | Pubmed Full Text
Chowdhury, J. R. e Chowdhury, N. R. (1983). Coniugazione ed escrezione della bilirubina. Semin. Fegato Dis. 3, 11-23.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chowdhury, J. R., Chowdhury, N. R., Bhargava, M. M., and Arias, I. M. (1979). Purificazione e caratterizzazione parziale della bilirubina di ratto glucuronoside glucuronosyltransferase. J. Biol. Chem. 254, 8336-8339.
Pubmed Abstract | Pubmed Full Text
Clark, J. E., Foresti, R., Green, C. J., and Motterlini, R. (2000a). Dinamica dell’espressione dell’emossigenasi-1 e della produzione di bilirubina nella protezione cellulare contro lo stress ossidativo. Biochem. J. 348, 615-619.
CrossRef Full Text
Clark, J. E., Foresti, R., Sarathchandra, P., Kaur, H., Green, C. J., and Motterlini, R. (2000b). La bilirubina derivata dall’eme ossigenasi-1 migliora la disfunzione miocardica postischemica. Am. J. Physiol. 278, H643-H651.
Cui, Y., König, J., Leier, I., Buchholz, U., e Keppler, D. (2001). Assorbimento epatico della bilirubina e dei suoi coniugati da parte del trasportatore umano di anioni organici SLC21A6. J. Biol. Chem. 276, 9626-9630.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Davies, K. J. (1995). Stress ossidativo: il paradosso della vita aerobica. Biochem. Soc. Symp. 61, 1-31.
Pubmed Abstract | Pubmed Full Text
Davies, K. J. (2000). Stress ossidativo, difese antiossidanti e sistemi di rimozione, riparazione e sostituzione dei danni. IUBMB Life 50, 279-289.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dennery, P. A., McDonagh, A. F., Spitz, D. R., Rodgers, P. A., and Stevenson, D. K. (1995). Risultati iperbilirubinemia in ridotto danno ossidativo in neonatale Gunn ratti esposti a iperossia. Radicali liberi. Biol. Med. 19, 395-404.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Djousse, L., Levy, D., Cupples, L. A., Evans, J. C., D’Agostino, R. B., e Ellison, R. C. (2001). Bilirubina sierica totale e rischio di malattie cardiovascolari nel Framingham Offspring Study. Am. J. Cardiol. 87, 1196-1200.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Djoussé, L., Rothman, K. J., Cupples, L. A., Levy, D., and Ellison, R. C. (2003). Effetto di albumina sierica e bilirubina sul rischio di infarto miocardico (il Framingham Offspring Study). Am. J. Cardiol. 91, 485-488.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Doré, S., Takahashi, M., Ferris, C. D., Zakhary, R., Hester, L. D., Guastella, D., and Snyder, S. H. (1999). La bilirubina, formata dall’attivazione dell’eme ossigenasi-2, protegge i neuroni dalle lesioni da stress ossidativo. Proc. Natl. Acad. Sci. U.S.A. 96, 2445-2450.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dröge, W. (2002). Radicali liberi nel controllo fisiologico della funzione cellulare. Physiol. Rev. 82, 47-95.
Pubmed Abstract | Pubmed Full Text
Erdogan, D., Gullu, H., Yildirim, E., Tok, D., Kirabas, I., Ciftci, O., Baycan, S. T., and Muderrisoglu, H. (2005). Bassi livelli di bilirubina nel siero sono indipendentemente e inversamente correlati a una ridotta vasodilatazione mediata dal flusso e a un aumento dello spessore dell’intima media della carotide sia negli uomini che nelle donne. Atherosclerosis 184, 431-437.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fondevila, C., Shen, X. D., Tsuchiyashi, S., Yamashita, K., Csizmadia, E., Lassman, C., Busuttil, R. W., Kupiec-Weglinski, J. W., and Bach, F. H. (2004). La terapia con biliverdina protegge i fegati di ratto dall’ischemia e dal danno da riperfusione. Hepatology 40, 1333-1341.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Foresti, R., Green, C. J., and Motterlini, R. (2004). Generazione di pigmenti biliari da parte dell’emossigenasi: una raffinata strategia cellulare in risposta a insulti stressanti. Biochem. Soc. Symp. 71, 177-192.
Pubmed Abstract | Pubmed Full Text
Forman, H. J., Maiorino, M., and Ursini, F. (2010). Funzioni di segnalazione di specie reattive dell’ossigeno. Biochemistry 49, 835-842.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franchini, M., Targher, G., and Lippi, G. (2010). Livelli sierici di bilirubina e rischio di malattie cardiovascolari: un Giano Bifronte? Adv. Clin. Chem. 50, 47-63.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fujii, M., Inoguchi, T., Sasaki, S., Maeda, Y., Zheng, J., Kobayashi, K., e Takayanagi, R. (2010). La bilirubina e la biliverdina proteggono i roditori dalla nefropatia diabetica attraverso la downregolazione della NAD(P)H ossidasi. Kidney Int. 78, 905-919.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fukui, M., Tanaka, M., Shiraishi, E., Harusato, I., Hosoda, H., Asano, M., Hasegawa, G., e Nakamura, N. (2008). Relazione tra bilirubina sierica e albuminuria in pazienti con diabete di tipo 2. Kidney Int. 74, 1197-1201.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fukui, M., Tanaka, M., Yamazaki, M., Hasegawa, G., Nishimura, M., Iwamoto, N., Ono, T., Imai, S. e Nakamura, N. (2011). Bassa concentrazione di bilirubina nel siero in pazienti in emodialisi con diabete di tipo 2. Diabet. Med. 28, 96-99.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
García-Lafuente, A., Guillamón, E., Villares, A., Rostagno, M. A., and Martínez, J. A. (2009). Flavonoidi come agenti anti-infiammatori: implicazioni nel cancro e malattie cardiovascolari. Infiammazione. Res. 58, 537-552.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ghersi-Egea, J. F., Gazzin, S., and Strazielle, N. (2009). Interfacce sangue-cervello e malattie neurologiche indotte dalla bilirubina. Curr. Pharm. Des. 15, 2893-2907.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gullu, H., Erdogan, D., Tok, D., Topcu, S., Caliskan, M., Ulus, T., e Muderrisoglu, H. (2005). Elevate concentrazioni sieriche di bilirubina preservano la riserva di flusso coronarico e le funzioni microvascolari coronariche. Arterioscler. Thromb. Vasc. Biol. 25, 2289-2294.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Halliwell, B., and Gutteridge, J. M. C. (1999). Radicali liberi in biologia e medicina. New York, NY: Oxford University Press.
Hopkins, P. N., Wu, L. L., Hunt, S. C., James, B. C., Vincent, G. M., and Williams, R. R. (1996). Più alta bilirubina sierica è associata ad una diminuzione del rischio di malattia coronarica familiare precoce. Arterioscler. Thromb. Vasc. Biol. 16, 250-255.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Horsfall, L. J., Rait, G., Walters, K., Swallow, D. M., Pereira, S. P., Nazareth, I., and Petersen, I. (2011). Bilirubina sierica e rischio di malattie respiratorie e morte. JAMA 305, 691-697.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hwang, H. J., Lee, S. W., and Kim, S. H. (2011). Relazione tra bilirubina e proteina C-reattiva. Clin. Chem. Lab. Med. 49, 1823-1828.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ishizaka, N., Ishizaka, Y., Takahashi, E., Yamakado, M., e Hashimoto, H. (2001). Alto livello di bilirubina nel siero è inversamente associato con la presenza di placca carotidea. Stroke 32, 580-583.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jo, J., Yun, J. E., Lee, H., Kimm, H., e Jee, S. H. (2011). Concentrazioni di bilirubina sierica totale, diretta e indiretta e sindrome metabolica nella popolazione coreana. Endocrine 39, 182-189.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kaliora, A. C., Dedoussis, G. V., e Schmidt, H. (2006). Antiossidanti alimentari nella prevenzione dell’aterogenesi. Atherosclerosis 187, 1-17.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kamisako, T., Kobayasi, Y., Takeuchi, K., Ishihara, T., Higuchi, K., Tanaka, Y., Gabazza, E. C., e Adachi, Y. (2000). Recenti progressi nella ricerca sul metabolismo della bilirubina: il meccanismo molecolare del trasporto della bilirubina negli epatociti e la sua rilevanza clinica. J. Gastroenterol. 35, 659-664.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kapitulnik, J., and Maines, M. D. (2009). Funzioni pleiotropiche della biliverdina reduttasi: segnalazione cellulare e generazione di bilirubina citoprotettiva e citotossica. Trends Pharmacol. Sci. 30, 129-137.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kaur, H., Hughes, M. N., Green, C. J., Naughton, P., Foresti, R., and Motterlini, R. (2003). Interazione di bilirubina e biliverdina con specie azotate reattive. FEBS Lett. 543, 113-119.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ko, G. T., Chan, J. C., Woo, J., Lau, E., Yeung, V. T., Chow, C. C., Li, J. K., So, W. Y., e Cockram, C. S. (1996). Bilirubina sierica e fattori di rischio cardiovascolare in una popolazione cinese. J. Cardiovasc. Risk 3, 459-463.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kwon, K. M., Kam, J. H., Kim, M. Y., Kim, M. Y., Chung, C. H., Kim, J. K., Linton, J. A., Eom, A., Koh, S. B., e Kang, H. T. (2011). Associazione inversa tra bilirubina totale e sindrome metabolica in donne coreane rurali. J. Womens Health (Larchmt) 20, 963-969.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lee, S. S., Gao, W., Mazzola, S., Thomas, M. N., Csizmadia, E., Otterbein, L. E., Bach, F. H., e Wang, H. (2007). L’eme ossigenasi-1, il monossido di carbonio e la bilirubina inducono la tolleranza nei riceventi verso gli allotrapianti di isole modulando le cellule T regolatrici. FASEB J. 21, 3450-3457.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levinson, S. S. (1997). Relazione tra bilirubina, apolipoproteina B e malattia coronarica. Ann. Clin. Lab. Sci. 27, 185-192.
Pubmed Abstract | Pubmed Full Text
Lin, J. P., O’Donnell, C. J., Schwaiger, J. P., Cupples, L. A., Lingenhel, A., Hunt, S. C., Yang, S., and Kronenberg, F. (2006). Associazione tra l’allele UGT1A1*28, livelli di bilirubina e malattia coronarica nel Framingham Heart Study. Circulation 114, 1476-1481.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lin, J. P., Schwaiger, J. P., Cupples, L. A., O’Donnell, C. J., Zheng, G., Schoenborn, V., Hunt, S. C., Joo, J., e Kronenberg, F. (2009). Linkage condizionale e studi di associazione genome-wide identificare UGT1A1 come un gene importante per i livelli di bilirubina nel siero anti-aterogeno – il Framingham Heart Study. Atherosclerosis 206, 228-233.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Litwack, G., Ketterer, B., e Arias, I. M. (1971). Ligandin: una proteina epatica che lega steroidi, bilirubina, cancerogeni e un certo numero di anioni organici esogeni. Nature 234, 466-467.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maghzal, G. J., Leck, M. C., Collinson, E., Li, C., and Stocker, R. (2009). Ruolo limitato per il ciclo di amplificazione redox bilirubina-biliverdina nella protezione antiossidante cellulare da biliverdina reduttasi. J. Biol. Chem. 284, 29251-29259.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maines, M. D. (1997). Il sistema dell’eme ossigenasi: un regolatore di gas secondo messaggero. Annu. Rev. Pharmacol. Toxicol. 37, 517-554.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mancuso, C., Bonsignore, A., Di Stasio, E., Mordente, A., and Motterlini, R. (2003). Interazione tra bilirubina e S-nitrosothiols: evidenza di un possibile ruolo della bilirubina come scavenger dell’ossido nitrico. Biochem. Pharmacol. 66, 2355-2363.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mazzone, G. L., Rigato, I., Ostrow, J. D., Bossi, F., Bortoluzzi, A., Sukowati, C. H., Tedesco, F., and Tiribelli, C. (2009). La bilirubina inibisce l’induzione legata al TNFalfa di tre molecole di adesione endoteliale. Biochem. Biophys. Res. Commun. 386, 338-344.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Meister, A., e Anderson, M. E. (1983). Glutatione. Annu. Rev. Biochem. 52, 711-760.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Miralem, T., Hu, Z., Torno, M. D., Lelli, K. M., e Maines, M. D. (2005). Il silenziamento genico mediato da Small Interference RNA della biliverdina reduttasi umana, ma non quello dell’eme ossigenasi-1, attenua l’induzione mediata dall’arsenito dell’ossigenasi e aumenta l’apoptosi nelle cellule renali 293A. J. Biol. Chem. 280, 17084-17092.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nakao, A., Murase, N., Ho, C., Toyokawa, H., Billiar, T. R., e Kanno, S. (2005). La somministrazione di biliverdina previene la formazione di iperplasia intimale indotta da lesioni vascolari. Circulation 112, 587-591.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nakao, A., Neto, J. S., Kanno, S., Stolz, D. B., Kimizuka, K., Liu, F., Bach, F. H., Billiar, T. R., Choi, A. M., Otterbein, L. E., and Murase, N. (2000). Protezione contro il danno da ischemia/riperfusione nel trapianto cardiaco e renale con monossido di carbonio, biliverdina e entrambi. Am. J. Transplant. 5, 282-291.
CrossRef Full Text
Neuzil, J., and Stocker, R. (1993). La bilirubina attenua i danni mediati dai radicali all’albumina del siero. FEBS Lett. 331, 281-284.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Neuzil, J., e Stocker, R. (1994). La bilirubina libera e quella legata all’albumina sono efficienti co-antiossidanti per l’alfa-tocoferolo, inibendo la perossidazione lipidica del plasma e delle lipoproteine a bassa densità. J. Biol. Chem. 269, 16712-16719.
Pubmed Abstract | Pubmed Full Text
Noguchi, M., Yoshida, T., e Kikuchi, G. (1979). Requisito specifico di NADPH-citocromo c reduttasi per la reazione microsomiale dell’eme ossigenasi che produce biliverdina IX alfa. FEBS Lett. 98, 281-284.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nolting, P. R., Kusters, D. M., Hutten, B. A., Kastelein, J. J., and ExPRESS study group. (2011). Livelli di bilirubina nel siero in ipercolesterolemia familiare: un nuovo marker di rischio per la malattia cardiovascolare? J. Lipid Res. 52, 1755-1759.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Novotný, L., and Vítek, L. (2003). Relazione inversa tra bilirubina sierica e aterosclerosi negli uomini: una meta-analisi degli studi pubblicati. Exp. Biol. Med. (Maywood) 228, 568-571.
Pubmed Abstract | Pubmed Full Text
Ollinger, R., Bilban, M., Erat, A., Froio, A., McDaid, J., Tyagi, S., Csizmadia, E., Graca-Souza, A. V., Liloia, A., Soares, M. P., Otterbein, L. E., Usheva, A., Yamashita, K., and Bach, F. H. (2005). Bilirubina: un inibitore naturale della proliferazione delle cellule muscolari lisce vascolari. Circulation 112, 1030-1039.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ollinger, R., Wang, H., Yamashita, K., Wegiel, B., Thomas, M., Margreiter, R., and Bach, F. H. (2007). Applicazioni terapeutiche della bilirubina e della biliverdina nei trapianti. Antiossid. Redox Signal. 9, 2175-2185.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Papez, M. J., Civalier, C. J., Thorne, L. B., e Gulley, M. L. (2009). UGT1A1 genotipo promotore non è fortemente associato con la gravità della malattia coronarica. Diagnosi. Mol. Pathol. 18, 226-231.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pedersen, A. O., Shonheyder, F., e Broderson, R. (1977). Fotoossidazione dell’albumina del siero umano e il suo complesso con la bilirubina. Eur. J. Biochimica. 72, 213-221.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Perlstein, T. S., Pande, R. L., Beckman, J. A., and Creager, M. A. (2008a). Livello di bilirubina totale nel siero e malattia arteriosa periferica prevalente dell’estremità inferiore: National Health and Nutrition Examination Survey (NHANES) 1999 a 2004. Arterioscler. Thromb. Vasc. Biol. 28, 166-172.
CrossRef Full Text
Perlstein, T. S., Pande, R. L., Creager, M. A., Weuve, J., and Beckman, J. A. (2008b). Livello di bilirubina totale nel siero, ictus prevalente ed esiti dell’ictus: NHANES 1999-2004. Am. J. Med. 121, 781-788.
CrossRef Full Text
Rantner, B., Kollerits, B., Anderwald-Stadler, M., Klein-Weigel, P., Gruber, I., Gehringer, A., Haak, M., Schnapka-Köpf, M., Fraedrich, G. e Kronenberg, F. (2008). Associazione tra il polimorfismo UGT1A1 TA-repeat e la concentrazione di bilirubina in pazienti con claudicazione intermittente: risultati dello studio CAVASIC. Clin. Chimica. 54, 851-857.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Rodella, L., Lamon, B. D., Rezzani, R., Sangras, B., Goodman, A. I., Falck, J. R., and Abraham, N. G. (2006). Monossido di carbonio e biliverdina prevenire sloughing delle cellule endoteliali nei ratti con diabete di tipo I. Radicale libero. Biol. Med. 40, 2198-2205.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roy-Chowdhury, J. (1996). “Il metabolismo della bilirubina e i suoi disturbi”, in Hepatology. A Textbook of Liver Disease, 3rd Edn, Vol. 1, eds D. Zakim and T. D. Boyer (Philadelphia: W. D. Saunders), 323-361.
Roy-Chowdhury, N., Lu, Y., and Roy-Chowdhury, J. (2008) “Bilirbuin metabolism,” in Textbook of Hepatology: From Basic Science to Clinical Practice, 3rd Edn, eds J. Rodés, J. P. Benhamou, A. T. Blei, J. Reichen, and M. Rizzetto (Hoboken, NJ: Wiley), 165-174.
Ryter, S. W., Morse, D., and Choi, A. M. (2007). Monossido di carbonio e bilirubina: potenziali terapie per lesioni e malattie polmonari/vascolari. Am. J. Respir. Cell Mol. Biol. 36, 175-182.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sarady-Andrews, J. K., Liu, F., Gallo, D., Nakao, A., Overhaus, M., Ollinger, R., Choi, A. M., e Otterbein, L. E. (2005). La somministrazione di biliverdina protegge dal danno polmonare acuto indotto dall’endotossina nei ratti. Am. J. Physiol. Lung Cell Mol. Physiol. 289, L1131-L1137.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schwertner, H. A., Jackson, W. G., and Tolan, G. (1994). Associazione di bassa concentrazione sierica di bilirubina con aumento del rischio di malattia coronarica. Clin. Chimica. 40, 18-23.
Pubmed Abstract | Pubmed Full Text
Schwertner, H. A., and Vítek, L. (2008). Sindrome di Gilbert, allele UGT1A1*28 e rischio di malattie cardiovascolari: possibili effetti protettivi e applicazioni terapeutiche della bilirubina. Atherosclerosis 198, 1-11.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sedlak, T. W., and Snyder, S. H. (2009). Ciclismo i carri per biliverdina reduttasi. J. Biol. Chem. 284, le11.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stevens, B., e Small, R. D. (1976). La fotoperossidazione di molecole organiche insature-XV. O2 1Δg quenching da bilirubina e biliverdina. Photochem. Photobiol. 23, 33-36.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stocker, R., e Ames, B. (1987). Ruolo potenziale della bilirubina coniugata e del rame nel metabolismo dei perossidi lipidici nella bile. Proc. Natl. Acad. Sci. U.S.A. 84, 8130-8134.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stocker, R., and Maghzal, G. J. (2009). Risposta a Sedlak e Snyder: il piccolo bighorn del ciclo di amplificazione della biliverdina reduttasi. J. Biol. Chem. 284, le12.
CrossRef Full Text
Stocker, R., e Peterhans, E. (1989a). Interazione sinergica tra la vitamina E e i pigmenti biliari bilirubina e biliverdina. Biochim. Biophys. Acta 1002, 238-244.
Stocker, R., and Peterhans, E. (1989b). Proprietà antiossidanti della bilirubina coniugata e della biliverdina: scavenging rilevante dell’acido ipocloroso. Radicale libero. Res. Commun. 6, 57-66.
CrossRef Full Text
Stocker, R., Yamamoto, Y., McDonagh, A., Glazer, A., and Ames, B. N. (1987a). La bilirubina è un antiossidante di possibile importanza fisiologica. Science 235, 1043-1045.
CrossRef Full Text
Stocker, R., Glazer, A. N., and Ames, B. N. (1987b). Attività antiossidante della bilirubina legata all’albumina. Proc. Natl. Acad. Sci. U.S.A. 84, 5918-5922.
CrossRef Full Text
Sugamura, K., and Keaney, J. F. Jr. (2011). Specie reattive dell’ossigeno nelle malattie cardiovascolari. Radicali liberi. Biol. Med. 51, 978-992.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tapan, S., Karadurmus, N., Dogru, T., Ercin, C. N., Tasci, I., Bilgi, C., Kurt, I., and Erbil, M. K. (2011). Diminuzione dei livelli di LDL piccole e dense nella sindrome di Gilbert. Clin. Biochem. 44, 300-303.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tell, G., and Gustincich, S. (2009). Stato Redox, stress ossidativo e meccanismi molecolari degli effetti protettivi e tossici della bilirubina sulle cellule. Curr. Pharm. Des. 15, 2908-2914.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Temme, E. H. M., Zhang, J. J., Schouten, E. G., and Kesteloot, H. (2001). Bilirubina sierica e rischio di mortalità a 10 anni in una popolazione belga. Cancer Causes Control 12, 887-894.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tenhunen, R., Marver, H. S., and Schmid, R. (1969). Eme ossigenasi microsomiale. Caratterizzazione dell’enzima. J. Biol. Chem. 244, 6388-6394.
Pubmed Abstract | Pubmed Full Text
Tenhunen, R., Ross, M. E., Marver, H. S., and Schmid, R. (1970). Ridotto nicotinamide-adenina dinucleotide fosfato dipendente biliverdina reduttasi: purificazione parziale e caratterizzazione. Biochemistry 9, 298-303.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Valko, M., Rhodes, C. J., Moncol, J., Izakovic, M., and Mazur, M. (2006). Radicali liberi, metalli e antiossidanti nel cancro indotto da stress ossidativo. Chem. Biol. Interact. 160, 1-40.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vítek, L., Jirsa, M., Brodanová, M., Kaláb, M., Mareček, Z., Danzig, V., Novotný, L., e Kotal, P. (2002). Sindrome di Gilbert e cardiopatia ischemica: un effetto protettivo di elevati livelli di bilirubina. Atherosclerosis 160, 449-456.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vitek, L., e Ostrow, J. D. (2009). Chimica e metabolismo della bilirubina; aspetti dannosi e protettivi. Curr. Pharm. Des. 15, 2869-2883.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, H. D., Yamaya, M., Okinaga, S., Jia, Y. X., Kamanaka, M., Takahashi, H., Guo, L. Y., Ohrui, T., e Sasaki, H. (2002). La bilirubina migliora la fibrosi polmonare indotta dalla bleomicina nei ratti. Am. J. Respir. Crit. Care Med. 165, 406-411.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, X., Chowdhury, J. R., e Chowdhury, N. R. (2006a). Metabolismo della bilirubina: fisiologia applicata. Curr. Pediatr. 16, 70-74.
CrossRef Full Text
Wang, H., Lee, S. S., Dell’Agnello, C., Tchipashvili, V., d’Avila, J. C., Czismadia, E., Chin, B. Y., and Bach, F. H. (2006b). La bilirubina può indurre la tolleranza agli allotrapianti di isole. Endocrinologia 147, 762-768.
CrossRef Full Text
Wegiel, B., Gallo, D., Csizmadia, E., Roger, T., Kaczmarek, E., Harris, C., Zuckerbraun, B. S., e Otterbein, L. E. (2011). Biliverdina inibisce Toll-like receptor-4 (TLR4) espressione attraverso ossido nitrico-dipendente traslocazione nucleare di biliverdina reduttasi. Proc. Natl. Acad. Sci. U.S.A. 108, 18849-18854.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Yamashita, K., McDaid, J., Ollinger, R., Tsui, T. Y., Berberat, P. O., Usheva, A., Csizmadia, E., Smith, R. N., Soares, M. P., and Bach, F. H. (2004). La biliverdina, un prodotto naturale del catabolismo dell’eme, induce la tolleranza agli allotrapianti cardiaci. FASEB J. 18, 765-767.
Pubmed Abstract | Pubmed Full Text
Yoshida, T., e Kikuchi, G. (1974). Sequenza della reazione di catabolismo dell’eme catalizzata dal sistema microsomiale dell’eme ossigenasi. FEBS Lett. 48, 256-261.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Yoshida, T., Noguchi, M., e Kikuchi, G. (1980). Forma ossigenata del complesso dell’eme eme ossigenasi e requisito del secondo elettrone per iniziare la degradazione dell’eme dal complesso ossigenato. J. Biol. Chem. 255, 4418-4420.
Pubmed Abstract | Pubmed Full Text
Yoshino, S., Hamasaki, S., Ishida, S., Kataoka, T., Yoshikawa, A., Oketani, N., Saihara, K., Okui, H., Shinsato, T., Ichiki, H., Kubozono, T., Kuwahata, S., Fujita, S., Kanda, D., Nakazaki, M., Miyata, M., e Tei, C. (2011). Relazione tra concentrazione di bilirubina, funzione endoteliale coronarica e stress infiammatorio in pazienti in sovrappeso. J. Atheroscler. Thromb. 18, 403-412.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhou, H., Qian, H., Liu, J., Zhu, D., Ding, W., Pan, P., Jin, D., Wang, J. e Li, W. (2011). Protezione contro il danno polmonare da donatori cerebralmente morti con monossido di carbonio, biliverdina, o entrambi. J. Heart Lung Transplant. 30, 460-466.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhu, H., Wang, J., Jiang, H., Ma, Y., Pan, S., Reddy, S., and Sun, X. (2010). La bilirubina protegge gli innesti dalle lesioni non specifiche indotte dall’infiammazione nel trapianto intraportale sincenico di isole. Exp. Mol. Med. 42, 739-748.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text