Il tetracloruro di carbonio può essere espresso come CCl4, ed è composto da una molecola di carbonio e quattro molecole di cloruro. Il tetracloruro di carbonio non è polare. Perché il tetracloruro di carbonio non è polare? È apolare perché i momenti di dipolo della molecola sono uniformemente distanziati intorno all’atomo di carbonio centrale. Ciò significa che i loro effetti individuali si annullano e la molecola è neutra.
I quattro atomi di cloro sono posizionati simmetricamente ai quattro angoli di un tetraedro, e un singolo legame unisce ognuno di loro all’atomo di carbonio nel centro della molecola. Di conseguenza, CCl4 non ha un momento di dipolo netto positivo o negativo. Se un atomo diverso dal cloro fosse stato posizionato in qualsiasi altro punto della molecola, la molecola avrebbe avuto un momento di dipolo e il CCl4 sarebbe stato polare come risultato.
“Definiamo la chimica organica come la chimica dei composti di carbonio”. – August Kekule
Questa è la risposta rapida sulla polarità del tetracloruro di carbonio. Tuttavia, sarebbe utile parlare della polarità delle molecole in generale ed esaminare il tetracloruro di carbonio e le sue proprietà per capire perché è non polare in natura.
Che cosa significa per una molecola avere polarità?
Quando si sente il termine polare, probabilmente si pensa ai poli nord e sud della terra. Questi poli nord e sud si trovano alle estremità opposte della terra, in modo simile a come una batteria può avere un polo positivo e uno negativo. Anche le molecole e i legami tra gli atomi possono avere polarità. Una molecola è definita polare quando gli atomi che costituiscono la molecola sono disposti in modo da dare ad un’estremità della molecola una carica positiva e all’altra estremità della molecola una carica negativa.
Una molecola polare si crea quando un atomo che ha un alto livello di elettronegatività si combina o si lega con un atomo che ha un livello di elettronegatività più debole. La molecola risultante ha una regione con alta elettronegatività e una regione con minore elettronegatività o poli elettrici. Uno degli esempi più famosi di molecola polare è l’acqua, ed è grazie alla natura polare dell’acqua che serve come base per la vita sulla terra.
Al contrario, le molecole non polari mancano di poli elettrici, e gli elettroni al loro interno sono distribuiti in modo più uguale. Le molecole non polari mancano di una carica notevole alle due estremità della molecola. La maggior parte dei liquidi idrocarburici sono non polari in natura.
In sintesi, una molecola che ha dipoli che non si annullano a vicenda è polare, mentre le molecole non polari sono quelle in cui le cariche degli atomi si annullano a vicenda e non c’è carica ad una estremità della molecola o all’altra.
Esempi di molecole polari
Come già detto, l’acqua è una molecola polare. I legami che esistono tra gli atomi di ossigeno e gli atomi di idrogeno sono distribuiti in modo tale che entrambi i lati dell’atomo, entrambi i legami ossigeno-idrogeno, sono equamente distanziati. Il risultato è che il lato dell’ossigeno, o la parte superiore della molecola, ha una carica leggermente negativa mentre gli atomi di idrogeno, o la parte inferiore della molecola, ha una carica leggermente positiva.
L’etanolo è una molecola polare perché gli atomi di ossigeno che sono dentro la molecola hanno più elettronegatività degli altri atomi. Gli atomi di ossigeno attraggono più elettroni a causa del loro potenziale di elettronegatività più alto, e i gruppi di legame -OH nella molecola hanno complessivamente cariche negative, anche se la carica negativa è molto leggera.
“La vita esiste nell’universo solo perché l’atomo di carbonio possiede alcune proprietà eccezionali.” – James Jeans
ADVERTISEMENT
Altri esempi di molecole polari sono l’anidride solforosa (SO2), il solfuro di idrogeno (H2S) e l’ammoniaca (NH3).
Si badi che una molecola può essere composta da legami polari e tuttavia essere non polare. Un esempio è l’anidride carbonica, che ha quattro legami, ma i momenti di dipolo della molecola finiscono per neutralizzarsi a vicenda, quindi la molecola è nonpolare.
Esempi di molecole non polari

Esempi di molecole non polari includono azoto, metano, ozono e ossigeno. Queste sono molecole omonucleari o molecole composte da atomi di un solo elemento. Le molecole non polari che non sono omonucleari includono l’anidride carbonica, menzionata sopra e il metano. Anche il toluene e la benzina sono esempi di sostanze non polari. Come regola generale, i composti del carbonio sono non polari, anche se ci sono alcune eccezioni come il monossido di carbonio. Il monossido di carbonio è lineare in natura, che di solito renderebbe una molecola non polare, ma la differenza di elettronegatività tra l’ossigeno e la molecola di carbonio è abbastanza sostanziale che la molecola è polare. Gli alchini non si dissolvono in acqua e sono considerati molecole non polari. Anche i gas inerti o nobili sono classificati come molecole non polari perché i gas sono solo atomi singoli dei loro rispettivi elementi, come neon, elio, argon e krypton.
Prevedere la polarità di una molecola
Esaminare i valori di elettronegatività degli atomi in una molecola vi aiuterà a determinare se la molecola sarà probabilmente polare o non polare. Differenze significative tra i valori di elettronegatività implicano che gli elettroni sono equamente condivisi tra gli atomi della molecola. Poiché gli elettroni saranno più vicini ad un atomo che ad un altro, quella regione della molecola sarà polare, anche se per determinare la polarità dell’intera molecola tutti i legami devono essere presi in considerazione.
Il fattore decisivo nella polarità o non polarità di una molecola è la sua geometria. Se un’estremità della molecola ha una carica negativa mentre l’altra estremità della molecola ha una carica positiva, la molecola sarà polare. Se invece le cariche sono distribuite uniformemente e orbitano intorno a un atomo centrale, la molecola è probabilmente non polare. Potete usare questo per prevedere se una molecola sarà polare o non polare. Non tutte le molecole hanno un momento di dipolo, e questo può rendere la previsione della polarità di una molecola un po’ più difficile. Per esempio, le molecole che possono essere capovolte e specchiate attraverso un piano geometrico, non hanno momenti di dipolo perché i momenti di dipolo non possono comprendere più di un singolo punto.
Fatti sul tetracloruro di carbonio
Il tetracloruro di carbonio fu scoperto dal chimico francese Henri Victor Regnault a metà del 1800. Il prodotto chimico fu scoperto attraverso una combinazione di cloro e cloroformio. Nonostante ciò, il tetracloruro di carbonio è oggi derivato principalmente dal metano. La produzione di tetracloruro di carbonio funziona spesso utilizzando i sottoprodotti delle reazioni di clorazione per ricavare il composto. Questo include i sottoprodotti della creazione di cloroformio e diclorometano. Il tetracloruro di carbonio è abbastanza volatile in natura, ed emana un odore simile ai prodotti chimici per la pulizia a secco. Il tetracloruro di carbonio è anche solvente e quindi è utile nella dissoluzione di sostanze non polari come oli e grassi.
Il tetracloruro di carbonio ha molte applicazioni diverse ed è stato usato come agente di pulizia, come refrigerante e negli estintori. Il tetracloruro di carbonio è spesso usato nella creazione di lampade di lava, rendendo la cera più pesante.
“… La molecola di carbonio è rivestita di pensiero?” – Saul Bellow
A causa dell’impatto ambientale del tetracloruro di carbonio, la sua produzione è fortemente diminuita dagli anni 80. Il protocollo di Montréal ha limitato la produzione di clorofluorocarburi, e poiché il tetracloruro di carbonio è un ingrediente chiave nella creazione dei CFC, il tetracloruro di carbonio ha visto una forte diminuzione della produzione come risultato. Gli effetti negativi sulla salute del tetracloruro di carbonio hanno anche causato una diminuzione della sua produzione, e anche se una volta era ampiamente utilizzato come solvente, oggi è raramente usato per tali scopi.
Il tetracloruro di carbonio è estremamente tossico per il fegato, e altre sostanze dannose per il fegato sono spesso paragonate alla tossicità del tetracloruro di carbonio. Alte concentrazioni di tetracloruro di carbonio possono non solo danneggiare il fegato, ma anche i reni. L’esposizione prolungata al tetracloruro di carbonio può causare un coma o la morte. L’esposizione alla sostanza chimica potrebbe anche aumentare la possibilità di sviluppare il cancro.
Perché il tetracloruro di carbonio è polare?
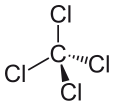
Dopo aver visto cosa rende una molecola polare, e aver visto alcuni esempi di molecole polari, ora possiamo capire meglio perché il tetracloruro di carbonio è una molecola non polare. La prima cosa da fare quando si cerca di determinare se una molecola è polare o non polare è calcolare i valori di elettronegatività degli atomi all’interno della molecola. La polarità del legame tra due atomi deve essere accertata, e tutti i legami devono essere considerati quando si cerca di determinare la polarità della molecola. Ma la differenza di valori di elettronegatività tra il cloruro e il carbonio, nel caso del tetracloruro di carbonio, non è l’unico fattore che deve essere considerato. Anche la forma della molecola deve essere considerata. Mentre ci sono dipoli presenti all’interno della molecola, la forma lineare del tetracloruro di carbonio significa che gli effetti dei diversi momenti di dipolo nella molecola si annullano a vicenda, e la molecola è neutra o non polare come risultato.