要旨
本研究の目的は,乳房軟部腫瘍全体の1%未満である乳房血管肉腫を少数の症例を中心に扱い,最終的にその経験を共有することである. 現在,標準治療である乳房温存療法(BCT)の帰結として,新しいタイプの血管肉腫が注目されている。 放射線誘発血管肉腫(RIAS)です。
ここでは、2013年から2018年にかけて当院で治療したRIAS6症例の統合治療と転帰の説明とともに、RIAS患者の特徴に関するレトロスペクティブな分析を報告します。
手術や放射線治療の結果としての乳房血管肉腫はほとんど記録されていないが,乳癌に対する放射線治療の合併症として記録されており,高い再発率と悪い転帰を伴う。
臨床的にも放射線学的にも組織学的にも難しいことに変わりないので,疑われる患者には高い疑い指数が必要である。 単純乳房切除術が第一の治療法であるが,放射線療法や化学療法を併用する研究が増えており,それぞれ成功の程度は様々であるが,注目されている。 局所制御を高めるために再照射が考慮され、化学療法はより進行した症例に考慮されます。
略語
RIAS: Radiation-Induced Angiosarcoma; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: 乳腺腫瘍。 磁気共鳴画像法;IMRT: Intensity-Modulated Radiotherapy
Keywords
乳房血管肉腫(AS)、放射線誘発血管肉腫(RIAS)、乳房切除術(RM)、放射線誘発腫瘍、アジュバント放射線治療。 強度変調放射線治療(IMRT)
はじめに
この論文では、少数の乳癌患者におけるRIASの診断、管理、および転帰について論じています。
非常にまれな血管腫瘍である乳房血管肉腫(AS)は、前駆症状がなく発生した場合は原発性、以前に照射した皮膚の部位に発生した場合は続発性に分けられ、この場合は乳房の放射線誘発血管肉腫(RIAS)として知られています。 しかし、血管肉腫の理想的な治療に関するエビデンスに基づくガイドラインはまだ存在しません。
補助放射線療法を伴う乳房温存手術を受けた患者において、RIASの推定発生率は0.05~0.3%と、乳癌の1%未満、全軟部肉腫の約3%を占めています。
RIASの発生率は、おそらく乳癌に対する補助放射線療法が広く採用された後に、これらの腫瘍の発生のための長い潜伏期間を反映して、増加しているように見える。
乳房のRIASの診断は、その良性の外観と、以前の放射線または他の疾患によって引き起こされる非特異的な皮膚変化との区別が難しいためにしばしば遅れている。 放射線学的所見もしばしば非特異的である。 RIASは通常、乳癌の放射線治療後10年目に発症するが、潜伏期間は6ヶ月から20年であり、著者によっては、おそらく過少報告されており、したがって真の発症率はもっと高いと考える者もいる。 乳がんの罹患率の増加に伴い、根治的乳房切除術に代わって、乳房温存手術後に放射線治療を行うことが標準的な治療法となってきています。 それに伴いRIASの発生率も上昇しており、乳がん1000例あたりの累積発生率は0.9-3.2例と推定されている 。 大規模な人口ベースのコホート研究において、乳癌の治療として放射線治療の既往がある場合、放射線治療を行わない対照群と比較して血管肉腫の発症リスクが26倍上昇することが示された。 RIAS患者の予後は依然として悪く、5年全生存率は27~48%である。 RIASは1920年代初頭に初めて報告されたにもかかわらず、その分子生物学的メカニズムはまだ議論の余地があり、したがって利用可能な標的療法はない。
現在、積極的な外科的切除が一般的な治療法として提唱されている。 アジュバント化学療法の有効性を証明するデータはない。
手術は、広範な切除または乳房切除の形で、局所病変の管理の主軸となるものである。 いくつかの研究では,R0マージンと生存率の改善との関連を報告しているが,腫瘍の大きさなどの他の生物学的因子と独立していることは証明されていない。 ネオアジュバント化学療法が血管肉腫の治療成績を改善する可能性があるといういくつかの証拠があるが、その希少性から、我々の知識は症例報告や小規模なレトロスペクティブケースシリーズに限られている …
当院で5年間治療したRIAS患者を特徴づけるために、マンモグラフィー、超音波、磁気共鳴画像(MRI)の診断への有用性を分析するレトロスペクティブ研究を実施した。
材料と方法
我々のケースシリーズは、2013年から2018年の間に、乳癌の放射線治療後に発症した組織学的に証明された乳房の血管肉腫の患者に関して、集学的アプローチによる治療戦略を分析する。
患児、放射線誘発乳房血管肉腫女性6名は、カターニアの大学病院、当機関の癌登録の前述の期間の包括的検索により同定された。 平均年齢は70歳で、範囲は 59-79歳であった。 患者は過去に様々な施設で診断・治療管理を受けたため、すべての情報が得られているわけではない。 患者さんの特徴とRIAS診断後に行われた治療法について表1に示す。 全例が診断時に乳房温存療法を受け,術後補助放射線療法は従来の3次元コンフォーマル・ラジオセラピーで総線量50Gy,1日分画2Gy,腫瘍床ブースト10Gyを併用または非併用で施行された。 腫瘍は3人が右側、他の3人が左側であった。 術後補助療法として、6例中5例は施設のガイドラインに従ってアントラサイクリン系の全身化学療法を受け、全例にタモキシフェン/アロマターゼ阻害剤の補助ホルモン療法を行った。 診断時にHER2陽性であった患者はいなかった。
追跡期間中、中央値7,6年(範囲:5~11年)後に、同側乳房血管肉腫の診断が行われた:発症時に患者が最も頻繁に示した徴候は、照射野に位置する赤紫色の皮膚結節で、成長速度は数週間から4~6ヶ月と中程度に変化していた。 全例に二次性血管肉腫の組織学的確認がなされ、全例に根治的乳房切除術が施行された。 RIASの診断には、CahanとArlenの基準:前回の照射野に発生した肉腫、放射線治療と肉腫の発生の間に少なくとも3年の潜伏期間、二次性肉腫と原発性新生物の組織学的区別がある、が用いられた。 6名全員がRIASの臨床的疑いを確認するために、マンモグラフィー、超音波、MR(4/6名)による完全な放射線検査を受けたが、予後を左右する特徴は確認されなかった。 放射線シグネチャー」の具体的な特徴を特定しようとする科学文献の関心が高まっているが、まだ統合されたデータは得られていない。 我々のケースシリーズで取り上げた6人の患者のうち3人は、MYCの発現を評価するための免疫組織化学的研究の対象であり、そのような患者では高い発現が確認されていた。 表1は、腫瘍の組織学的特徴も示している。 RIASの診断日は、組織学的診断がなされた日とした。 潜伏期は、最初の放射線照射からRIAS診断日までの期間と定義した。 RIAS診断時に肺に転移があったのは1例のみで、他の5例は乳腺のみであった。
表1:患者の特徴と治療方法。 表1を見る
当院で手術を受けるすべての患者さんは、術前の段階で肉腫集学的会議にて検討されました。 術前評価により、1回の血行再建または遊離筋皮弁による形成外科的再建を伴う、または伴わない手術で2cm以上の陰性縁が得られると判断された患者は、切除可能な疾患と分類された。 もし、希望する陰性のマージンが、大きな皮膚移植による広範な再表面化など、より広範な再建を必要とする場合、その患者は切除不能の疾患と分類されるであろう。
急速に進行する病変では、2-3週間の間に病変量が増加し、乳房切除単独またはペディキュアフラップとの併用に適した状態からより広範囲な再建を必要とする場合、腫瘍学的に切除不能と判定した。
術前生検はASの存在を確認し他の疾患を除くために行った。
マクロ的に完全切除は術者によって考えられた。 組織学的には,切除断端が周方向に1cm以上あればR0(顕微鏡的に陰性),腫瘍が切除断端に及ぶか1cm未満であればR1(顕微鏡的に陽性)に分類された。
4人の患者が即時再照射に採用されたが,1人は13カ月後に頭頂部の再発が起こったため治療され(彼女は即時再照射を拒否した),最後の患者は前回の治療で心臓の線量限界を達成したため,再照射から除外された。 アジュバント化学療法の投与は、それまでに受けた治療と患者のパフォーマンス状態に関する利用可能なデータに基づいて、ケースバイケースで決定された。 1例はエピルビシン-イホスファミドの化学療法を4サイクル、1例はエピルビシン単独で6サイクル受け、3例は医学的理由(年齢、併存疾患、アントラサイクリンの許容量に既に達している)で除外された。 1例は、肺転移のためパクリタキセルを週1回12サイクル投与された。
放射線治療は、前回の照射で健康な組織から受けた線量とアントラサイクリンの前投与を考慮して行われた。 このような理由から,私たちは施設の手順に従い,ステップアンドシュート法を用いた強度変調放射線治療(IMRT,図1参照)による再照射を選択した。 使用した放射線量と分割方法は様々で、2例は50Gyの通常分割、2例は40Gy(前回の照射からの経過時間が短く、新生物が左胸にあったため)、1例は35Gyで週1回5Gy分割(臨床コンプライアンスが低下したため)であった。
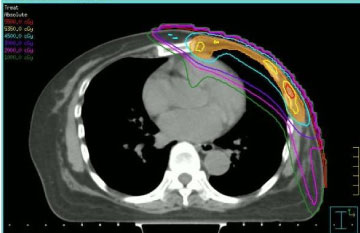 図1: ステップアンドショット強度変調線量分布の横断面CT画像。 図1
図1: ステップアンドショット強度変調線量分布の横断面CT画像。 図1
結果
同じ手術チームによって行われた根治的乳房切除術を受けた患者において、断端陽性は報告されていない。
根治的乳房切除術後、患者は化学療法と放射線療法の両方を、中断することなく計画通り治療を受けた。 追跡期間中央値22年(範囲:1.5~4年)において,3名が生存しており,再発や疾患の進行は認められていない。 診断時に肺転移があった1名の患者さんは、現在も積極的に腫瘍学的治療を受けています。 1名の患者は肺転移と骨転移を起こしたが、作品投稿時点ではまだ生存している。 最後の2名は肺転移を起こし、うち1名は局所再発を伴い、8-10ヵ月後に死亡した(病態と受けた治療との関連における患者の特徴の分布は表1に記載されている)。 全体として、RIASの診断時に全身疾患がなかった5名の患者の無病生存期間は14ヶ月であり、診断時に転移があった患者の無増悪生存期間は12ヶ月であった。
予想されるように,文献上では,本シリーズの症例と比較して,外科的治療に適さない局所進行病変を呈した患者において,より悪い生存成績が注目された。 これらのことから,RIAS患者における早期診断の重要性が浮き彫りになった。 血管肉腫は、しばしば紫色や赤色の皮膚変化で漠然と現れ、打撲や良性の皮膚変化と容易に間違われるため、調査や診断が遅れることがある。 早期発見と迅速な紹介は、切除不能な疾患を示す患者の数を減らし、局所および遠隔の疾患管理を改善する可能性がある。
Discussion
放射線誘発腫瘍は通常、線量が均一でない照射野の周囲または端に生じ、細胞破壊を引き起こすのに必要な値よりも低くなる場合があり、発癌プロセスにつながる突然変異を引き起こす可能性がある。 電離放射線の影響として、生体内で引き起こされる化学的および生化学的修飾は、細胞の機能的および形態的変化を生じさせ、生物学的損傷を引き起こす。 染色体修飾を受けた細胞が正常な細胞制御から外れると、発癌が起こる可能性がある。
乳癌の治療で放射線療法を受けている患者が腫瘍を発生する確率は非常に低く、適応があれば放射線療法の使用を制限することはできない。 50Gy以上の放射線量は細胞死を誘発し、それ以下の線量(
軟部肉腫の発症と乳癌に対処するために行われた放射線治療との相関を示唆する研究が数多くある。 放射線治療は軟部肉腫の発症リスクを高め、特に血管肉腫の発症リスクを高める。 RIASは乳腺腫瘍の約1%未満である。 放射線誘発血管肉腫には多くの臨床症状がある。 は、乳房の放射線治療後に見られる一般的な光線性変化とほとんど区別がつかない無症状の皮膚変化を示すことが多い。 触知可能な腫脹、血腫に類似した赤紫色の部位を示すことが多い。 血管肉腫は、血管腫や非定型毛細血管拡張症などの良性疾患と混同されることがあります。 また、紫色の丘疹や紅斑性結節が生じることがあります。
あらゆる治療努力にもかかわらず、5年生存率は27%から62.8%と幅がある(2-3)。 RIASは、典型的には乳癌の放射線治療後10年で発症するが、潜伏期間は6ヶ月から20年までと幅がある。 放射線誘発血管肉腫は、自然発生血管肉腫と区別がつかないが、いくつかの違いを評価することができる。 Laeらは、RASB32標本と散発性血管肉腫15標本で染色体8q24.21上のc-myc増幅を比較した 。
我々のシリーズでは、患者は非特異的な徴候を経験したが、大半の症例で診断は速やかになされた。 潜伏期間は文献で報告されているものと同様であり,中央値は76年であった。 RIASの大部分(96%)で、腫瘍床または手術痕に沿った局所再発が検出されると報告されている。 これはおそらく、手術断端が陰性であっても、術後にRIASが多巣性に増殖したり、悪性組織が残存したりするためであろう。 肺や肝臓への転移が最も多く、局所再発と同時または直後に存在することがある 。 Abbottらは2017年時点で発表されたRIASの全症例をレトロスペクティブにレビューし、データをまとめました . その結果、局所再発率は59%で、再発までの期間の中央値は6か月(範囲:1~78か月)であったとのことです。 また、転移性疾患は通常少なくとも1回の局所再発に先行し、最も一般的な部位は肺、対側乳房、骨格であることも明らかにした。 さらに、42例の組織学的検討から、低分化型RIASは転移のリスクが高いが、高分化型腫瘍は遠隔転移よりもむしろ局所再発のリスクが高いことが示唆された。
放射線誘発性肉腫は,稀ではあるが,非常に侵攻性の高い新生物である。 治療ガイドラインがなく,予後が悪く,5年生存率に大きな差があるため,その管理は議論のあるところであるが,以前に報告したとおりである。 しかし、積極的な外科的切除が一般的に推奨されています。
手術は、乳房切除術の形で、形成再建を伴うか伴わないかを問わず、局所病変を呈する患者さんに選択される治療法です。 治療中の患者さんでは、80%以上の患者さんで切除断端が顕微鏡的に完全(R0)であることが可能です。 RIASは通常、多巣性病変として現れます。 この病態はマイクロサテライトを形成する傾向があるため、局所制御を得ることが困難な一因となっている可能性がある。
病理学的完全切除の重要性は文献で強調されているが,推奨切除距離に関する標準的なガイドラインは公表されていない。 今回のシリーズでは,局所再発を起こした者はそうでない者に比べて,より近い距離で切除することが判明した。 しかし、このシリーズでは、マージンの状態が独立して腫瘍学的転帰の予後を決定するものではないことが判明した。 このことは、より大きなマージンを獲得できるかどうかは、大きさなど、転帰を決定する他の生物学的腫瘍因子に依存することを示唆するものである。 RIASでは腫瘍生物学が主に転帰に関与していると考えられるが、最初の手術は巨視的なクリアランスを目指すべきであるが、より大きな陰性縁を達成することが必ずしも患者の転帰の改善と一致しないことに注意すべきである<3729><6232> ネオアジュバント、アジュバントにかかわらず、化学療法と放射線療法に焦点を当てた研究が増加しているが、その役割はまだ明確ではない。 アジュバント化学療法の有効性を証明するデータは不足しているが,最近のデータでは放射線療法が再発予防に有用であることが示唆されている。 Johnstoneらによると、術後の補助放射線療法は、より良い局所制御を可能にする。 胸壁の治療におけるIMRTの役割は現在評価中である。なぜなら、IMRTは危険部位(OARs)への照射を減らすことにより、放射線毒性の発生率を減らすことができるからである。 胸壁と標的へのIMRT計画は、従来の治療と比較して、最大線量を下げ、最小線量を上げることができ、その結果、標的体積の適合性と均一性が良くなると著者らは線量測定比較研究において報告している …
化学療法の役割と効果は、利用可能なデータが小規模なサンプル群から得られるため確立されておらず、明確な結論を導き出すことはできませんが、おそらく悪性度が高いG3や再発を伴う患者には、ネオまたはアジュバント化学療法が最も有効でしょう。
すべての部位の放射線誘発肉腫患者の大規模なレトロスペクティブシリーズでは、ネオ/アジュバント化学療法の使用は、全身再発率や生存率の改善とは関連しないものの、局所病勢コントロールの改善と関連していることも明らかにされた。 補助化学療法は、手術と放射線治療を受けた高リスクの軟部肉腫の局所制御または全生存研究において有益であることは明らかにされなかった。 そのため、RIASにおいてネオ/アジュバント化学療法が生存に有益であることを示す証拠は限られているが、局所進行病変を有する患者の手術前の導入療法として確かに有用であり、さらに患者に効果的な疾患緩和を提供できる可能性がある。
我々のシリーズでは、この新生物の局所再発の高い傾向の結果として、上記の線量測定の問題のために1人を除いて、すべての患者に2回目の照射を提案することにした。 1名の患者は即時再照射を拒否し、治療は再発時に実施された。 過去に使用された照射量に対するサンプルの不均一性、1症例の臨床コンプライアンス不良、そして何よりも文献やガイドラインの明確な指示の欠如により、全ての患者に対して均質な放射線治療を計画することは不可能であった。 いずれにせよ、適切な線量分布と周辺健康組織、特に肺実質と心臓への被曝を低減するために、強度変調方式による治療を行うことに決定した。
結論
乳癌の治療における放射線療法は、その後の肉腫のリスク上昇と関連するが、リスクの割合は非常に低い。
RIASは、治療選択肢が限られ、局所および全身再発の率が高い稀で侵攻性の軟組織病巣である。
アジュバント放射線治療後の慎重な観察が必要である。 標準的な治療法は、単純乳房切除術による手術と補助放射線療法である。
血管肉腫は放射線治療を受けた症例で有意に多く、特に照射野内または照射野に隣接して発生します。 放射線治療を受けた乳癌患者のその後の肉腫のリスクのわずかな差は,放射線治療の有益性に取って代わるものではない。
しかし,我々のシリーズは最終結論を出すには少なすぎ,これは研究の限界である。 病態をより適切に分類し、より正確な集学的管理を可能にするためには、より多くの症例研究を通じて、さらなる評価が必要である」
利益相反
著者はいずれも開示すべき利益相反はない。
資金源
なし。
倫理的承認
カターニア大学倫理委員会より承認された。
インフォームドコンセント
この症例報告および添付画像の公表について、患者から書面でのインフォームドコンセントを得ている。 3729>
Author Contributions
Trovato Agata.Ph.D.は、本誌の編集長が希望すれば、書面による同意のコピーを閲覧できる。 Reviewing and editing the article.
Registration of Research Studies
なし.
Disclosure
いずれの著者も開示するものはない.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Primary and secondary angiosarcoma of the breast.All Rights Reserved.「乳房の原発性血管肉腫と二次性血管肉腫」(邦題:乳房の原発性血管肉腫). Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Long-term outcomes in patients with radiation-associated angiosarcomas of the breast after surgery and radiotherapy for breast cancer.(乳癌の手術と放射線療法に伴う放射線関連血管肉腫患者の長期予後).Gland Surg 3: 28-34. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma: a large-scale single-institution review.乳癌に対する放射線治療後の放射線誘発肉腫。 Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Cutaneous radiation-associated angiosarcoma of the breast: poor prognosis in a rare secondary malignancy.乳癌に対する放射線治療後に発症した血管肉腫。 Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Clinical management of secondary angiosarcoma after breast conservation therapy.An Surg Oncol 19: 3801-3808. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Radiation-induced sarcoma of the breast: a systematic review.「乳房の放射線誘発肉腫:系統的レビュー」。 Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Increased risk of soft tissue sarcoma after radiotherapy in women with breast carcinoma.Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Inc. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Radiation-associated angiosarcoma after breast cancer: high recurrence rate and poor survival despite surgical treatment with R0 resection.Heuang JM, Styring E, Verstappen F, Rydholm A, et al.(2012)放射線関連乳癌後の血管肉腫:高い再発率と生存率は外科的治療にもかかわらず。 Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Surgical management of radiation-induced angiosarcoma after breast conservation therapy.「乳房保存療法後の放射線誘発血管肉腫の外科的管理」(共著). Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Localised angiosarcomas: the identification of prognostic factors and analysis of treatment impact.「局所血管肉腫:予後予測因子の同定と治療効果の分析」(共著). フランス肉腫グループ(GSF/GETO)からのレトロスペクティブ分析 Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Thalidomide combined with neoadjuvant chemotherapy in angiosarcoma of the breast with complete pathologic response: case report and review of literature.A Revolution: A Retrospective analysis from the French Carcoma Group (GSF/COS) Eur J Cancer 49: 369-376.Allowardo-A, F. M. C (2013) 血管肉腫の病理学的完全奏効におけるサリドマイドのネオアジュバン化学療法併用:症例報告および文献レビュー。 Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Neoadjuvant chemotherapy for primary cutaneous/soft tissue angiosarcoma: determining tumor behavior prior to surgical resection.「皮膚軟部腫瘍の術後化学療法」(英語). J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) 新規原発乳癌の女性における対側リンパ節転移。 Systemic desease or locoregional diffusion? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement.の項参照。 コンセンサスに基づく手術症例報告ガイドライン。 Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) 乳癌の放射線治療後の二次肉腫:持続リスクと不良生存率. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) c-myc amplificationは放射線照射後の乳腺原発肉腫と確実に識別できるか? Cancer Radiother 19: 168-174.
- AbbottR、Palmieri C (2008) 乳癌の手術と放射線治療後の乳房の血管肉腫. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarcoma after breast-conserving therapy.の項参照。 Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast: Local-regional control with post-operative radiotherapy.On Therapy of the breast. Int J Radiat Oncol Bi Phys 27: 671-675.
- YangB、Wei XD、Zhao YT、Ma CM (2014) 修正根本乳房切除術後の乳癌に対する胸壁と鎖骨上領域の統合IMRT治療の線量評価(Dosimetric evaluation of integrated IMRT treatment for breast wall and supraclavicular region after modified radical mastectomy). Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) A systematic meta-analysis of randomized controlled trials for adjuvant chemotherapy for localized resectable soft-tissue sarcoma.Med Dosim 39: 185-189.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstim for resected soft-tissue sarcoma (EORTC 62931): a multicentre randomised controlled trial.(2012年)切除した柔らかい肉腫に対するドキソルビシン、イホスファミド、レノグラスチムの補助化学療法:多施設無作為化比較試験。 Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Breast tuberculosis cases rising in Sicily.Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Role, timing and technique of radiotherapy in pediatric pleuropulmonary synovial sarcoma.小児胸膜肺腫瘍における放射線治療の役割と時期、技術. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Intensity-modulated radiotherapy for relapsed malignant pleural mesothelioma.「再発胸膜中皮腫の放射線治療における強度変調放射線治療」. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) カタニア大学における悪性胸膜中皮腫に対する強度変調放射線治療の単一施設経験.Single institution experience of intensity-modulated radiotherapy for malignant pleural mesothelioma at University of Catania.The University of Catania. Future Oncol 14: 17-21.
Medical Dosim 39: 185-189.Med Dosim 39: 185-189. Cancer 113: 573-581.
Citation
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al.(2019)乳房温存療法後の2次乳腺血管肉腫の単一施設の研究経験: 集学的な管理。 Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114
.