Apoptosis

アポトーシス(プログラム細胞死)は、生物が選択的に細胞を排除する高度に制御された方法である。 このプロセスは、胚発生、生物のサイズの維持、損傷した細胞や異常な細胞の除去において重要な役割を担っています。 アポトーシスの重要性は、異常なアポトーシスに起因する多くの疾患によって強調される。 アポトーシスの異常は、様々な癌、神経疾患、心血管疾患、自己免疫疾患と関連している。
我々は一般的に、DNA損傷などの内部刺激に反応してミトコンドリアが仲介する内部経路と、細胞外の死の受容体(例えば、FasLとFasLG受容体の結合)が仲介する外部経路の2種類のアポトーシスから区別している(図1)。 どちらの経路もイニシエーターカスパーゼと呼ばれるプロテアーゼに依存し、エフェクターカスパーゼのカスケードを活性化することでアポトーシスに至る。 内在性経路と外来性経路のクロストークはBH-3相互作用ドメインデスアゴニスト(Bid)を介して行われる。
内在性経路(図1)はBcl-2ホモロジー蛋白によって開始される。 古典的なアポトーシス経路では、Bcl-2タンパク質であるBaxとBakが、DNA損傷や酸化ストレスなどの内部刺激に応答して活性化される。 この2つのタンパク質は、その後Bidと相互作用して、ミトコンドリア外膜に挿入される。 その結果、アポトーシスにおける帰結点とされるミトコンドリア外膜の透過化(MOMP)が起こる。 MOMPは、シトクロムcなどのアポトーシス促進因子を細胞質内に放出させる。 細胞質内のシトクロムcはAPAF-1およびdATPと結合してプロカスペース9をリクルートし、アポプトソームを形成する。 アポトーソームが形成されると、プロカスパース9が切断され、活性型プロテアーゼであるカスパーゼ9が形成される。 カスパーゼ9はイニシエーターカスパーゼとして、カスパーゼ-3や-7などの下流のエフェクターカスパーゼをタンパク質分解によって活性化し、アポトーシスに至るカスパーゼカスケードの引き金となる。 アポトーシスの経路
外部経路はリガンドがデスレセプターに結合することで開始される。 リガンドが結合すると、デスレセプターはオリゴマー化し、FADDのようなアダプタータンパク質をリクルートする。 これにより、活性型カスパーゼであるプロカスパーゼ8が動員され、death-inducing signal complex (DISC)が形成される。 プロカスパーゼ-8はオリゴマー化し、活性型カスパーゼ-8に切断され、さらにエフェクターカスパーゼ-3が切断され活性化される。 カスパーゼ-3は、他のカスパーゼを活性化し、アポトーシスを引き起こす。
アポトーシスは非プログラム化細胞死/ネクローシスとは異なるものである。 ネクローシスは外部からのダメージによって開始される無秩序なプロセスであり、いくつかの重要な点においてアポトーシスとは異なっている(表1)。 しかし、アポトーシスとネクローシスについての理解が深まり、ネクロプトーシスのような新しい細胞死のメカニズムが明らかになるにつれ、アポトーシスとネクローシスの境界はよりあいまいになってきている。 しかし、表1に示すような特徴は、依然として有用な指針となっている
Table 1. アポトーシスとネクローシスの特徴
| アポトーシス | ネクローシス |
| 細胞が縮小 | 細胞が膨張 |
| 食細胞・マクロファージが細胞を呑込む | Cell debris is released |
| プロセスは非炎症性 | プロセスは炎症性 |
アポトーシスを分析する際には、このプロセスを段階別に分けることが有用である。
- アポトーシスが開始され、シグナル伝達カスケードが活性化される
- 細胞は収縮し、丸くなる。 カスパーゼを介する
- 器官の形が変わり、膜がブリープし始める
- 核凝縮が始まる
- DNA断片化が見られる
- アポトーシス体ができる
- アポトーシス体が貪食される
これらのアポトー シスの段階を示すものである。 は、既知のアポトーシスのメディエーターとともに、アポトーシスの識別に使用することができる。 カスパーゼ活性アッセイはアポトーシス開始の優れた指標であり、一方、DNA断片化アッセイは、不可逆的にプログラムされた細胞死に至るアポトーシス後期の細胞を同定するために使用することができる。
ライブセルタイムラプスイメージングは、リアルタイムでアポトーシスを追跡するために用いることができ、特に膜のブリービングを特定するのに有用である。 組織については、透過型電子顕微鏡を使用して、アポトーシスの段階に伴う多くの構造変化を確認することができる。 また、組織をヘマトキシリン・エオジンで染色し、アポトーシス細胞を取り込んだマクロファージを可視化することもできる。 アクリジンオレンジ(AO)も、アポトーシス細胞の可視化によく用いられる色素である。 この一般的な生存率および増殖色素は、酸性ライソゾーム環境では発光スペクトルがオレンジ色に変化するため、アポトーシスの評価に使用することができる。この色素は、飲み込まれたアポトーシス細胞の識別に有用である。 DAPI、Hoechst、ヨウ化プロピジウム(PI)、7-AADなどのDNA結合色素は、核の白化を可視化するために使用され、細胞の縮小はフローサイトメーターで前方散乱(FSC)の減少として、または光学顕微鏡を使って視覚的に検出できる。 ミトコンドリア膜電位の変化
膜電位の変化は、細胞が帰還不能点を過ぎて現在アポトーシスに向かっていることを示唆している。 ミトコンドリア膜電位の崩壊は、電位差色素を用いたフローサイトメトリーや免疫蛍光法で検出することができる。
テトラメチルローダミンエチルエステル(TMRE)、テトラメチルローダミンメチルエステル(TMRM)、JC-1はよく用いられる電位差蛍光色素である。 TMRE と TMRM は非アポトーシス細胞のミトコンドリア内で凝集し、明るいオレンジ色または赤色に蛍光を発する。 ミトコンドリア膜電位が低下したアポトーシス細胞では、これらの色素は単量体の形で細胞質全体に存在し、赤色の蛍光を減少させて示す。 この色素は、fluorophore labeled inhibitor of caspase assay (FLICA) (次章参照) と組み合わせて、ミトコンドリア膜電位の破壊とカスパーゼ活性化という二つの特徴に基づいてアポトーシス細胞を識別することができる (Figure 2).
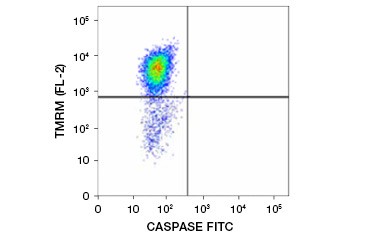
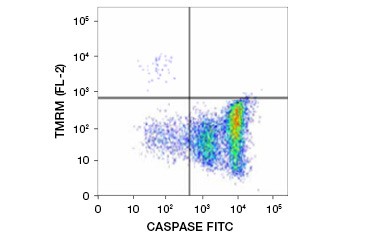
図2. フローサイトメトリーによるミトコンドリア膜電位低下とカスパーゼ活性化の検出。 FAM-FLICA Polycaspase Kitで測定したTMRMからのオレンジ蛍光の消失とカスパーゼ活性化を示す緑色蛍光の増加が同時に起こり、アポトーシス細胞(右下4分の1)を示している。 JC-1を用いて可視化したミトコンドリア膜電位の破壊。 Jurkat細胞はMitoPT JC-1で染色した。 非アポトーシス細胞(上)は赤く染色されたミトコンドリアを示し、アポトーシスの様々な段階にある細胞は緑の細胞質蛍光を示す。
JC-1 も非アポトーシス細胞のミトコンドリア内に凝集し、アポトーシス細胞では細胞全体に拡散していることが確認された。 TMREやTMRMのように蛍光が減少するのではなく、JC-1は赤から緑に変色する。 これにより、非アポトーシスの赤色蛍光細胞とアポトーシスの緑色蛍光細胞を容易に識別することができる(図3)。 これらのアッセイは、蛍光顕微鏡、フローサイトメーター、あるいは適切な装備のマイクロプレートリーダーを用いて読み取ることができる。 カスパーゼ活性化
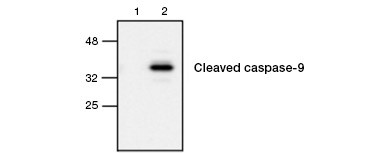
Fig.4. 活性化したカスパーゼ9はウェスタンブロットで検出される。 未処理(レーン1)およびエトポシド処理(レーン2)細胞をRabbit anti-caspase-9 (active) 抗体でプローブしたウエスタンブロット解析。 活性化されたカスパーゼ9は、エトポシドによるアポトーシス誘導時にのみ検出される。
カスケースの活性化は、アポトーシスの特徴である。 一般にアポトーシスの鍵となるカスパーゼはイニシエーターカスパーゼ3、6、7とエフェクターカスパーゼ2、8、9、10が測定される。 カスパーゼの活性化は、プロカスパーゼが切断されてサイズが小さくなることで確認するか、切断された活性化型のみと相互作用する抗体を用いて確認することができる(図4)。 どちらのアプローチもウェスタンブロッティングで読み取ることができるが、後者のアプローチは、蛍光色素やビオチンと結合した抗体を選択することにより、蛍光染色や免疫組織染色アッセイに適合させることも可能である。 これらのアッセイは固定細胞、非固定細胞の両方に対応している。
ひとつ留意すべきは、イニシエーターカスパーゼはアポトーシスのシグナル伝達経路のはるか上流にあり、その活性化が必ずしもアポトーシスを引き起こすとは限らないということである。 そのため、イニシエーターカスパーゼのアッセイとエフェクターカスパーゼのアッセイ、さらに言えばMOMPのようなpoint of no returnの下流のイベントのプローブと組み合わせることが賢明である。
もう一つのカスパーゼ活性化アッセイはFLICAアッセイのような蛍光標識したカスパーぜイトの基質である。 FLICA Assaysは活性化したカスパーゼと共有結合し、不可逆的に結合する。結合しなかった阻害剤は細胞外に拡散し、洗浄で除去することができる。 これらの阻害剤は、赤色または緑色の色素と結合しているものがあります。 カスパーゼ活性が高いアポトーシス細胞は、カスパーゼ活性が低い細胞よりも蛍光強度が高いため、カスパーゼ活性の定量的な指標として使用することができます。 FLICAアッセイは生細胞、組織切片、薄い凍結切片に対応しているが、固定細胞やパラフィン包埋組織には対応していない。蛍光顕微鏡、フローサイトメトリー(図2)、マイクロプレートリーダーを用いて、蛍光強度を定量することにより、読み取ることができる。 Annexin-Vコンジュゲートは、アポトーシス細胞と壊死細胞および生存細胞を区別するために使用することができる。 アネキシンV:FITCで染色したラモス細胞とヨウ化プロピジウムを比較したドットプロット。 ホスファチジルセリンの外添
アポトーシスの重要な特徴は、健康な細胞の内膜にのみ存在するリン脂質であるホスファチジルセリン(PS)の外添で、初期段階でも検出することができる。 アネキシンVはホスファチジルセリンと結合するので、アネキシンVコンジュゲートを用いてアポトーシスを評価することができる。 これらのアッセイは、蛍光標識したアネキシン-Vを用いたフローサイトメトリーで行われるのが一般的である。 この色素とPIなどの生存率色素を組み合わせることで、アポトーシス細胞とネクローシス細胞を区別することができる。 これらの2色フローサイトメトリー実験では、3つの集団が容易に区別できる:アネキシン-V/PI二重陰性の生存細胞、アネキシン-V陽性/PI陰性のアポトーシス細胞、アネキシン-V/PI二重陽性の二次壊死細胞
(Figure 5).
MOMP 後、細胞がアポトーシスへ向かうまではホスファチジルセリンの外部化は動的かつ可逆的なプロセスである。 アネキシン-Vコンジュゲートを用いると、アポトーシスの初期の可逆的な段階と、細胞が死に至るアポトーシスの後期段階を区別することは不可能である。 Polarity-sensitive indicator of viability and apoptosis (pSIVA) プローブは、PS と可逆的に結合するバイオセンサーであるため、PS が外膜から内膜に反転するときにオンとオフを繰り返す(図6)。 pSIVAアッセイのもう一つの利点は、アネキシン-Vコンジュゲートとは異なり、pSIVAプローブは洗浄ステップなしで細胞に直接添加できることである。 このアッセイは、ライブセルイメージングを含む免疫細胞化学および免疫蛍光顕微鏡を用いて読み取ることができ、異なる実験処理に対するアポトーシス率の違いをリアルタイムで容易に比較することができる。 アポトーシスをリアルタイムでモニターしているため、このアッセイは固定細胞には対応していません。
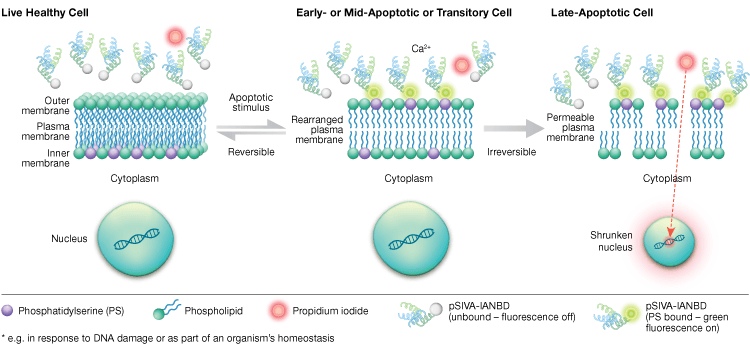
Fig.6. pSIVAアッセイは、ホスファチジルセリンの外部化と内部化をリアルタイムでモニターすることにより、生細胞、初期アポトーシス細胞、後期アポトーシス細胞を区別することができる。
5. DNA断片化
DNA断片化はアポトーシスの後期段階の一つであり、一般的にはアガロース電気泳動によるDNAラダーの検出やTerminal deoxynucleotidyl transferase dUTP nick end labeling(TUNEL)法により解析される。
アポトーシスの特徴として、カスパー活性化酵素によりDNAを〜180 bp断片に断片化させることが挙げられる。 アガロースゲルで抽出したゲノムDNAは、ネクローシスなどの他のメカニズムで死ぬ細胞では見られない特徴的なDNAラダーを示す。
TUNEL法は、カスパーゼ活性化エンドヌクレアーゼによるオリゴヌクレオソーム生成を検出する別の方法である。 DNAが切断されると、3′-OH基(ヒドロキシル基)が生成されます。 TUNELアッセイは、Terminal deoxynucleotidyl transferase (TdT) という酵素を使って、この3′-OH基にBrdUを付加させる。 取り込まれたBrdUは、ビオチンまたは蛍光色素で標識された抗BrdU抗体を用いて検出することができる。 このアッセイは、フローサイトメトリー、免疫組織化学、免疫蛍光法と互換性があり、BrdUの代わりに-TdRを使用することにより、放射性ラベル読み出しに変換することができる。 BrdUの取り込み後、染色前に細胞を固定する必要がある。
DNA fragmentationもsub-G1 assayを用いたフローサイトメトリーで測定することができる。 アポトーシス中に生成された小さな、約 180 bp の DNA 断片は細胞から漏れ出し、アポトーシス細胞の総 DNA 量を減少させる。 DNAをPIで染色すると、PIヒストグラムのsub-G1ピークでhypodiploidアポトーシス細胞がカウントされる。 Multiplex apoptosis marker panel
最後に、多くの業者が細胞集団の多重免疫測定分析用のパネルを販売している。 アポトーシスを検出するための方法にかかわらず、実験条件や細胞の種類によってアッセイの性能が変わることがあるため、適切なコントロールが含まれていなければならない。 常にポジティブコントロールとネガティブコントロールを含めること。 溶媒の影響を考慮したビヒクル処理コントロール、免疫蛍光実験における自家蛍光などの要因をコントロールするアプリケーション固有のコントロール、ウェスタンブロッティングのローディングコントロールも含めること。 アポトーシスの特徴を検出するためのアッセイのまとめ。
| アポトーシス期 | 検出可能な試薬 | 応用 | ||
| PS flipping | annexin-V conjugates, pSIVAプローブ | フローサイトメトリー、顕微鏡検査 | ||
| シグナルカスケードを開始 | FLICA, カスパーゼ抗体 | フローサイトメトリー、顕微鏡、ウェスタンブロット | ||
| MOMP | TMRM, TMRE, JC-1 | フローサイトメトリー、顕微鏡、マイクロプレートリーダー | ||
| Cell shrinkage | Flow Cytemetry.jp | Flow cytometry.jp | Flow cytometry.jp | Flow cytometry, 顕微鏡検査 |
| Membrane blebbing | hematoxylin + eosin | Microscopy | ||
| Nuclear condensation | DAPI, Hoechst, PI, 7-AAD | Microscopy | ||
| DNA fragmentation | TUNEL, サブG1アッセイ、DNAラダリング | アガロースゲル、フローサイトメトリー、顕微鏡検査 | ||
| アポトーシス体の貪食 | アクリジンオレンジ、ヘマトキシリン+エオシン | フローサイトメトリー、光・電子顕微鏡 |