INTRODUCTION
診断・手術技術や術後ケアの進歩にもかかわらず、急性A型大動脈解離は依然として短期・長期的に高い罹患率と死亡率と関連しています。 現在の病院での死亡率は15~35%、5年生存率は65~75%と推定されている1-7
これらの患者における術後脳卒中の高い発生率(10~20%)3、5、7、8は、循環停止中の不適切な脳保護、塞栓事象、または大腿動脈を用いた灌流の際に偽腔を優先的に流れることによる不完全灌流と関連があると言われている9、10
術後脳卒中は、脳卒中の発生を引き起こす可能性がある。 近年、選択的Antegrade脳灌流や腋窩動脈カニュレーションなどの新しい脳保護技術の導入により、この合併症の発生率はかなり減少している10-17。
本研究の目的は、急性A型大動脈解離の手術経験について、院内死亡率、再介入率、長期生存率との関連で述べ、脳保護が結果に及ぼす影響を分析することである
METHODS
2007年10月に、当院にて連続98例(男性79例、女性19例)急性A型大動脈解離に対して手術を受けた。 この期間に診断され、手術のために紹介された患者(103人)のうち、5人が除外された。2人は85歳以上、その他は脳や内臓の不可逆的な病変を呈したためであった
年齢の中央値は59歳であった。 来院時の症状で最も多かったのは急性胸痛であった。 診断は初診時の大動脈造影(18%),経胸壁心エコー(76%),経食道心エコー(66%),胸腹部CT(65%)で確認された。 診断検査が1つであった11例を除き、全例がこれらの画像診断のうち2つまたは3つを併用して診断されている(現在、採用されている診断システムは経胸壁心エコーと術中経食道心エコーに胸腹部CTを併用、または併用している)。
計91名(93%)が緊急手術(24時間以内),その他は緊急手術(診断後72時間以内)を受けた。
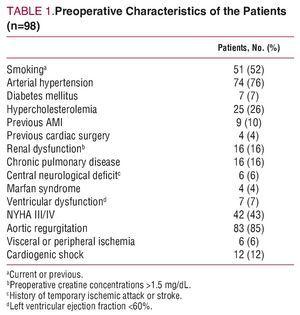
画像検査では83名(55%が重度の逆流を伴う)で大動脈逆流が確認された。 術前の臨床的・人口統計学的特徴を表1に示す。
手術手技
手術の基本概念は、上行大動脈または大動脈弓の置換、原発巣切除、循環停止中の遠位吻合部の準備にある。 この18年の間に、この病態に対する外科的戦略は徐々に進化してきた。 当初は上行大動脈のみを切除し、循環停止を行わず大動脈クランプを行った。 1994年には循環停止を伴う遠位吻合術が導入され、現在ではすべての患者に対して、さまざまな脳保護法を適用しながら、この方法が用いられている。 最近、循環停止中の脳保護法として腋窩動脈からの選択的antegrade脳循環が導入された(図1)
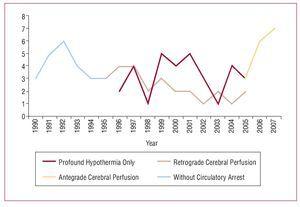
図1. 4408>
手術は胸骨正中切開、大腿動脈カニュレーション(82%)、腋窩動脈カニュレーション(16%)、大動脈弓カニュレーション(2%)、右房(85%)または大腿静脈(15%)からの静脈還流と心肺バイパスにより行われた。 大動脈クランプ後、上行大動脈を縦に開き、冠動脈上切開を行い、内膜裂傷があればその位置を確認し、大動脈弁の形態と機能を検討した。 その後、深部低体温と循環停止状態で、上行大動脈のクランプを解除し、大動脈弓全体を検査した。 27%の患者で上大静脈から逆行性脳循環を追加した(200〜300mL/min)。 4408>
一次断裂は83例で確認され,大動脈基部14%,上行大動脈67%,大動脈弓部19%であった. 一次断裂の影響を受けた大動脈セグメントは切除され、Hemashield dacron graft (Boston Scientific, Massachusetts, USA) を用いて、異種心膜ストリップを支持した4/0モノフィラメント連続縫合で吻合し、近位および遠位の本来の大動脈を gelatin-resorcin-formaldehyde (GRF, biological glue; Cardial Laboratories, Saint-Etienne, France) で補強することにより、置換が行われた。 私たちの初期の経験では、大動脈セグメント置換術は21人の患者に包埋法(切除した大動脈で人工血管を覆う方法)で行われました。 現在ではグラフトインターポジション法(在来大動脈を完全に切除してチューブ状の人工血管に置換する方法)が用いられている。
上行大動脈のみの置換は61例(63%)、半弓部までの拡張は24例(24%)、全大動脈弓部への置換は13例(13%)である。 半弓部とは,大動脈弓部を部分切除し,遠位吻合のみを行い,大動脈弓上部の再移植を必要としない症例を指す。 大動脈弓部全置換術では、遠位吻合部に人工血管の遊離片が残り、下行胸部大動脈にぶら下がるため、この部位への介入が容易になる)6例で象牙幹が使用された。 大動脈弁は、46例(47%)でテフロンパッチに支えられた4/0モノフィラメント縫合糸で交連を再懸濁することで温存し、34例(35%)で置換し、1例(1%)で再置換した。 大動脈弁の交換が必要な場合、73%の患者は弁グラフトを使用し、Bentall法による冠動脈の再移植が行われた。 大動脈弁の術前状態をTable 2に示す。 術後、再留置の場合、術中経食道心エコーで弁の機能を確認したところ、84%の患者で、軽度の逆流が13%、残りの患者では中程度の逆流(II/IV)であった。

平均心肺バイパス時間は183(58)分、虚血時間は113(39)分、循環停止時間は3(23)分であり、初期経験者の合計24%は循環停止を行わなかった。 残りの症例では,脳保護法として深部低体温法が32例(33%),逆行性脳灌流が26例(27%),前向性脳灌流が16例(16%)に使用されたのみである。 臨床データは患者,家族,プライマリーケア医との個人面談および電話面談によって得られた。 統計解析<4408><7850>すべての解析にSPSS統計プログラム(Windows版14.0)を使用した。 周術期の変数について単変量解析を行い、統計的に有意なリスクファクターを決定した(P
RESULTS
Hospital Mortality
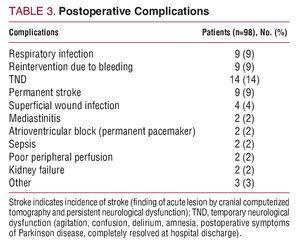
病院死亡率は15%(15/98):術中出血による死亡6例、低心拍数3例、神経障害2例、敗血症2例、術後の多臓器不全による2例であった。 表3に術後合併症を示す。
単変量解析では、高齢、左室機能障害、心原性ショック、心肺バイパス時間>200分、大動脈クランプ時間>130分、術後脳卒中が院内死亡の危険因子と考えられた(表4)。 これらの変数について多変量解析を行った結果、高齢(70歳以上)(RR=2.85、P=.04)と術前心原性ショック(RR=2.6、P=.025)が病院死亡率の独立予測因子として同定された。

術前の神経機能障害と経験年数(1990-1994)は単変量解析で術後神経合併症と関連した唯一の変数だったが(表4),これらは多変量解析では統計的に有意には至らなかった。
循環停止を行った患者と行わなかった患者で死亡率および特定の術後神経学的合併症(永久脳卒中および一時的神経機能障害)を測定し、用いた脳保護方法(深部低体温単独または逆行性または前向性灌流の併用)により層別化した(表5)。 4408>

フォローアップ
95%のフォローアップ率(79例)で、中央値は61(範囲、1-204)カ月であった。 退院後,全例に2か月後とその後1年ごとに心エコー検査を実施した。 合計67%(56/83)の患者が少なくとも1回のCT検査を受けた。 CTを受けなかった生存患者27名のうち、17名が検査を拒否または出席せず、4名が研究対象から外れ、6名がフォローアップ中に死亡し、1名は既知の大動脈の原因(腹部大動脈瘤破裂)によるものであった。
コンピュータ断層撮影では,71%の患者で遠位大動脈の偽腔が持続的に開存しており,そのうち17%は胸部大動脈と腹部大動脈の進行性の拡張を示した。
再介入
合計13人(16%)の患者が,追跡期間中に再介入となった。 その原因は,重症大動脈弁逆流と大動脈基部の拡張が5例,重症大動脈弁逆流と大動脈基部の再分割が3例,重症大動脈弁逆流のみが1例,重症大動脈弁逆流と僧帽弁逆流が1例,僧帽弁と大動脈弁心内膜炎が1例,大動脈気管性偽アニューレスが1例,大動脈基部と右房のフィステル化が1例であった。 下行大動脈の疾患に対して再介入を行った患者はいなかった。 適用された外科的処置を表6に示す。 院内死亡率は23%(3/13)であり,2例は術中出血,1例は心拍出量低下により死亡した。
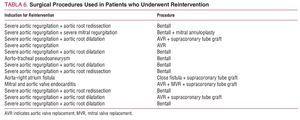
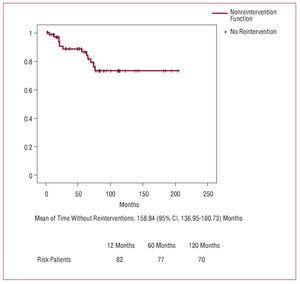
Figure 2. Nonreintervention curve
Long-Term Survival
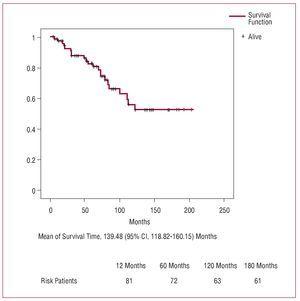
Figure 3. 追跡中の生存曲線(Kaplan-Meier)

単変量解析では追跡中の死亡の予測因子として高齢(≧70歳),包埋法,術後TND,非前頭脳保護法(表9)の適用が示された。 多変量解析では,追跡期間中の死亡率の独立した統計的に有意な予測因子は,antegrade cerebral protectionを使用しないことのみであった(RR=3.1;P=0.02).

考察
急性A型大動脈解離は、ほとんどの症例で即時臨床対応と緊急外科的介入を要する重大事態である。
Siegalら18は未処置患者では、最初の48時間は死亡リスクが1時間ごとに1%上昇し1週間後には70%に到達すると推測した。 急性大動脈症候群の国際登録(IRAD)1 のデータによると、保存的治療を受けた患者の死亡率は58%であるのに対し、手術による総死亡率は24%である。
近年、診断、手術の技術や術後ケアにおいて大きな進歩があったが、入院死亡率は15~30%とかなりのばらつきがある。
我々のシリーズでは,病院死亡率の独立した予測因子は高齢(70歳以上)および術前の心原性ショックのみだった。 一方,他の著者は,より広範な切除に伴うリスクは潜在的な利益を上回り,手術の主目的は患者の生存であると主張し,上行大動脈のみの切除を提案している5。
大動脈解離の手術中の神経損傷の原因は多因子性であり、長時間の循環停止、塞栓事象、偽腔を優先的に流れることによる脳灌流不良につながる。
術後神経合併症は大動脈解離手術における病的および死亡率の原因として頻繁に見られ、発生率は10~20%と推定されている。3,5,7,8
Erginら9とHaglら10は、術後脳卒中は主に大腿動脈からの逆行性灌流との関連性が考えられる塞栓事象であり、使用した脳保護法とは直接関係しないが、TNDは不十分な脳保護と関連すると指摘する。 最近の研究では、Antegrade脳灌流はTNDの有意な減少と関連しているが、脳卒中の減少との関連ではその役割はあまり明確ではない。 さらに、脳を保護し、深部低体温の弊害を避けるためには、中等度低体温(25℃)で十分であるとする意見もある。17,25,26 しかし、我々のグループは、これらの修復が複雑で、長期に及ぶことが予想され、この冷却方法が脳だけでなく他の器官の保護に非常に有効であると示されているので深部低体温を適用した17,27,28。
大腿動脈の代わりに腋窩動脈をカニュレーションすることにより、内臓および脳灌流の低下、腹部および胸部大動脈から脳へ向かう血栓の再固定化のリスクを減らし、さらに、流れを真の内腔に向け、大動脈クランプ時に過度の圧力上昇の機会を減らし、前向遠位灌流の回復を促進することができます12-16。 これらの利点から、重度の動脈硬化の影響を受けている場合を除き、腋窩動脈を介した前向きの脳循環は脳保護に適した方法であると思われます10,11,17。
我々のシリーズでは、腋窩動脈を用いたantegrade脳循環は、手術を受けた最後の16人の患者においてTNDの発生率を6%に、病院死亡率を6%に減少させ、神経合併症とそれに付随する病的状態と死亡率から守る役割を示唆したが、実証はしなかった。 この統計的有意性の欠如は、腋窩動脈経由のantegrade灌流を用いたインターベンションの数が少ないことに起因している可能性がある。 このインターベンションの稀少性(
10年時点で73.3%の患者が再インターベンションを受けておらず、この結果は発表されたものと同様である3,4,6,29,30。 大動脈弁は可能な限り温存し、弁膜変性症、環状大動脈外膜症、心臓弁膜症の既往がある場合のみ、弁置換単独または大動脈基部置換(Bentall法)を行うことにしたが、この方法は入院死亡率には影響しなかった
我々のシリーズにおいて、再閉鎖手術を受けた患者の77%(13/78)が、以前に発症し最初の手術中に弁を再懸濁させて保存的に対処した重度の大動脈逆流によるものであった。 術前の急性大動脈弁閉鎖不全症と大動脈弁の温存は、まさに大動脈再介入の遅れを決定する要因であり、このことは初回手術時の大動脈弁の積極的な管理を正当化するものである6、29 Haglら31 は、根元と大動脈弁を系統的に置換すること(Bentall法)を推奨した。 一方、Estreraら32 は、大動脈弁を温存した後の耐久性が許容範囲であると報告しています。彼らは、再介入の可能性を考慮して初回手術を決めるべきではないと指摘し、慢性抗凝固療法と偽腔の血栓症の可能性がない場合の役割を考慮して大動脈弁の温存を推奨しています33。
我々は、重度の大動脈弁閉鎖不全症の初期症状は、その起源または範囲が大動脈基部を含む解離の重症度を決定するため、大動脈基部および弁切除と弁グラフト移植(Bentall法)による積極的管理が、選択されるべき手順であると考えています4、6、29、31これらのケースでは、弁再懸濁は大動脈基部を残して、再解離とその後の合併症をより大きく危険にする、大動の固有の病気のセグメントを残すことになるのです。 大動脈弁再移植を伴う大動脈基部置換術(David法)の結果は有望であり、長期的な評価が必要であるが、興味深い選択肢となる可能性がある33,34。
退院後も生存し、経過観察中にCTを受けた56人のうち、大動脈の他の部位で進行性の拡張が明らかで外科的適応があったのは、腹部大動脈瘤2人、胸腹部動脈瘤2人、下行胸部大動脈瘤2人の計6人(11%)だけであった。 これらの患者のうち、2人は再介入を拒否し、他の患者は何らかの併存疾患(高齢、重度の神経障害など)があり、処置が不可能であった。
遠位大動脈の再介入率がこのように低いのは、おそらくインターベンション中に一次内膜裂傷が高い割合で存在し、すべてのケースでそれを切除するという我々の決断によると考えられる。 実際、内膜裂傷が見つからなかった15例のうち、60%(9例)は循環停止(大動脈弓の検査ができず、そのレベルでの内膜裂傷を除外する)を行わなかったグループのメンバーであり、統計的有意性の限界に近い再介入のリスク増加を示した(P=0.06)。 したがって、数名の著者は、胸部または腹部大動脈の拡張術に対する遅発性再介入の主な要因として、最初の手術で内膜破裂を切除しなかったことについて述べている6,30。
この点に関して我々のグループは経験がないが、ある症例では、初回手術または再手術時に胸部下行大動脈にステントを留置することにより、再手術の発生率と遠位大動脈への疾患進行による合併症の発症を減少させ、治療成績を改善できると指摘する著者がいる35,36。
退院後の数理的生存曲線は、他の著者によって記述されたものと同等のいくつかの割合を示している。2,3,5,6 高齢は、この患者群における低い生命予後のためもあり、ほとんどのシリーズで追跡調査中の死亡の独立した危険因子の1つである。 Chiappiniら2 は、A型大動脈解離に対してインターベンションを受けた487人の患者について報告し、唯一の危険因子は術前の糖尿病であることを明らかにした。 Erwinら3は315人の患者を対象に,高齢と術後透析が経過観察中の死亡の予測因子であることを明らかにした。
我々のシリーズでは,antegrade cerebral protectionを使用しないことが晩期死亡の予測因子であり,antegrade perfusionは術後初期成績に大きな影響はないものの,晩期生存については重要性が高いことがわかった。 Pompilioら37は、周術期の神経学的イベントが晩期死亡率に及ぼす影響を評価した。つまり、神経学的損傷により入院を乗り切った患者は、長期生存率が悪いということである。 この事実は、これらの患者の機能的能力の低下に関連した気管支肺炎、新たな神経学的イベントおよびその他の合併症のリスクが高いことで説明できるかもしれない4
Limitations
この論文は、レトロスペクティブ非ランダマイズ研究に伴うすべての制限を共有するものであった。 本疾患の発生率が低いため、介入を受けた患者が少なく、所見の統計的検出力に限界がある。
このレビューは長い期間の経験を対象としているので、最初の患者は循環停止なしで管理し、後の患者はantegrade cerebral perfusionで管理したが、他の脳保護方法について言及したものと同時代のものでなかった。 また、最後の方法(antegrade cerebral perfusion)はサンプル数が少なく(16人)、結果の統計的意義に限界があった。
重度の大動脈弁逆流は早期の再介入のリスクが高く、このことは初回手術時の大動脈弁の積極的な管理を正当化する。
前向性脳循環は、循環停止の概念を変更し、これらの患者の長期予後を改善した。 大動脈解離の急性期手術において,より大規模な症例での経験が必要であるが,antegrade cerebral perfusionの適用により予後が改善する可能性があると考える.