John Grizzanti1, Rachel Corrigan1, Spencer Servizi1, Gemma Casadesus1,2*
1School of Biomedical Sciences, Kent State University, Ohio, USA
2Department of Biological Sciences.のメンバーとして参加。 米国オハイオ州ケント州立大学
Abstract
II型糖尿病(T2D)とアルツハイマー病(AD)の密接な関係を示す証拠が増えつつある。 重要なことは,これら2つの疾患はアミロイドの蓄積,酸化ストレス,炎症,細胞死など多くの病態的類似性を有していることである。 現在までのところ、ADおよびT2Dに対する薬物治療薬は不足しており、これらの疾患に対する新規治療薬の発見と開発が極めて重要な課題となっています。 多くのヒトおよびげっ歯類の研究により、代謝ホルモンの補充は、T2DとADの両方において、認知機能と全体的な代謝の健康を改善するために非常に価値があるという証拠が得られています。 膵臓ホルモンであるアミリンは、T2DとADの両方の疾病病因の重要な構成要素として浮上しているが、アミリンがこれらの疾病で果たす正確な役割はまだ十分に理解されていない。 ここでは、ヒトのアミリンまたはその合成アナログであるプラムリンチド、およびアミリン受容体拮抗薬をADの治療に利用した現在の文献を批判的にレビューします。
はじめに
アルツハイマー病(AD)は、アミロイドベータ(Aβ)プラークおよび過リン酸化Tau1からなる神経原線維もつれの蓄積によって特徴づけられる進行性の衰弱性神経変性疾患である。 これらの病的ペプチドの蓄積は、学習・記憶などの実行機能、気分・感情などの障害の一因となり、患者さんや介護者に大きな負担を与えます。 米国ではADの発症率が驚異的に増加しており、2017年時点で推定550万人の米国人がADとともに生活しており、この数は2050年までに3倍になると予想されています2。 さらに、AD患者のケアと治療にかかる費用は現在、年間2000億ドルを超えており、今後も増加すると予想されています3。 ADは米国内外で明らかに重大な問題ですが、治療の選択肢は依然として非常に限られています4。 多くの薬物試験が実施され、様々な標的アプローチが行われていますが、現在、FDAによって承認されているAD治療薬は6種類のみで、対症療法にとどまっています5, 6。 現在までに開発された薬理学的薬剤の大半は、特徴的なAβやタウの病態を特異的にターゲットにしていますが、病態の除去や予防に成功したものはありません4。 そのため、ADの治療薬や予防法を開発することが根本的に必要です。
加齢性(散発性)ADは、遺伝や環境の影響を多く受ける、複雑な多因子疾患です。 散発性ADの発症には環境とライフスタイルが大きく関わっており、食事7-9、肥満8-10、メタボリックシンドローム7、II型糖尿病(T2D)9、11、心血管疾患12などの要因がADの発症に関与しているとされてきました。 特に重要なことは、ADと並行して肥満と糖尿病の割合が急速に増加していることです12, 13。 肥満とADの関係はやや不明ですが、中年期の肥満がADの発症に関与していることを示す証拠があります10。 さらに重要なことは、肥満は一般的に心血管疾患、高血圧、脂質異常症、T2D、脳卒中など、他の多くの疾患を伴うということです14。 T2Dの発症率は急速に上昇しており、CDCの推計によると、米国では約3,030万人(成人の10人に1人)が糖尿病、8,410万人(成人の3人に1人)が糖尿病予備軍で、そのほとんどが自分の症状に気づいていないとされています。 さらに、身体活動の大幅な低下とそれに伴う食事量の増加や食生活の乱れにより、肥満、T2D、メタボリックシンドローム、心血管疾患の割合は、2035年までに世界中で推定6億人のT2D患者へと増加すると言われています15。 例えば、T2Dと診断された人の約70%が認知機能障害を報告し、相当数のT2D患者が後に認知症を発症する16, 18-21。 また、5年以上T2Dと診断された人は、5年未満の人に比べてAD発症のリスクが有意に高い17。
T2Dは、まず高血糖とインスリンによって高インスリン血症を引き起こすことが特徴です。重要なことは、膵臓のβ島細胞によって産生される小さな代謝ホルモンであるアミリンが、インスリンと一緒にパッケージされて共分泌され、そのためT2Dでは過剰に産生されることです。22. 重要なことは、T2DとADの両方に存在する病理学的特徴として、1)脳代謝の低下と代謝ホルモン抵抗性 2)アミロイド病理 3)酸化ストレス(OS)および炎症があることである。 慢性的な高インスリン血症および高アミリン血症は、多くの生理学的問題を引き起こす。慢性的な高インスリン血症は、全身のインスリン抵抗性22、血液脳関門(BBB)を介したインスリン輸送障害23、24、ひいては脳内のインスリンシグナルの減少25をもたらす。 さらに、アミリンは高濃度においてAβと同様の病理学的特徴を有しており26、両疾患の共通経路である可能性がある。 例えば、アミリン線維はT2D患者の95%の膵臓で発見されており27-29、異常なCa2+流入、炎症性サイトカインの分泌増加30,31、最終的にはβ島細胞の損失32など多くの生理的混乱を引き起こしている。 さらに、アミリンはBBBを容易に通過し、脳内でアミリン線維やAβとの混合プラークを形成し、T2DにおけるAD様病態やAβ播種に関与している可能性がある33-35。 アミリンは海馬の長期増強(LTP)に影響を与えることが知られており、脳内の認知機能に生得的な影響を与える可能性がある36-39. しかし、アミリンがこれらの疾患における毒性障害であるのか、あるいはT2Dにおける凝集や後期のβ細胞喪失による機能喪失がADの発症に寄与しているのかは、依然として不明である。
The Amylin Signaling Dichotomy
T2DとADの疾患進行と病因におけるアミリン受容体(AMYR)とアミリンシグナルの関与についてはまだ多くの議論が残っている。 この関係を見極めることを目的とした研究群は、急速に拡大している。 すべての関連する研究は、アミリンシグナル伝達の調節がAD関連の病態に影響を与えることを一貫して実証している。 しかし、この関係の性質は、まだ具体的に解明されていない。 いくつかのグループは、アミリンシグナル伝達がin vivoとin vitroの両方でAD関連の病態と認知障害の予防に有益であることを示唆する説得力のあるデータを発表している40-44。 重要なことは、アミリンの組換え非集合型であるプラムリンチドが、糖尿病治療のためにインスリン療法と併用して、血糖コントロールを改善し、体重を減らし、OSの血清マーカーを減少させることである45-47も、AD治療薬として有望であることを示していることである。 しかし、現在までのところ、アミリンやプラムリンチドを認知症治療薬として活用することを目的とした臨床試験は行われていない。 ネズミの研究から、ヒトのアミリンまたはプラムリンチドを慢性的に投与すると、AD関連の病態を軽減する上で強い治療効果があることが明らかになった。アミリン/プラムリンチドの補充は可溶性Aβレベル、プラーク負荷、タウリン酸化、神経炎症、OSを軽減し、認知機能も改善する40-42,44. 上記のデータは、凝集によるCNSにおける生来のアミリンシグナル伝達の喪失がADの発症リスクの増加をもたらすことを示唆しており、Grizzantiら201848でより詳細に取り上げられている<1040><8590>一方、研究は、ヒトアミリンおよびAβが同様の毒性効果を有すること、およびこれらの毒性効果はAMYR拮抗薬を用いて軽減できることも示す36〜39,49. 例えば、AMYRアンタゴニストによるin vivo治療は、アミリンまたはプラムリンチド治療と非常に類似した生理学的利益をもたらすことを示すデータがある。 TgCRND8 ADマウスにAMYRアンタゴニストのAC253またはその環状体cAC253を投与すると、神経炎症、可溶性Aβレベル、プラーク負荷が減少し、認知機能も改善する50。 同様に、in vitro/ex-vivo 研究では、低用量のヒトアミリンまたはAβはLTPの障害を引き起こし、これらの障害はAC253またはpramlintideによってブロックされる38,39、高用量のヒトアミン/アミリンオリゴマーは制御できないCa2+流入と関連しており、これは細胞死と強く結びついている26,32。 これらのデータを総合すると、アミリンオリゴマーの毒性機能が支持され、したがってAMYR遮断の治療メカニズムとして期待される。 一方、他の研究者は、AC25341を用いてアミリンの有益な効果をブロックできることを示している。
Piecing Together the Puzzle
現在の文献には、アミリンに関するストーリーをより完全に把握するために埋めるべき穴がいくつもある。 1) 生来のアミリン系と脳内のアミリンシグナルの性質 2) 3つの主要なAMYRおよび関連受容体を介したAβおよびPramlintideシグナル伝達能力 3) amylin/PramlintideまたはAMYR阻害が仲介する治療機序などです。 まず、興味深い新規データとして、AMYRはシグナル伝達だけでなく、BBBを介したリガンド輸送にも関与していることが示された。 AMYRは、カルシトニン受容体と受容体活性調節タンパク質(1-3)からなるヘテロ二量体受容体である51。 このため、AMYRの主要な構成要素であるカルシトニン受容体を50%グローバルノックダウンすると、脳内に見出されるAC253の量が著しく減少することから50、BBBに存在するAMYRがこれらのリガンドの脳内輸送に関与し、アミリンやプラムリンチドの脳内外へのシャトル移動にも関与している可能性が示唆された。 このようなBBB輸送機構の存在は、アミリンの脳内輸送が厳密に制御されていることから、アミリンが脳内で生来の生理的機能を有している可能性が高いことを示唆している。 しかし、アミリンシグナルがどのようにADの病理学的特徴をもたらすのか、また、アミリン酸がその毒性効果を媒介する媒介物であるかどうかは、まだ不明である。 いくつかの研究は、ヒトのアミリンとAβがCNSのLTPに同様の効果を持ち、AMYR阻害剤の使用がこれらの有害な効果を改善することを明確に示しているが36-39、他の証拠は、Aβ(1-42)がAMYRのいかなるシグナル伝達もできず、幅広い濃度においていかなる種類のcAMP反応を引き起こすことができないことを示唆している52。 AβはAMYRとの相互作用を通じて異なるシグナル伝達カスケードを活性化するか、あるいは単に不活性な競合阻害剤として働く可能性があるが、これはまだ実証されていない。
さらに、別の研究では、オリゴマーアミリンはAMYRを通じて直接、非選択的カチオンチャネルのTRPV4を介して間接的に毒性効果を仲介することが示された26。 低濃度のヒトアミリンでは、アミリン本来の受容体を介したCa2+応答が起こるが、低濃度のヒトアミリンでは、アミリン本来の受容体を介したCa2+応答は起こらない。 しかし、高濃度では、アミリンはオリゴマーを形成し、TRVP4チャンネルを活性化する異常なシグナル伝達を行い、制御できないほどの陽イオン、特にCa2+の流入を可能にする。 AMYRとTRPV4の薬理学的遮断は、オリゴマーのヒトアミリンがその毒性Ca2+効果を誘発するためには、両方の受容体が必要であることを証明している26。 従って、AβはAMYRに対して同様の方法で毒性作用を媒介すると思われるが、これらのデータはまだ存在しない。 制御不能なCa2+流入は、制御不能な小胞放出、OSおよびミトコンドリア機能障害、アポトーシスなど、多くの病的現象に関連している。 このため、毒性アミロイドシグナルから生じる細胞機能障害やさらなるAD様病態の進展は、AMYRとTRPV4の両方を介している可能性が高いと考えられます。 そのため、AMYRとTRVP4の関係を調節するシグナル伝達カスケードを見極めることが必要である。 さらに、Aβとプラムリンチドを幅広い用量で利用し、Ca2+電流、LTP、cAMP生成、および他のシグナル伝達カスケードに対するAβとプラムリンチドの効果を測定し、それらのシグナル伝達能力を決定する薬理実験が必要である。 これらの実験は、AMYRとその疾患状態への関与に関して、現在の文献にある空白を埋めるのに役立ちます(図1)。
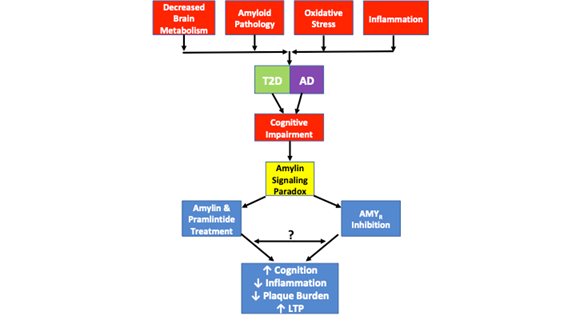
図1は、T2DとADで観察されるアミリン信号パラドックスと病的類似性を描いたものです。 脳代謝の低下、アミロイド病理、酸化ストレス、炎症はすべて、両疾患で観察される共通の病理学的特徴である。 T2DやADのすべての症例がこれらの病的特徴をすべて含むわけではないが、すべての症例で認知機能障害が認められる。 アミリンとプラムリンチドによるAMYR阻害とAMYRアゴニズムの両方が、認知機能の改善、炎症の抑制、プラーク負荷の軽減、LTPの増加をもたらすことが研究で示されており、アミリンシグナルパラドックスが重要な役割を担っている。 AMYRアゴニズムとAMYRアンタゴニズムが支配するシグナル伝達機構は、まだ十分に解明されていない。 アミリンシグナルは従来、cAMPおよびPKAシグナルと関連しているが、他のカスケードもアミリン/プラムリンチドによって活性化されるのかどうかは不明である。 さらに、AMYRアンタゴニスト、アミリンオリゴマー、AβがAMYRを介してシグナルを発するのか、これらすべてのAMYRリガンドの間に類似性やクロストークがあるのかどうかも不明である。 1040>
結論
脳におけるアミリンシグナルの役割に関する現在の格差は、ADとT2Dの両方におけるアミリンの関与についてさらに解明することが不可欠であることを示している。 T2Dでは、病気の初期にアミリンが脳に流入し、オリゴマーを形成し、本来の受容体を介した異常なシグナル伝達を誘導し、TRPV4を呼び出して病的なCa2+流入を引き起こし、OS、制御できない小胞放出、神経間機能障害、炎症、結果として細胞死として現れる広範囲の神経細胞の機能不全を引き起こすと思われます。 このメカニズムは、健康な脳から代謝性疾患における脳の老化への最初の移行に関与していると考えられる。 このように、代謝性疾患や糖尿病の初期段階において、AMYRやTRVP4を阻害することは、オリゴマーアミリンやAβの毒性作用をブロックするために必要なことかもしれない。 しかし、ヒトアミリンまたはプラムリンチドによるアミリン置換は、ADのげっ歯類モデルにおいて認知機能を改善しつつ、ADに関連する主要な病理をほとんど軽減することを示す強い証拠もある。 このように、凝集、オリゴマー化、あるいはβ細胞の消失によってアミリンシグナルが失われた糖尿病の中期から後期にかけて、アミリンまたはプラムリンチドによるアミリンシグナル補充が正当化される可能性がある。 そのためには、代謝に関連した脳老化の病理学的事象の時間的提示を見極め、初期、中期、後期の疾患に対する治療法の選択肢も必要である。 これらのアミロイドの直接的な性質とシグナル伝達能力、および特定の時間的な治療の性質について批判的に分析および検証することは、AMYR阻害療法とアミリン置換療法との間のギャップを埋めるのに役立つ可能性がある。
資金提供
この記事の資金は、国立老化研究所助成金1R15AG050292-01A1によって提供された。
- LaFerla FM, Oddo S. Alzheimer’s Disease. Aβ、タウ、シナプス機能障害。 Trends Mol Med. 2005; 11: 170-176.
- Hebert LE, Weuve J, Scherr PA, et al. 米国におけるアルツハイマー病(2010-2050)2010年国勢調査を用いて推計した。 Neurology. 2013; 80: 1778-1783.
- Association As. 2016 Alzheimer’s disease facts and figures. アルツハイマー病 & 認知症. 2016; 12: 459-509.
- Cummings JL, Morstorf T, Zhong K. Alzheimer’s disease drug-development pipeline: few candidates, frequent failures.アルツハイマー病の医薬品開発パイプライン:少数の候補、頻繁な失敗例。 Alzheimers Res Ther. 2014; 6: 37.
- Hyde C, Peters J, Bond M, et al. Evolution of the evidence on the effectiveness and cost-effectiveness of acetylcholinesterase inhibitors and memantine for Alzheimer’s disease: systematic review and economic model.アルツハイマー病治療薬の有効性と費用対効果に関するエビデンスの進化。 Age Ageing. 2012; 42: 14-20.
- Howard R, McShane R, Lindesay J, et al. Donepezil and memantine for moderate-to-severe Alzheimer’s disease.(中等度から重度のアルツハイマー病に対するドネペジルとメマンチン).The Evolution of the evidence of acetycholinesterase inhibitors and memantine for Alzheimer disease. N Engl J Med. 2012; 366: 893-903.
- Crane PK, Walker R, Hubbard RA, et al. Glucose levels and risk of dementia.グルコースレベルと認知症のリスク。 N Engl J Med. 2013; 369: 540-548.
- Loef M, Walach H. Midlife obesity and dementia: meta?analysis and adjusted forecast of dementia prevalence in the United States and China.中年の肥満と認知症:米国と中国における認知症有病率のメタ分析と調整済み予測。 肥満。 2013; 21.
- Gudala K, Bansal D, Schifano F, et al. Diabetes mellitus and risk of dementia: a meta?analysis of prospective observational studies.糖尿病と認知症リスク:プロスペクティブ観察研究のメタ? 糖尿病調査ジャーナル。 2013; 4: 640-650.
- Whitmer RA, Gunderson EP, Barrett-Connor E, et al. Middle age and future risk of dementia: a 27 year longitudinal population based study.中年期の肥満と将来の認知症リスク:27年間の集団縦断研究. BMJ. 2005; 330: 1360.
- Vagelatos NT, Eslick GD. アルツハイマー病の危険因子としての2型糖尿病:この関係に関連する交絡因子、相互作用、および神経病理学。 Epidemiol Rev. 2013; 35: 152-160.
- Debette S, Seshadri S, Beiser A, et al. Midlife vascular risk factor exposure accelerates structural brain aging and cognitive decline.中年期の血管リスクファクターへの曝露は、脳の構造的老化と認知機能低下を加速させる。 Neurology. 2011; 77: 461-468.
- Ginter E, Simko V. Global prevalence and future of diabetes mellitus In Diabetes Springer.2011年11月号より。 2013; 35-41.
- Khaodhiar L, McCowen KC, Blackburn GL. 肥満とその併存疾患 クリンコーナーストーン。 1999; 2: 17-31.
- Federation ID. IDF糖尿病アトラス。 ブリュッセル:国際糖尿病連合。 2013.
- K Dash S.認知機能障害と糖尿病。 最近のPat Endocr Metab Immune Drug Discov。 2013; 7: 155-165.
- Leibson CL, Rocca WA, Hanson V, et al.Risk of dementia among persons with diabetes mellitus: a population-based cohort study.「糖尿病患者における認知症のリスク」(英語). Am J Epidemiol。 1997; 145: 301-308.
- Biessels GJ, Strachan MW, Visseren FL, et al. Dementia and cognitive decline in type 2 diabetes and prediabetic stages: towards targeted interventions.「2型糖尿病と糖尿病予備軍における認知症と認知機能の低下:標的介入に向けて」. ランセット 糖尿病&内分泌学. 2014; 2: 246-255.
- Akter K, Lanza EA, Martin SA, et al. Diabetes mellitus and Alzheimer’s disease: shared pathology and treatment.糖尿病とアルツハイマー病:共通の病理と治療. Br J Clin Pharmacol. 2011; 71: 365-376.
- Akter S, Rahman MM, Abe SK, et al. Bangladeshi adults: a nationwide survey.Prevalence of diabetes and prediabetes and their risk factors among Bangladeshi adults.2011; 71: 365-376.
- Akter S, Rahman MM, Abe SK, et al. Bull World Health Organ. 2014; 92: 204-213A.
- Ott A, Stolk R, Van Harskamp F, et al. Diabetes mellitus and the risk of dementia The Rotterdam Study.「糖尿病と認知症リスク」. Neurology. 1999; 53: 1937-1937.
- Farris W, Mansourian S, Chang Y, et al. Insulin-degrading enzyme regulates the levels of insulin, amyloid β-protein, and the β-amyloid precursor protein intracellular domain in vivo.インスリン分解酵素は、インスリン、アミロイドβ-タンパク質、β-アミロイド前駆タンパク質細胞内ドメインのレベルを調節している。 米国科学アカデミーの議事録(Proceedings of the National Academy of Sciences)。 2003; 100: 4162-4167.
- Schwartz MW, Figlewicz DF, Kahn SE, et al. Insulin binding to brain capillaries is reduced in genetically obese, hyperinsulinemic Zucker rats.(「肥満の脳毛細血管へのインスリン結合」は、遺伝的に高インスリン血症のZuckerラットにおいて減少した。 Peptides. 1990; 11: 467-472.
- Wallum B, Taborsky Jr G, Porte Jr D, et al. Cerebrospinal Fluid Insulin Levels Increase During Intravenous Insulin Infusions in Man*. 臨床内分泌学&代謝のジャーナル。 1987; 64: 190-194。
- Gil-Bea FJ, Solas M, Solomon A, et al. Insulin levels are decreased in the cerebrospinal fluid of women with prodomal Alzheimer’s disease(アルツハイマー病患者の脳脊髄液におけるインスリンレベルの低下). J Alzheimers Dis. 2010; 22: 405-413.
- Zhang N, Yang S, Wang C, et al. hAmylinのラット初代海馬ニューロンに対する多重標的作用. Neuropharmacology. 2017; 113: 241-251.
- Kahn SE, Hull RL, Utzschneider KM. 肥満とインスリン抵抗性、2型糖尿病をつなぐメカニズム。 Nature. 2006; 444: 840-846.
- Johnson K, O’Brien T, Jordan K, et al. Impaired glucose tolerance is associated with increased islet amyloid polypeptide (IAPP) immunoreactivity in pancreatic beta cells.膵臓β細胞の耐糖能異常とIAPPの免疫反応の増加。 The American Journal of Pathology. 1989; 135: 245.
- Johnson KH, O’Brien TD, Betsholtz C, et al. Islet amyloid, islet-amyloid polypeptide, and diabetes mellitus.膵島アミロイドと糖尿病。 N Engl J Med. 1989; 321: 513-518.
- Masters SL, Dunne A, Subramanian SL, et al. islet amyloid polypeptide による NLRP3 inflammasome Activation provides a mechanism for enhanced IL-1β in type 2 diabetes.島アミロイドポリペプチドによって活性化することは、2型糖尿病においてIL-1βが増強されるメカニズムを提供する。 Nat Immunol. 2010; 11: 897.
- Wang X, Bao W, Liu J, et al. Inflammatory markers and risk of type 2 diabetes: a systematic review and meta-analysis.Nat Immunol.2010;11:897.2型糖尿病の炎症マーカーとリスク。
- Kawahara M, Kuroda Y, Arispe N, et al. Alzheimer’s β-amyloid, human islet amylin, and prion protein fragment evoke intracellular free calcium elevation by a common mechanism in a hypothalamic GnRH neuronal cell line.視床下部GnRH神経細胞株におけるアルツハイマー病βアミロイド、ヒト膵島アミリン、プリオン蛋白質断片の共通したメカニズム。 J Biol Chem. 2000; 275: 14077-14083.
- Verma N, Ly H, Liu M, et al. Intraneuronal Amylin Deposition, Peroxidative Membrane Injury and Increased IL-1β Synthesis in Brains of Alzheimer’s Disease Patients with Type-2 Diabetes and in Diabetic HIP Rats.In the Brains, and Insecting in Diabetic Hip Rats. J Alzheimers Dis. 2016; 53: 259-272.
- Jackson K, Barisone GA, Diaz E, et al. Amylin deposition in the brain: a second amyloid in Alzheimer disease.「脳のアミリン沈着:アルツハイマー病における第2のアミロイド」。 Ann Neurol. 2013; 74: 517-526.
- Oskarsson ME, Paulsson JF, Schultz SW, et al. In vivo seeding and cross-seeding of localized amyloidosis: a molecular link between type 2 diabetes and Alzheimer disease.(「2型糖尿病とアルツハイマー病の分子的関連」)。 The American Journal of Pathology. 2015; 185: 834-846.
- Fu W, Patel A, Jhamandas JH.他。 アミリン受容体:アルツハイマー病と糖尿病における共通の病態生理学的標的。 Front Aging Neurosci. 2013; 5.
- Fu W, Ruangkittisakul A, MacTavish D, et al. Amyloid β (Aβ) peptide directly activates amylin-3 receptor subtype by triggering multiple intracellular signaling pathway.アミロイドβペプチドは細胞内シグナル伝達経路を活性化し、アミリン3受容体サブタイプを直接活性化する。 J Biol Chem. 2012; 287: また、海馬の長期増強の抑制には、アミロイドβ(Aβ)およびヒトアミリンによって誘導されるものがある。 Mol Neurobiol. 2017; 54: 748-754.
- Kimura R, MacTavish D, Yang J, et al. Beta amyloid-induced depression of hippocampal long-term potentiation is mediated through the amylin receptor.海馬の長期増強はアミリン受容体を介して行われる。 J Neurosci. 2012; 32: 17401-17406.
- Zhu H, Wang X, Wallack M, et al. 膵臓ペプチドのアミリン腹腔内注射は、アルツハイマー病モデルマウスにおける行動障害と脳アミロイド病理を強力に抑制した。 Mol Psychiatry. 2015; 20: 252.
- Zhu H, Xue X, Wang E, et al. Amylin receptor ligands reduce the pathological cascade of Alzheimer’s disease.アミリン受容体リガンドはアルツハイマー病の病理学的カスケードを軽減する。 Neuropharmacology. 2017; 119: 170-181.
- Adler BL, Yarchoan M, Hwang HM, et al. アミリンアナログのプラムリンチドのアルツハイマー病病態および認知に対する神経保護作用。 Neurobiol Aging. 2014; 35: 793-801.
- Zhang Z, Hartmann H, Do VM, et al. Presenilin-1の変異によるβ-カテニンの不安定化は、神経細胞のアポトーシスを増強させる. Nature. 1998; 395: 698-702.
- Wang E, Zhu H, Wang X, et al. Amylin Treatment Reduces Neuroinflammation and Ameliorates Abnormal Patterns of Gene Expression in the Cerebral Cortex of an Alzheimer’s Disease Mouse Model.アミリン投与によるアルツハイマー病モデル脳の炎症と異常発現の抑制.1998; 395: 698-702. J Alzheimers Dis. 2017; 56: 47-61.
- Singh-Franco D, Robles G, Gazze D. Pramlintide acetate injection for the treatment of type 1 and type 2 diabetes mellitus.「1型糖尿病および2型糖尿病の治療におけるプラムリンチド酢酸塩注射剤」. Clin Ther. 2007; 29: 535-562.
- Singh?Franco D, Perez A, Harrington C. The effect of pramlintide acetate on glycemic control and weight in patients with type 2 diabetes mellitus and in obese patients without diabetes: a systematic review and meta?analysis.Pramlintide acetate in patients with type 2 diabetes mellitus. 糖尿病、肥満とメタボリズム。 2011; 13: 169-180。
- Hollander PA, Levy P, Fineman MS, et al. Pramlintide as an adjunct to insulin therapy improves long-term glycemic and weight control in patients with type 2 diabetes.インスリン治療の補助療法として、2型糖尿病患者の長期的な血糖値と体重のコントロールを改善する。 Diabetes Care. 2003; 26: 784-790.
- Grizzanti J, Corrigan R, Casadesus G. Neuroprotective Effects of Amylin Analogues on Alzheimer’s Disease Pathogenesis and Cognition.「アルツハイマー病の病態と認知に対するアミリン類似物質の神経保護効果」. J Alzheimers Dis. 2018; 1-13.
- Jhamandas JH, Li Z, Westaway D, et al. Actions of β-amyloid protein on human neurons are expressed through the amylin receptor.ヒト神経細胞に対するβ-アミロイドタンパクの作用はアミリン受容体を介して発現する。 The American Journal of Pathology. 2011; 178: 140-149.
- Soudy R, Patel A, Fu W, et al. Cyclic AC253, a novel amylin receptor antagonist, Improves cognitive deficits in a mouse model of Alzheimer’s disease.「新規アミリン受容体拮抗薬はアルツハイマー病の認知障害を改善する。 アルツハイマー病&認知症。 Translational Research & Clinical Interventions. 2017; 3: 44-56.
- Gebre-Medhin S, Mulder H, Zhang Y, et al. Reduced nociceptive behavior in islet amyloid polypeptide (amylin) knockout mice.アルツハイマー病モデルマウスにおいて、アミリン受容体アンタゴンが認知機能を改善した。 モルブレインレジデンス 1998; 63: 180-183.
- Gingell JJ, Burns ER, Hay DL. Endocrinology. 2014; 155: 21-26.