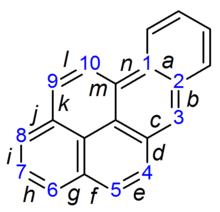
ベンゾピレン、有機化学のIUPAC命名法に従ってベースピレン環と番号付けと環融合位置を示す
神経系編集
ラットの出生前BaP曝露はネズミモデルで学習と記憶に影響を与えることが知られています。 BaPを食べた妊娠ラットは、その子孫の晩生の脳機能に悪影響を及ぼすことが示された。 シナプスが最初に形成され、活動によって強さが調整される時期に、BaPはNMDA NR2B受容体サブユニットのmRNA発現として測定されるNMDA受容体依存性の神経細胞活性を低下させた。
免疫系編集
BaPは白血球数に影響を与え、その一部が感染症と戦う体の最初の防御線となるマクロファージへと分化することを阻害する。 2016年、その分子メカニズムが、膜コレステロールを25%減少させることによるマクロファージ膜の脂質ラフトの完全性の損傷であることが明らかになりました。 これは、IgGと結合し、白血球をマクロファージに変えることができる免疫受容体CD32(Fcファミリーのメンバー)が少なくなったことを意味します。 したがって、マクロファージ膜が細菌感染しやすくなる。
Reproductive systemEdit
雄ラットの実験では、吸入BaPへの亜慢性曝露により、性ステロイド/テストステロンの生産および精子の生産が低下して、一般的に精巣および精巣上体の機能が低下することが示されている。
発がん性編集
BaPの代謝物は変異原性および高い発がん性を有し、IARCによりグループ1の発がん性物質に指定されています。 Chemical agents and related occupations, Volume 10, A review of Human Carcinogens, IARC Monographs, Lyon France 2009
2016年6月に、BaPはベンゾクリセンとしてREACH認可対象高懸念物質候補リストに追加された
1970年代以降の多数の研究によりBaPと癌の関連性が文書化されている。 特にヒトでは、特定のBaP発生源とがんを関連付けることは難しく、様々な暴露方法(吸入または摂取)によってもたらされるリスクを定量化することも困難でした。 2005年に、喫煙者のビタミンA欠乏症と肺気腫の関連性が、ラットのビタミンA欠乏症を誘発するBaPに起因すると説明されました。
1996年の研究では、タバコ煙中の成分を肺がんに関連付ける分子的証拠が提示されました。
調理された肉の定期的な消費は、大腸癌のレベルの増加と疫学的に関連しています(これ自体は発癌性を証明するものではありませんが)、2005年のNCI研究は、大腸腺腫のリスクの増加は、BaP摂取と関連しており、すべての食品からのBaP摂取とより強く関連していたことを発見しました。 しかし、消化管は絶えず外皮を剥いで発がんを防いでいるため、微量の発がん物質が含まれていても、食品自体に発がん性があるとは限りません。 さらに、食品由来の毒素から身を守るために、腸内ではシトクロムP450などの解毒酵素が活性を高めている。 したがって、ほとんどの場合、少量のBaPは血中に移行する前に代謝される。 肺はどちらの方法でも保護されない。
解毒酵素であるチトクロームP450 1A1(CYP1A1)とチトクロームP450 1B1(CYP1B1)は、どちらもベンゾピレン毒性に対して保護的であり、必要な酵素である。 CYP1A1 および CYP1B1 を除去(ノックアウト)したマウス系統を用いた実験から、CYP1A1 は主に低用量の BaP から哺乳動物を保護するように作用し、この保護を除去すると高濃度の BaP が蓄積されることが明らかになった。 CYP1B1もノックアウトしない限り、BaPが究極の毒性化合物であるbenzopyrene -7,8-dihydrodiol-9,10-epoxideに生物活性化され、毒性が生じるのです。
DNAとの相互作用Edit

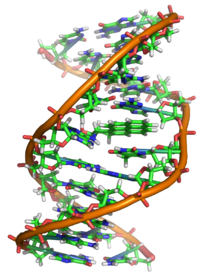
正しくは発がん性物質で、発がんのメカニズムはBaPジオールエポキシドへの酵素的代謝に依存することを意味する。

X 線結晶学および核磁気共鳴構造の研究により、この結合が二重らせん DNA 構造を混乱させ、DNA をどのように歪めるかが明らかにされました。 これは、DNAをコピーする正常なプロセスを混乱させ、突然変異を引き起こすので、被曝後の癌の発生を説明することができます。 この作用機序は、グアニンのN7位に結合するアフラトキシンと類似している。
ベンゾピレンジオールエポキシドは、保護的なp53遺伝子を特異的に標的にしているという指摘がある。 この遺伝子は、細胞周期を制御する転写因子であり、それゆえ腫瘍抑制因子として機能する。 p53内の転座ホットスポットでG(グアニン)→T(チミジン)転座を誘発することにより、ベンゾピレンジオールエポキシドが特定の細胞の腫瘍抑制能を不活性化し、癌に導く可能性がある。
ベンゾピレン-7,8-ジヒドロジオール-9,10-エポキシドは3つの酵素反応による発がん性生成物です:
- ベンゾピレンはまずチトクロームP450 1A1によって酸化され、(+)ベンゾピレン-7,8-エポキシドなど様々な生成物を形成することが分かっています。
- この生成物はエポキシドヒドロラーゼによって代謝され、エポキシド環を開いて(-)ベンゾピレン-7,8-ジヒドロジオールを生成します。
- さらにシトクロムP450 1A1と反応して(+)ベンゾピレン-7,8-ジヒドロジール-9,10-エポキシドが生成すると、究極のがん化物質が形成されます。
BaPは細胞質内のAHR(アリール炭化水素受容体)に結合して、チトクロームP4501A1(CYP1A1)を誘導する。 結合後、形質転換した受容体は核に移行し、ARNT(アリール炭化水素受容体核内移行因子)と二量体化し、特定の遺伝子の上流にあるDNA中の異種物質応答要素(XRE)に結合する。 この過程で、特定の遺伝子、特にCYP1A1の転写が増加し、その後、CYP1A1タンパク質の産生が増加する。 この過程は、ある種のポリ塩化ビフェニルやダイオキシン類によるCYP1A1の誘導と類似している。 腸管粘膜のCYP1A1活性は、摂取されたベンゾピレンが門脈血や全身循環に大量に流入することを防いでいるようだ。 CYP1A1の発現は、肝ではなく腸で、リポテイコ酸などの細菌表面構造に対する真核生物の受容体であるTOLL様受容体2(TLR2)に依存する。
さらに、BaPはヒトでトランスポゾンであるLINE1を活性化することが判明している。