一般人口における腎結石症の発生率と有病率は上昇し続けている。 生涯有病率は最大10%で、腎石症(NL)および腎石灰化症(NC)は、特に欧米諸国において大きな健康負担となっている(1)。 NLおよびNCは、再発、外科的/内視鏡的介入の繰り返し、および炎症の併発により、重大な罹患率と慢性腎臓病への進行と関連しています。 腎結石の形成は、尿中の結晶化阻害物質(クエン酸塩、マグネシウム、ウロモジュリン、ピロリン酸など)と促進物質(シュウ酸塩、カルシウム、リン酸塩、尿酸塩、シスチンなど)の不均衡により、過飽和度を超え、Randallの斑で凝集、核生成、結石成長が連続することにより起こると考えられている(図1)。 このアンバランスは、シュウ酸塩の腸管での不正分泌やカルシウムの腎臓での不正吸収など、促進因子または抑制因子の腸管および腎臓での取り扱いが変化することに起因する(図1)

Figure 1. 腎結石形成につながる尿中インヒビターと結晶化促進因子の不均衡。 尿中のインヒビターとプロモーターの濃度は、腸と腎のトランスポーター(GI-Kidney axis)の影響を受け、コントロールされている。 これらのトランスポーターと交換体、例えばSLC26A1は、分泌と吸収を担っている。 シュウ酸塩に関しては、腸での高吸収と分泌不全、腎での高分泌と吸収不全により、尿中のシュウ酸塩濃度が過飽和度を超え、結晶化を促進し、連続した結石形成が起こる。
NLの根本的な病因は、環境、特に食事、ホルモン、遺伝など多因子に及ぶと考えられている。 双子研究では、腎臓結石の遺伝率は56%と推定されており(3)、高カルシウム尿症結石形成者の最大2/3はNLを有する親族を持つ(4)。 カルシウムを含む腎臓結石は全体の80%以上を占めるが、その遺伝的基盤はまだほとんどわかっていない(5)。 CLDN14、TRPV5、SLC34A1、ALPL、CASR、UMODの変異を除き、ゲノムワイド関連研究では、まだ実質的な遺伝要因は得られていない(6-8)。 しかし、CASR、SLC34A1、SLC2A9など、メンデルベースで本疾患を伝播することが判明した遺伝子内では、リスクアレルが同定されている(9, 10)。 現在までに、Online Mendelian Inheritance in Manで定義された表現型を持つ30以上の単一遺伝子が、変異した場合、NL/NCに関与することが確認されている(表1)

Table 1. NL/NCの単発型の原因となることが知られている遺伝子。
単発型の遺伝様式には、常染色体優性、常染色体劣性、およびX連鎖遺伝が含まれる。 興味深いことに、これらの遺伝子のいくつかでは、劣性遺伝と優性遺伝の両方の様式が報告されている。 SLC7A9、SLC34A1、SLC34A3、SLC2A9、SLC22A12、そしてSLC4A1である。 症候群性疾患や重篤な先天性疾患の多くは劣性遺伝を示すが(Bartter、Lowe、Dent、FHHNC、感音性難聴を伴う遠位尿細管性アシドーシス)、軽症のものはむしろ優性遺伝子の変異が関与していると考えられている。 腎臓の溶質トランスポーター(SLC34A1、SLC34A3、SLC9A3R1など)、クロライドチャネル(CLCN5)、タイトジャンクションタンパク(CLDN16/CLDN19など)、代謝酵素(AGXT、APRT、CYP24A1など)の欠損が認められている。 したがって、根本的な欠陥は、ほとんどが腎臓の尿細管系にあり、それゆえ尿細管障害として帰結させることができる。 逆に、原発性高シュウ酸尿症(PH)のように、肝酵素(AGXT、GRHPR、HOGA1)の機能障害によりシュウ酸が蓄積し、二次的に腎障害を起こす腎外疾患もNL/NCの原因として考えられる。 それぞれの表現型は比較的稀な疾患であると考えられるが、単一遺伝子の場合、遺伝子の不均一性が大きいため、相当数の患者を占めると考えられる(42)。 遺伝的不均質性とは別に、対立遺伝子にも変異があり、トランケート変異はむしろ機能喪失を引き起こし、ミスセンス変異(hypomorph)はむしろ微妙な障害を引き起こすことがあり、特に成人の結核患者では臨床的に観察することが可能である。 もう一つの最近注目されている現象は、前述の腎臓結石遺伝子のいくつかにおける遺伝子投与効果に関するものである。 例えば近位尿細管における主要なリン酸輸送体(NaPiIIc)をコードするSLC34A3では、ヘテロ接合体は野生型よりも有意に頻繁に腎石灰化や骨症状を示すため、もはや健常なキャリアーとは見なされないことが示された(ただし、二重接合体(ホモおよび複合ヘテロ)よりは程度が低い)(43)。 CYP24A1 の変異を持つ家系でも同様のことが報告されている(44)。 腎結石症全体の有病率に対する単発性疾患の寄与については、これまで包括的に検討されてこなかった。 特に、大規模な患者コホートにおける多数の原因遺伝子の広範なスクリーニングに基づく遺伝学的根拠は不足している。 包括的な遺伝子検査は、これまでコストがかかりすぎて非効率的であった。 NL/NCの分子的原因を知ることは、予後、予防、治療にとって重要な意味を持つにもかかわらず、ほとんどのNL/NC患者にとって、原因となる遺伝子異常の変異解析は、それゆえ、手が届かなかったのである。 臨床観察研究からは、大まかな推定値しか得られていない。膨大な数の結石成分分析のデータに基づいて、単原因は小児で9.6%、成人で1.6%を超えないという結論が出された(45)。 しかし、この10年、ハイスループットシーケンス技術の登場により、この状況は変わり始めている。
High-Throughput Mutation Analysis in Patients with NL/NC
腎臓結石症患者の既知の疾患遺伝子における病因変異の有無を調べるために、マイクロ流体マルチプレックスPCRと連続NextGenシーケンス(フルイドーム/NGS)に基づく遺伝子パネルを構築した(46、47)。
「パイロット研究」として、典型的な腎臓結石クリニックから遺伝学的に未解決の268人(小児102人、成人166人)を連続的に募集しました。 その結果,解析した30遺伝子のうち14遺伝子に50の劇症型変異を同定し,全症例の15%で分子診断に至った。 小児では21%、成人では11%に原因変異が検出された(図2A)(48)。 シスチン尿症遺伝子SLC7A9の変異は、成人のコホートで最も頻繁に見つかった(図2B)。 2つのフォローアップ研究により、これらの結果を確認することができた。 まず、143人のNL/NC患者からなる小児だけのコホートでは、症例の17%が14種類の遺伝子における変異で説明された(49)。 第二に、NL/NCの発症年齢が25歳以前の51家族のコホートでは、標的WESにより、ほぼ30%で遺伝的原因が検出された(50)。 当然のことながら、劣性突然変異は新生児や先天性疾患の症例でより頻繁に見つかったが、優性疾患は通常、人生の後半に発現した。 これらのデータは、分子診断が予後、予防、治療に影響を与える可能性があるにもかかわらず、遺伝性腎結石症が過小診断であることを示している。 しかし、言及に値する限界は、前述の3つの研究すべてにおいて腎臓結石専門クリニックから募集したことによる選択バイアスの可能性である

Figure 2. NL/NC患者268人における既知の単原性腎石症(NL)/腎石灰化症(NC)遺伝子30個の変異解析。 (A)小児および成人サブコホートにおける単原因の割合。 (B)遺伝子間の単原因の数(赤は成人、オレンジは小児患者を示す)。 注目すべきは、SLC7A9が特に若年成人において最も頻繁に変異していることがわかった。
候補遺伝子アプローチによる新規ヒト疾患遺伝子の同定
ハイスループット変異解析は、様々な候補遺伝子における病因変異のスクリーニングにも使用されている。 最近の最も興味深い知見の一つは、SLC26A1におけるヒトの変異の発見である(32)。 2010年にDawsonらによってSlc26a1 (Sat1) -ノックアウトマウスにおけるCa-oxalate (CaOx) 腎臓結石の形成とNCが初めて記述されて以来、SLC26A1は真正のNL候補遺伝子とされてきた(51)。 SLC26A1は、近位尿細管、回腸、空腸の側底膜に発現する陰イオン交換体をコードしている。 その結果、候補遺伝子を用いたアプローチにより、早期発症のCaOx-NLの病歴を持つヒト、すなわち二重鎖のミスセンス変異を持つ2人の無関係な個体において、病原性のある変異体が同定された(32)。 機能的には、同定された変異体の病原性はin vitroで証明され、細胞内のミストラフィッキングと輸送活性の低下につながった(32)。 248>
遺伝性腎結石症の新しい臨床患者登録
欧米諸国における有病率の増加に関する疫学データのほとんどは、米国のデータベースに由来している。 緊急に必要ではあるが、欧州の集中的なデータベースは現時点では利用できない。 遺伝性腎結石症の有病率に関する前述の遺伝子研究は、欧米の専門施設からの小規模コホートで実施されたため、欧州の一般的な状況への翻訳は有効ではない。 米国では、Rare Kidney Stone Consortiumが、シスチン尿症、PH、APRT欠損症、Dent、Lowe病などの希少疾患の登録、基礎科学、臨床研究活動を統合、調整するプラットフォームを構成しているが、欧州でもドイツでも、遺伝性腎結石症患者に関する同等のデータ収集は今日まで実施されていない。 このたび、欧州のPHレジストリであるOxalEurope(Bernd Hoppe教授、ボン大学)と協力し、ドイツ研究振興財団とElse Kröner-Fresenius Stiftungからの資金援助を受けて、ライプチヒ大学に臨床患者「遺伝性腎結石症レジストリ」を設立しました。 この登録は、ドイツ成人腎臓病学会(DGfN)と小児腎臓病学会(GPN)の全国的な支援を受けています。 さらに、ドイツ臨床試験登録(DRKS-ID: DRKS00012891)にも登録されています。 研究募集の基本として、既知および新規腎結石遺伝子のハイスループット変異解析は、確立した分子診断がないものの、基礎となる遺伝的感受性を示唆する臨床像を有する患者、例えば、早期発症(<40歳)、陽性家族歴、NC、シスチン尿、RTAなどの示唆的表現型、重度の再発NL(>3×)、などを研究ベースで提供しています(表2)。 遺伝学的診断が確立している患者は一般に登録されるが、悪性腫瘍、サルコイドーシス、原発性副甲状腺機能亢進症などの二次性NL/NC原因症例は遺伝学的解析の対象とはならない。 患者さんを積極的に登録するためには、通常、臨床センターは地域の施設審査委員会の承認を必要とします。このプロセスについて、当社はそれぞれのテンプレートを提供することで支援します。 倫理委員会の承認後、同意書と臨床データシート(例:臨床質問表)は、当社のレジストリサイト(http://www.mks-registry.net)からダウンロードできます。 臨床表現型を徹底するために、民族、血縁、家族歴、発症年齢、再発(推定される新しい腎臓結石事象ごとに定義)、1日の水分摂取量、外科的介入、腎外病変など、実質的な患者情報をお伺いすることにしています。 この書類は、登録医師の協力のもと、患者さんが記入することができます。 さらに、クレアチニン、eGFR、PTH、ビタミンD、電解質、尿酸、尿検査(pH、カルシウム、リン酸、マグネシウム、尿酸、クエン酸、シュウ酸、シスチン、スポット尿でなければ24時間尿から)、結石の組成分析に関するデータなどの生化学血清パラメータが、登録時に要求されることになる。 24時間採尿と結石成分分析はすべての施設でルーチンに行われているわけではないことを考慮し、利用可能な場合はこれらのパラメータを含める。 登録された患者さんの2年ごとの臨床経過観察が望ましいが、必須ではありません。 登録後、参加施設には、登録用ウェブサイト(http://www.mks-registry.net)から患者データを入力するための個人用ログインが提供される。 また、紙で送られてきたデータを電子的に入力することも可能です。 入力されたデータは保護されたサーバーに保存され、参加臨床施設がアクセスして自身の患者データを閲覧することができます。 詳細は以下のサイトをご参照ください:
https://www.dgfn.eu/hereditaere-nierensteinleiden.html
https://www.drks.de/drks_web/navigate.do?navigationId=trial.HTML&TRIAL_ID=DRKS00012891
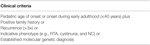
Table 2. 248>
要約すると、腎臓結石症は、臨床的に不均一で、特にその遺伝的要因については十分に理解されていない、ますます一般的になっている疾患であるということである。 最近の一連の研究が示すように、単原性の疾患は有病率が過小評価されている可能性が高い。 遺伝性腎結石症に関する集中患者登録の実施により、腎結石症の遺伝学に関する膨大な知識ギャップを少なくとも部分的には克服することに貢献することができると考えています。 第一に、表現型と遺伝子型の関連をより明確にすることは、将来の臨床研究において、より正確な患者層別化を行うために極めて重要であろう。 第二に、新しい疾患メカニズムと新しい疾患遺伝子を同定することは、NL/NCの病因が不明であるというギャップを減らすことになり、第三に、新しい分子標的を解読することは、重症患者家族に対する再発予防薬の開発に道を開くのに役立つ。 すべての被験者は、ヘルシンキ宣言に基づき、書面でのインフォームドコンセントを行った。 プロトコルはEthikkommission an der Medizinischen Fakultät der Universität Leipzigによって承認された」
Author Contributions
JHは原稿を構想し執筆した。 BH、AS、LM、RSは原稿を編集し、読者に紹介するレジストリのインフラを構築した。
利益相反声明
著者は、本研究が利益相反の可能性として解釈できるいかなる商業的または金銭的関係もない状態で行われたことを宣言している。
Funding
本研究は、DFG (HA 6908/2-1) およびEKFS (2016_A52) からJHへのプロジェクト助成金によって行われたものである。 本研究はさらに、ドイツ連邦教育研究省(BMBF)、FKZ: 01EO1501 からJH.
1 の支援を受けています。 Scales CD Jr.、Smith AC、Hanley JM、Saigal CS. 米国における腎臓結石の有病率。 Eur Urol (2012) 62:160-5.
Google Scholar
2. Pfau A, Knauf F. Update on nephrolithiasis: core curriculum 2016.腎結石症に関する最新情報。 Am J Kidney Dis (2016) 68:973-85. doi:10.1053/j.ajkd.2016.05.016
CrossRef Full Text | Google Scholar
3. Goldfarb DS, Fischer ME, Keich Y, Goldberg J. A twin study of genetic and dietary influences on nephrolithias: a report from the Vietnam Era Twin (VET) Registry. Kidney Int (2005) 67:1053-61. doi:10.1111/j.1523-1755.2005.00170.x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Stechman MJ, Loh NY, Thakker RV.の双子研究. 高カルシウム尿素性腎結石症の遺伝学:腎結石症. Ann N Y Acad Sci (2007) 1116:461-84. doi:10.1196/annals.1402.030
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Sayer JA. カルシウム含有腎石症の遺伝学的理解への進展。 J Am Soc Nephrol (2017) 28:748-59. doi:10.1681/ASN.2016050576
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Thorleifsson G, Holm H, Edvardsson V, Walters GB, Styrkarsdottir U, Gudbjartsson DF, et al. CLDN14遺伝子における配列変異と腎結石および骨ミネラル密度の関連性. Nat Genet (2009) 41:926-30. doi:10.1038/ng.404
PubMed Abstract | CrossRef Full Text | Google Scholar
7.Gudbjartsson DF, Holm H, Indridason OS, Thorleifsson G, Edvardsson V, Sulem P, et al.Association of variants at UMOD with chronic kidney disease and kidney stone -role of age and comorbid diseases.UMODの変異体と腎結石との関連。 PLoS Genet (2010) 6:e1001039. doi:10.1371/journal.pgen.1001039
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Oddsson A, Sulem P, Helgason H, Edvardsson VO, Thorleifsson G, Sveinbjörnsson G, et al. 腎石と生化学形質に関する共通および稀少バリアント. Nat Commun (2015) 6:7975. doi:10.1038/ncomms8975
CrossRef Full Text | Google Scholar
9.を参照。 Döring A, Gieger C, Mehta D, Gohlke H, Prokisch H, Coassin S, et al. SLC2A9 influences uric acid concentrations with pronounced sex-specific effects.尿酸濃度に影響を及ぼすSLC2A9の性差を明らかにした。 Nat Genet (2008) 40:430-6. doi:10.1038/ng.107
PubMed Abstract | CrossRef Full Text | Google Scholar
十. グルコーストランスポーター9遺伝子SLC2A9の変異は、腎性低尿酸血症を引き起こす。 Am J Hum Genet (2008) 83:744-51. doi:10.1016/j.ajhg.2008.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
11.邦訳:「グルコーストランスポーター遺伝子変異による腎性貧血」。 Reed BY, Gitomer WL, Heller HJ, Hsu MC, Lemke M, Padalino P, et al. 吸収性高カルシウム尿症表現型と低い脊椎骨密度に関連する塩基置換遺伝子の同定と特徴付けを行った。 J Clin Endocrinol Metab (2002) 87:1476-85. doi:10.1210/jcem.87.4.8300
PubMed Abstract | CrossRef Full Text | Google Scholar
12.を参照。 パデューPE、オールソップJ、イサヤG、ローゼンバーグLE、ダンプアCJ. 高尿酸血症患者におけるペルオキシソームL-アラニン:グリオキシル酸アミノトランスフェラーゼのミトコンドリアへのミスターゲットは、点変異による暗号化ミトコンドリア標的配列の活性化によって決まる。 このような場合、「臓器特異的」であることが重要である。 Hidaka Y, Palella TD, O’Toole TE, Tarlé SA, Kelley WN. ヒトアデニンホスホリボシルトランスフェラーゼ。 酵素の完全欠損の原因としてヌクレオチドレベルの対立遺伝子変異を同定した。 J Clin Invest (1987) 80:1409-15. doi:10.1172/JCI113219
CrossRef Full Text | Google Scholar
十四. Smith AN, Skaug J, Choate KA, Nayir A, Bakkaloglu A, Ozen S, et al. 新しい腎臓液胞プロトンポンプ116kDサブユニットをコードするATP6N1Bの変異は、聴力を維持した劣性の遠位尿細管性アシドーシスを引き起こす。 Nat Genet (2000) 26:71-5. doi:10.1038/79208
PubMed Abstract | CrossRef Full Text | Google Scholar
15.を参照。 Karet FE, Finberg KE, Nelson RD, Nayir A, Mocan H, Sanjad SA, et al. H+-ATPaseのB1サブユニットをコードする遺伝子に変異があると感音性難聴を伴う腎尿細管性アシドーシスが生じる。 Nat Genet (1999) 21:84-90. doi:10.1038/5022
PubMed Abstract | CrossRef Full Text | Google Scholar
十六. Venta PJ, Welty RJ, Johnson TM, Sly WS, Tashian RE. ベルギー人家族における炭酸脱水酵素II欠損症候群は不変のヒスチジン残基(107 His→Tyr)の点変異によって引き起こされる:正常ヒトCA II遺伝子の完全構造。 Am J Hum Genet (1991) 49:1082-90.
Google Scholar
17. Pearce SH, Williamson C, Kifor O, Bai M, Coulthard MG, Davies M, et al. カルシウムセンシング受容体の変異による高カルシウム尿症を伴う家族性低カルシウム血症症候群。 N Engl J Med (1996) 335:1115-22. doi:10.1056/NEJM199610103351505
PubMed Abstract | CrossRef Full Text | Google Scholar
18.C. (1996) 335:1115-22. Lloyd SE, Pearce SH, Fisher SE, Steinmeyer K, Schwappach B, Scheinman SJ, et al. 3つの遺伝性腎臓結石症に共通する分子的基盤。 Nature (1996) 379:445-9. doi:10.1038/379445a0
PubMed Abstract | CrossRef Full Text | Google Scholar
19.を参照。 Simon DB, Bindra RS, Mansfield TA, Nelson-Williams C, Mendonca E, Stone R, et al. クロライドチャネル遺伝子、CLCNKBの変異はIII型バーター症候群の原因となる。 Nat Genet (1997) 17:171-8. doi:10.1038/ng1097-171
CrossRef Full Text | Google Scholar
20.を参照。 Simon DB, Lu Y, Choate KA, Velazquez H, Al-Sabban E, Praga M, et al. Paracellin-1, a renal tight junction protein required for paracellular Mg2+ resorption.(パラセリン1、腎臓タイトジャンクションタンパク質、パラセル性Mg2+吸収に必要)。 Science (1999) 285:103-6. doi:10.1126/science.285.5424.103
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Konrad M, Schaller A, Seelow D, Pandey AV, Waldegger S, Lesslauer A, et al. タイトジャンクション遺伝子クローディン19(CLDN19)の変異は、腎マグネシウム消耗症、腎不全、重度の眼病変と関連しています。 Am J Hum Genet (2006) 79:949-57. doi:10.1086/508617
PubMed Abstract | CrossRef Full Text | Google Scholar
22.を参照。 Schlingmann KP, Kaufmann M, Weber S, Irwin A, Goos C, John U, et al. CYP24A1の変異と特発性幼児性高カルシウム血症. N Engl J Med (2011) 365:410-21. doi:10.1056/NEJMoa1103864
CrossRef Full Text | Google Scholar
23.を参照。 Jaureguiberry G, De la Dure-Molla M, Parry D, Quentric M, Himmerkus N, Koike T, et al. 常染色体劣性FAM20A変異によるネフロカルシノーシス(エナメル腎症).Nephrocalcinosis, et al. Nephron Physiol (2012) 122:1-6. doi:10.1159/000349989
PubMed Abstract | CrossRef Full Text | Google Scholar
24.を参照。 Cramer SD、Ferree PM、Lin K、Milliner DS、Holmes RP. ヒドロキシピルビン酸還元酵素をコードする遺伝子(GRHPR)はII型原発性高シュウ酸尿症患者で変異している。 Hum Mol Genet (1999) 8:2063-9. doi:10.1093/hmg/8.11.2063
PubMed Abstract | CrossRef Full Text | Google Scholar
25.を参照。 Hamilton AJ, Bingham C, McDonald TJ, Cook PR, Caswell RC, Weedon MN, et al. HNF4A R76W変異はβ細胞表現型に加え、非定型優性ファンコニー症候群を引き起こす。 J Med Genet (2014) 51:165-9. doi:10.1136/jmedgenet-2013-102066
CrossRef Full Text | Google Scholar
26.を参照。 Belostotsky R, Seboun E, Idelson GH, Milliner DS, Becker-Cohen R, Rinat C, et al. DHDPSLの変異はIII型原発性高シュウ酸尿症の原因である. Am J Hum Genet (2010) 87:392-9. doi:10.1016/j.ajhg.2010.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
27.を参照。 Davidson BL, Tarlé SA, van Antwerp M, Gibbs DA, Watts RW, Kelley WN, et al. Human hypoxanthine-guanine phosphoribosyltransferase (HPRT) deficiency に関わる17の独立した変異の同定(Identification of 17 independent mutations responsible for human hypoxanthine-guanine phosphoribosyltransferase). Am J Hum Genet (1991) 48:951-8.
PubMed Abstract | Google Scholar
28. Simon DB, Karet FE, Rodriguez-Soriano J, Hamdan JH, DiPietro A, Trachtman H, et al. K+チャネル、ROMKの変異により明らかになったバーター症候群の遺伝的異質性(Genetic heterogeneity of Bartter’s syndrome revealed by mutations in the ROMK.) Nat Genet (1996) 14:152-6. doi:10.1038/ng1096-152
CrossRef Full Text | Google Scholar
29. Laghmani K, Beck BB, Yang S-S, Seaayfan E, Wenzel A, Reusch B, et al. 多乳房症、一過性出生前バルター症候群、MAGED2変異。 N Engl J Med (2016) 374:1853-63. doi:10.1056/NEJMoa1507629
PubMed Abstract | CrossRef Full Text | Google Scholar
30.を参照。 Reilly DS, Lewis RA, Ledbetter DH, Nussbaum RL. Lowe眼球脳腎症候群の緊密にリンクしたフランキングマーカー、保因者評価への応用。 Am J Hum Genet (1988) 42:748-55.
PubMed Abstract | Google Scholar
31. Simon DB, Karet FE, Hamdan JM, DiPietro A, Sanjad SA, Lifton RP. Bartter症候群(高カルシウム尿症を伴う低カリウム血症)は、Na-K-2Cl共輸送体NKCC2の変異によって引き起こされる。 Nat Genet (1996) 13:183-8. doi:10.1038/ng0696-183
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Gee HY, Jun I, Braun DA, Lawson JA, Halbritter J, Shril S, et al. SLC26A1の変異は腎臓結石症を引き起こす。 Am J Hum Genet (2016) 98:1228-34. doi:10.1016/j.ajhg.2016.03.026
PubMed Abstract | CrossRef Full Text | Google Scholar
33.を参照。 榎本 淳、木村 浩、Chairoungdua A、重田 泰、Jutabha P、Cha SH、他 血中尿酸値を制御する腎臓尿酸アニオン交換体の分子同定。 Nature (2002) 417:447-52. doi:10.1038/nature742
PubMed Abstract | CrossRef Full Text | Google Scholar
34.を参照。 Prié D, Huart V, Bakouh N, Planelles G, Dellis O, Gérard B, et al. 2a 型ナトリウム-リン酸共輸送体の変異による低リン酸血症に伴う腎石症および骨粗鬆症。 N Engl J Med(2002)347:983-91。 doi:10.1056/NEJMoa020028
PubMed Abstract | CrossRef Full Text | Google Scholar
35.NEJMoa020028
35.NEJMoa020028。 高カルシウム尿症を伴う遺伝性低リン酸血症性くる病は、ナトリウム-リン酸共輸送体遺伝子SLC34A3の変異によって引き起こされる。 Am J Hum Genet (2006) 78:193-201. doi:10.1086/499410
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Calonge MJ, Gasparini P, Chillarón J, Chillón M, Gallucci M, Rousaud F, et al. シスチンの輸送に関与する遺伝子、rBATの変異によるシスチン尿症. Nat Genet (1994) 6:420-5. doi:10.1038/ng0494-420
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bruce LJ, Cope DL, Jones GK, Schofield AE, Burley M, Povey S, et al. 家族性遠位尿細管性アシドーシスは赤血球アニオン交換体(Band 3, AE1)遺伝子における変異と関連している。 J Clin Invest (1997) 100:1693-707. doi:10.1172/JCI119694
CrossRef Full Text | Google Scholar
38. Feliubadaló L, Font M, Purroy J, Rousaud F, Estivill X, Nunes V, et al. rBATのサブユニット(bo,+AT)をコードするSLC7A9の突然変異による非I型シスチン尿症。 Nat Genet (1999) 23:52-7. doi:10.1038/12652
PubMed Abstract | CrossRef Full Text | Google Scholar
39.邦題:非典型I型シスチン尿症。 Karim Z, Gérard B, Bakouh N, Alili R, Leroy C, Beck L, et al. NHERF1変異と腎臓副甲状腺ホルモンの反応性. N Engl J Med (2008) 359:1128-35. doi:10.1056/NEJMoa0802836
PubMed Abstract | CrossRef Full Text | Google Scholar
40.を参照。 Scott P, Ouimet D, Valiquette L, Guay G, Proulx Y, Trouvé ML, et al. 特発性カルシウム結石形成におけるビタミンD受容体遺伝子座付近の感受性遺伝子に関する示唆に富む証拠. J Am Soc Nephrol (1999) 10:1007-13.
PubMed Abstract | Google Scholar
41. ヒトのキサンチンデヒドロゲナーゼ遺伝子に2つの変異があり、それが古典的なI型キサンチン尿症の原因となっていることを明らかにした。 J Clin Invest (1997) 99:2391-7. doi:10.1172/JCI119421
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Hildebrandt F. Genetic kidney diseases. Lancet (2010) 375:1287-95. doi:10.1016/S0140-6736(10)60236-X
CrossRef Full Text | Google Scholar
43.遺伝性腎臓病(Lancet (2010) 375:1287-95. Dasgupta D, Wee MJ, Reyes M, Li Y, Simm PJ, Sharma A, et al. SLC34A3/NPT2cの変異は腎結石およびネフロカルシノーシスと関連している。 J Am Soc Nephrol (2014) 25:2366-75. doi:10.1681/ASN.2013101085
PubMed Abstract | CrossRef Full Text | Google Scholar
44.を参照。 オキーフDT、テッベンPJ、クマールR、シンRJ、ウーY、ワーマーズRA. モノアレリックおよびバイアレイのCYP24A1変異を有する成人の臨床的および生化学的表現型:遺伝子用量効果のエビデンス。 Osteoporos Int (2016) 27:3121-5. doi:10.1007/s00198-016-3615-6
PubMed Abstract | CrossRef Full Text | Google Scholar
45.を参照。 Jungers P, Joly D, Blanchard A, Courbebaisse M, Knebelmann B, Daudon M. Lithiases rénales héréditaires monogéniques.(単発性リチウムイオン病)。 Récents acquis diagnostiques et thérapeutiques. 腎臓内科 (2008) 4:231-55. doi:10.1016/j.nephro.2007.12.005
CrossRef Full Text | Google Scholar
46.邦訳なし。 ネフロンフィシス関連繊毛症患者における、多重バーコードアレイを用いたPCR増幅と次世代シーケンシングによるハイスループットな変異解析。 J Med Genet (2012) 49:756-67. doi:10.1136/jmedgenet-2012-100973
PubMed Abstract | CrossRef Full Text | Google Scholar
47.を参照。 Halbritter J, Porath JD, Diaz KA, Braun DA, Kohl S, Chaki M, et al. ネフロンフィシス関連繊毛症の患者1,056人の世界的コホートにおける99件の新規変異の同定。 Hum Genet (2013) 132:865-84. doi:10.1007/s00439-013-1297-0
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Halbritter J, Baum M, Hynes AM, Rice SJ, Thwaites DT, Gucev ZS, et al. 14の単原性遺伝子が腎石症/腎石灰化症の15%を占めている。 J Am Soc Nephrol (2015) 26:543-51. doi:10.1681/ASN.2014040388
CrossRef Full Text | Google Scholar
49. Braun DA, Lawson JA, Gee HY, Halbritter J, Shril S, Tan W, et al. 腎石症または腎石灰化症を有する小児患者における単発性原因の有病率. Clin J Am Soc Nephrol (2016) 11:664-72. doi:10.2215/CJN.07540715
PubMed Abstract | CrossRef Full Text | Google Scholar
50.を参照。 Daga A, Majmundar AJ, Braun DA, Gee HY, Lawson JA, Shril S, et al. Whole exome sequencing frequently detects a monogenic cause in early onset nephrolithiasis and nephrocalcinosis.早期発症の腎結石症およびネフロカルシノーシスにおける単原因を検出する全エキソームシークエンス。 Kidney Int (2018) 93:204-13. doi:10.1016/j.kint.2017.06.025
CrossRef Full Text | Google Scholar
51.を参照。 Dawson PA, Russell CS, Lee S, McLeay SC, van Dongen JM, Cowley DM, et al. Urolithiasis and hepatotoxicity are linked to the anion transporter Sat1 in mice.マウスの尿石症および肝毒性は陰イオン輸送体Sat1との関連がある。 J Clin Invest (2010) 120:706-12. doi:10.1172/JCI31474
PubMed Abstract | CrossRef Full Text | Google Scholar
.