はじめに
裸子植物または基底のStreptophytes; (Becker and Marin, 2009; Leliaert et al, 2012)は、現存する淡水および陸上の緑藻類の多様な分類学的品揃えを構成し、単細胞、糸状、および「柔組織性」の幅広い形態を示す(Graham、1993;Lewis and McCourt、2004)。 4億5000万〜5億年前に陸上に出現し、植民地化したシャロフィットの祖先の系統がある。 これらの生物は陸上条件に適応し、大気に完全にさらされた状態でも生存・繁殖できるようになり、一部のメンバーは最終的に陸上植物に進化した(Zhong et al.、2013;Delwiche and Cooper、2015)。 この緑色植物の「地上化」は、地球の生物地球化学と自然史を永遠に変える、重要な生物学的イベントであった。 その後の陸上植物の増殖は、大気の状態を変え、さらに土壌の状態を変化させ、他の多様な生命体の陸上への出現を可能にした。 また、陸上植物の進化は、農業の革新とそれに伴う現代文明の創造を通じて、人類の歴史に最も大きな変化をもたらした。 その進化的意義もあって、過去数十年にわたり、シャロフィットは植物生物学者から大きな注目を集めてきた(Pickett-Heaps and Marchant, 1972; Pickett-Heaps, 1975; Mattox and Stewart, 1984; Becker and Marin, 2009; Harholt et al.、2016)。 しかし、これらの藻類の生物学に関する追加の新しいデータが集まるにつれて、生化学、細胞生物学、発生生物学、生態学、そしてますます分子生物学における基本的な現象を理解するための重要なモデルとなっている(Delwiche and Cooper, 2015; Lemieux et al.、2016)。 Frontiers in Plant Scienceの「Charophytes」シリーズは、植物生物学研究のいくつかの特定分野におけるこれらの生物の重要性を示している。 このミニレビューでは、多様な研究分野におけるモデル生物としてのシャロフィテスの特質を強調する。 7022>
The “Line-Up” of Charophytes
1970年代から1980年代にかけて、超微細構造(e.g…, 1970年代から1980年代にかけて、超微細構造(例:細胞分裂の仕組み、鞭毛装置の下部構造)や生化学(例:酵素プロファイル)のデータが、緑藻類をシャロフィテスの系統に含めるための主な基準となっていた(Mattox and Stewart, 1984; Lewis and McCourt, 2004; Leliaert et al.) 1990年代から今日に至るまで、葉緑体・核ゲノムやトランスクリプトームの分子解析に焦点を当てた研究により、以前の分類学的・系統学的スキームが再確認され、洗練されてきた(Timme et al., 2012; Delwiche and Cooper, 2015)。 さらに、生化学、免疫学、細胞生物学に基づく、イワナ科植物の細胞壁やホルモン生合成・シグナル伝達経路の詳細な解析によって補完されてきた(Popper and Fry, 2003; Popper, 2008; Sørensen et al, 2010, 2011, 2012; Zhang and van Duijn, 2014; Ju et al, 2015; O’Rourke et al, 2015)。 現存するシャロフィットは、他の緑藻類分類群に比べ比較的低い多様性の割合を示し、13科122属を包含する(Becker and Marin, 2009; Leliaert et al.) 現在の系統学的見解では、シャロフィテスは6つのクラスに分類されている(図1;Delwiche and Cooper, 2015)。 基本的なクラスであるメソスティグマトフィカス科は、メソスティグマという1つの属が知られている。 この藻類は単細胞の二鞭毛虫で、独特の非対称な形状(すなわち、扁平な救命ボートのような形状)を持ち、装飾的なデザインの鱗片の層で覆われている(Manton and Ettl, 1965; Becker et al, 1991; Domozych et al, 1991, 1992)。 第二のクラスであるクロロキブソウ科も、クロロキブソウatmophyticusという1つの型が知られている。 この稀な藻類は、厚いゲル状の被覆に囲まれた細胞のサルシノイドパケットを形成する(Rogers et al., 1980)。 なお,別の系統樹ではメソスティグマとクロロキバスは姉妹系統とされ,他のすべての連鎖植物と姉妹関係にある (Rodríguez-Ezpeleta et al., 2007)。 6つのクラスからなる系統樹のうち、第3のクラスであるKlebsormidiophyceaeは3属からなり、単純な非分岐の糸を形成し(Sluimanら、2008)、しばしば様々な陸上生息地の表面に生える「生物クラスト」の一員となる。 このクラスのいくつかの種は、砂漠の地殻の一部である場合、著しい乾燥ストレスにさえ耐えることができる(Mikhailyuk et al, 2008, 2014; Holzinger and Karsten, 2013)。 これら最初の3つのクラスは、「初期分岐型」のシャロフィットを構成している。 後期分岐」の系統にも3つのクラスがある。 シャジクモ類は、淡水域の生態系でよく見られる植物で、非常に細長い細胞からなる分岐したフィラメントの集合体である巨視的な多細胞体を持っている(Lewis and McCourt, 2004)。 このグループの仲間は、運動性の精子と運動性のない卵を多細胞の配偶子で産生する、卵生学的有性生殖を行う。 Coleochaetophyceaeは、分岐した糸状または柔細胞状の多細胞の距骨を持つ分類群からなる(Graham, 1993; Delwiche et al.、2002)。 これらの生物はまた、明確な卵生制の有性生殖を示す。 これらの植物は,淡水域と陸域の境界に生息し,しばしば着生植物として見られる。 最後に、最も大きく多様なシャロフィツ類のグループであるZygnematophyceaeは、単細胞と非分岐糸からなる(Gontcharovら, 2003; Guiry, 2013)。 このグループの特徴は、複雑な細胞間シグナル伝達と接着を必要とする抱合型有性生殖の存在である(Abe et al.、2016)。 zygnematophycean algaeは、淡水生息地によく生息し、時には壮大な刹那的ブルームで発生し、また湿った陸上基質にも生息する

FIGURE 1. 現存するチャロフィツム類。 現存するチャロフィツム類は初期分岐分類と後期分岐分類に分けられる。 初期分岐の分類群にはメソスティグマトフィカス門,クロロキプシス門,クレブスモルディフィカス門があり,後期分岐の分類群にはシャロフィカス門,コレオケトフィカス門,ズィグネマトフィカス門が含まれる。 各グループの代表的なものは、Mesostigma (Mesostigmatophyceae), Chlorokybus atmophyticus (Chlorokybophyceae), Klebsormidium flaccidum (Klebsormidiophyceae), Chara (Charophyceae), Coleochaete scutata (Coleochaetophyceae) and Micrasterias (Zygnematophyceae) である。
Charophytes as Model Organisms
Several charophytes has been widely used as model organisms in study of basic biological processes.これは、いくつかのCharophytesが基本的な生物過程の研究に広く使用されていることを意味する。 陸上植物と比較して、小型で単純な葉身と、実験操作が容易であることは、魅力的なモデル生物であることの2つの特徴に過ぎない。 また、最近の証拠により、多くの生長調節物質の生合成経路の存在(図2; Boot et al., 2012; Hori et al., 2014; Wang et al., 2014, 2015; Holzinger and Becker, 2015; Ju et al., 2015)や複数の細胞壁ポリマー(Popper, 2008; Sørensen et al., 2010, 2011, 2012; Mikkelsen et al., 2014)などの陸上植物と著しく似た特徴を有することが証明されています。 この2つの特徴により、植物の分子発生やストレス生理学などの研究分野で、シャロフィットは有効な存在となっている。 多くのシャロフィテスが広範な生物学的研究に使用されているが、以下の分類群は、モデルとして複数の研究分野で広範囲に使用されている点で最も注目に値する:
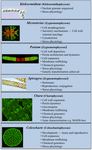
FIGURE 2. 現行モデルのシャロフィツム。 Klebsormidium、Micrasterias、Penium、Spirogyra、Chara、およびColeochaeteを含むいくつかのCharophytesがモデルとして使用されており、それぞれが特定の生理学的および生化学的プロセスのために特に適したモデルとなる特定の属性を持っている。
Desmids: The Symmetrical Models
Zygnematophyceae は最近、陸上植物に最も近い生きた祖先である可能性が示されています(Wodniok et al, 2011; Delwiche and Cooper, 2015)。 包括的なプラコデルムデスミッド群の単細胞のメンバーは、植物の細胞生物学と発生の多くの基本原理を解明するための重要なモデルとなっている。 大きな細胞サイズ、顕著な対称性/形状、明確な細胞壁構造、精巧な内膜/細胞骨格系は、細胞生理学と発生を研究するための優れた細胞系となる特徴のほんの一部である。 近年、安定した形質転換系統が確立され、一部のデスミドのゲノム/トランスクリプトームがまもなく解読されることにより、植物学的研究におけるその価値はさらに高まっている。 7022>
Micrasteriasは、そのユニークな特徴から、過去50年間、細胞生物学研究において最も人気のあるデスミッドである(Meindl, 1993; Lutz-Meindl, 2016)。 Micrasteriasの細胞は、しばしば壮大に解剖された(すなわち、多葉)周辺部によって強調される両側対称性を示す。 細胞分裂によって生じる新しい娘半球は、このような複雑な形態を持たず、むしろ球状である。 細胞運動後の複雑な発生プログラムが、高度に連携した複数の細胞内メカニズムを用いて、娘半球の拡大時に多葉形状の表現型を生み出すのである。 このプログラムはまた、一次および二次細胞壁の生成のためのポリマーの沈着にも関与している。 これらのイベントは、ゴルジ体と関連する小胞の大規模なネットワークを中心として、複雑な分泌機構をもたらす。 このプロセスは、次に、多極性細胞の膨張と細胞壁高分子と細胞外粘液の同時分泌を生み出す特定の細胞表面部位に照準を合わせる(Kimら、1996; Lutz-Meindl and Brosch-Salomon, 2000; Oertelら, 2004; Aichinger and Lutz-Meindl, 2005)。 分泌成分の正確な細胞表面位置への送達は、精巧なアクチノミオシンベースのサイトモタイルシステムを必要とし、いくつかのシグナル伝達カスケードによって制御されている(Meindlら、1994;Oertelら、2003)。 さらに、細胞の形態形成は外部ストレス(酸化ストレス、塩分、重金属など)に対して非常に敏感で、細胞分化に大きな変化をもたらす(Darehshouri et al., 2008; Affenzeller et al., 2009; Andosch et al.) ミクロステリアスは、実験室での維持と操作が容易であり、免疫細胞化学、集束イオンビーム走査型電子顕微鏡(FIB-SEM)および電子エネルギー損失分光法(EELS)イメージングを含む光および電子顕微鏡を用いた高解像度イメージングの取得に特に適しているため、これらの細胞内特徴を分析するための優れた生物です(Lutz-Meindl、2007;Eder and Lutz-Meindl, 2008, 2010;Wannerら、2013;Lutz-Meindlら、2015)。 さらに、形質転換細胞株の生産を含む初期の分子解析は、特に細胞壁処理の分子力学におけるMicrasteriasの使用をさらに強化した(Vannerumら、2010、2011、2012)。
過去10年間に、デスミド、Penium margaritaceumも貴重なモデル生物となった(Domozychら、2009、2014、Sørensenら、2014、Rydahlら、2015;Wordenら、2015)。 Micrasteriasとは異なり、Peniumは単純な円筒形をしており、一次細胞壁のみを有し、膨張時に細胞表面の特定の2箇所に壁ポリマーを沈着させる(Domozych et al.、2011)。 この相対的な単純さは、細胞壁の発達、細胞の膨張、分泌物の動態など、植物細胞の発達の基本原理を解明する上で非常に魅力的である(Domozych et al, 2005, 2014; Ochs et al, 2014)。 その主な特徴の一つは、多くの陸上植物に存在するものと同様の壁ポリマー(セルロース、ペクチン、ヘミセルロースなど)を有し、これらのポリマーをモノクローナル抗体で標識できることである。 生細胞を標識した後、これらを培養に戻し、その後の細胞膨張と壁堆積のイベントをモニターすることができる(Domozychら、2009年;Rydahlら、2015年)。 ペニウムはまた、実験室での維持が容易であり、正確に制御された条件下での速い成長速度は、多くの化学薬剤の大規模な同時マイクロアレイスクリーニング(マルチウェルプレートでの成長による)および拡大/壁の発達に対するそれらの特定の効果の評価のための優れた試料となる(Wordenら、2015年)。 これは、膨張/分化における特定の細胞内成分やプロセスの役割を明らかにする上で著しく役立つ。 近年、安定な形質転換株の単離(Sørensen et al.、2014)により、今後の植物細胞研究におけるこの藻の可能性がさらに高まっている。
Chara and Nitella: 植物生理学のための細胞の巨人
CharaとNitella(Charophyceae)の種は、特に細胞のダイナミクス、拡張、細胞質ストリーミングを扱う様々な生物学的調査のための標本として長い間使用されてきた(Green、1954;ProvineとPreston、1962)。 その巨視的な体節は,枝や配偶子が生じる節と,例外的に細長い細胞からなる節間領域とで区別される。 節間細胞は、細胞内成分の層状化が顕著で、らせん状の葉緑体が静止した皮質を形成し、その皮質がアクチノミオシンによる細胞質流動を最も速く記録するエンドプラズムを取り囲むように存在する。 細胞質は、複雑なシグナル伝達カスケードによって制御される動的な膜輸送ネットワーク(例えば、エンドサイトーシスおよびエキソサイトーシス)に参加する多様な内膜成分を含む(Foissner and Wastenys, 2000, 2012, 2014; Sommer et al, 2015; Foissner et al, 2016)。 節間細胞は、セルロースとペクチンであるホモガラクチュロナン(HG)に富む細胞壁を持っている。 Turgorは膨張の主な駆動力であり、ペクチンは壁の膨張を制御する耐荷重成分である可能性が最も高い。 HGの周期的、非酵素的変調と同時のカルシウム複合化は、細胞膨張につながる壁の変調を制御するメカニズムである(Proseus and Boyer, 2007, 2008, 2012; Boyer, 2016)。 細胞研究においてCharaとNitellaの技術的な利点の1つは、節間細胞を個別に除去できることである。
根粒のような他の距骨の構成要素は、細胞質の組織化された極性組織を持つ。 これらの細胞は、重力知覚に機能する、頂点に位置する沈殿性でミネラルに富むスタトリスを含んでいる(Hodick et al.、1998;Braun、2002;Braun and Limbach、2006)。 この特徴により、Charaは宇宙で最初のシャロフィツとなった。 TEXUSロケットのパラボリックフライトの際、静止石がアクチンフィラメントに引張力を与えることが示された。 重力とそれに対抗するアクチンフィラメントの力のバランスが、静止石を根粒の中に正しく位置させ、重力ベクトルに対応する能力を保証している(Braun and Limbach, 2006)。 レーザーピンセットと低速回転遠心機による顕微鏡観察により、根粒の沈降は根粒の先端を重力で曲げるには不十分であることが明らかになった。 むしろ、重力学的形態学的効果が進行するためには、ミネラルに富むスタトリスが細胞膜の特定の領域に沈降する必要がある(Braun, 2002)。 Charaはまた、電気生理学やホルモンの役割と動きを含む他の現象の研究にも用いられている(Belby, 2016)。
Coleochaete for Developmental Studies and Pattern Development
植物の多細胞体(すなわち、組織、器官)の形成には、発生中の特定の時点で発現する複数セットの遺伝子によって制御された正確かつ空間的に制御された細胞分裂平面が必要です(Besson and Dumais, 2011; Umen, 2014)。 3次元空間と時間の両方で制御される距骨の形態形成は、外部ストレス要因に応答して変化する。 植物では、細胞の移動や組織の柔軟性を許さない細胞壁の存在により、これらの発生プログラムはさらに複雑なものとなっている。 陸上植物では、非常に複雑で拡張性の高い組織・器官に埋め込まれているため、特定の細胞の挙動の解像度が低いことが多く、距骨の形や大きさの発現の中心となる事象の解明が困難であった。 そのため、よりシンプルな距 離を持つ生物の利用は、基礎的な発生現象の理解に有利であり、炭 藻類Coleochaete属はそのような例の一つである。 ある種(例えば、C. orbicularis, C. scutatum)は、反クライナルまたはペリクライナル細胞分裂とそれに続く最外層細胞の拡張の組み合わせによって外側に成長する柔組織円盤状の距膜を作る(Brownら、1994; Cook, 2004)。 細胞の分裂面は、細胞の大きさ、形状、距 離に応じた単純なルールに従っている (Dupuy et al., 2010; Besson and Dumais, 2011)。 この特性により、多細胞の形態形成を解釈するための数学的モデルを構築することができ(Domozych and Domozych, 2014; Umen, 2014)、器官や生物全体の進化、バイオメカニクス、生理に関する重要な知見を得ることができる。 さらに、いくつかのColeochaete種は、乾燥条件下で距骨に生じる構造的および機能的変調(Grahamら、2012)、すなわち初期の陸上植物の進化や干ばつ時の植物成長ダイナミクスを理解する上で重要な特徴を明らかにするために広範囲に研究されてきた。 例えば、MADS-box 遺伝子ファミリーのメンバーは、3 種類の炭そ植物、Chara globularis、Coleochaete scutata、および Closterium peracerosum-strigosum-littorale から単離され特徴づけられている (Tanabe et al., 2005)。 MADS-box遺伝子は、イワナ科植物における発現パターンから、ハプロイドの発生や生殖に関与していることが示唆されている(Tanabe et al.、2005)。 陸上植物の進化の過程で、2倍体世代に採用され、発生における役割がさらに多様化したと考えられている(Tanabe et al.、2005)。 現在までに、Klebsormidium flaccidumは、ほぼ完全な核ゲノムが利用可能な唯一のシャロフィツ類である(Hori et al.、2014);ただし、葉緑体とミトコンドリアゲノムは、6クラスのシャロフィツ類のそれぞれの代表について配列決定されており、EST(発現配列タグ)はいくつかのシャロフィツ類について利用できる(Delwiche、2016)。 Klebsormidiumのゲノムからは、いくつかの植物ホルモンやシグナル伝達中間体の合成遺伝子、高光量からの保護機構(Hori et al., 2014)、これまでコケ類で初めて登場したと考えられていたGroup IIb WRKY転写因子の存在(Rinerson et al., 2015)がすでに明らかにされている。 現在、いくつかのイワナ科植物のゲノム配列決定プロジェクトが進行中であり(Delwiche, 2016)、より多くのイワナ科植物を含むより詳細な比較解析が可能となり、種や遺伝子間の進化的関係性について新しい知見が得られる可能性がある。 Streptophytesの中で最も早く分岐したグループというシャロフィットのユニークな位置づけは、進化-発生研究にとって特に強力なツールとなり、最近Peniumで安定形質転換が達成されたような新しい技術(Sørensen et al, 7022>
Future Uses of Charophytes as Model Organisms
Charophyte研究の重要な次のステップは、包括的な分類群のゲノムの解析と陸上植物との比較研究である。 この研究は、陸上生息地に出現し、うまく植民地化する際に、シャロフィートが進化した適応メカニズムに関する重要な洞察をもたらすだけでなく、植物基礎研究における現在のモデル生物の使用をさらに洗練し、拡大するものである。 分子生物学的研究は多くの研究分野をサポートするが、すぐに役立つのは細胞壁生物学と成長・発達における成長調節因子の動態の2分野であろう。 前者では、ペクチンや細胞壁タンパク質の生合成、壁ポリマーの制御された分泌、沈着、分泌後の調節、植物細胞における特異的で相互作用的な膜輸送ネットワークなど、多くの基本的であるが解決されていない現象に、シャジクモが解明をもたらす可能性がある。 後者については、エチレンやオーキシンのようなホルモンに関連した成長・発達の分子シグナリング、細胞生物学、発達動態の解読に、シャロフィトンモデルが役立つと思われます。 また、近年のシャロフィツムの生態生理学的研究は、植物細胞が乾燥や塩分耐性などのストレスにどのように適応するかを決定する上で、重要なデータのボナンザになる可能性がある(Holzinger and Karsten, 2013; Pichrtová et al., 2014; Herburger et al., 2015; Holzinger and Becker, 2015; Holzinger and Pichrtová, 2016; Kondo et al.) 7022>
Author Contributions
All authors listed, has made substantial, direct and intellectual contribution to the work, and approved it for publication.著者らは、この研究に対して実質的、直接的、知的な貢献を行い、出版を承認した。
Conflict of Interest Statement
著者らは、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する
Acknowledgement
この作業は、NSF(米国)MCB共同グラント1517345および1517546による支援を受けた
Belby,M. J. (2016). マルチスケールなイワナ実験システム:膜輸送体の電気生理学から細胞間結合性、細胞質ストリーミング、オーキシン代謝まで。 Front. Plant Sci. 7:1052. doi: 10.3389/fpls.2016.01052
CrossRef Full Text | Google Scholar
Braun, M. (2002). 重力知覚には、イワナの根粒やプロトネマタの特定の細胞膜領域に定置するスタトリスが必要である。 Protoplasma 219, 150-159. doi: 10.1007/s007090200016
CrossRef Full Text | Google Scholar
Braun, M., and Limbach, C. (2006)(2010). カラ類藻類のリゾイドとプロトネマタ:偏光成長および植物重力感知研究のためのモデル細胞。 Protoplasma 229, 133-142. doi: 10.1007/s00709-006-0208-9
CrossRef Full Text | Google Scholar
Graham, L. E. (1993). 陸上植物の起源. ニューヨーク、NY: John Wiley & Sons, 287.
Google Scholar
Herburger, K., and Holzinger, A. (2015)(2015). ストレプトファイト緑藻類ZygnemaとKlebsormidiumにおけるカロースの局在と定量化:乾燥耐性との相関性. Plant Cell Physiol. 56, 2259-2270. doi: 10.1093/pcp/pcv139
CrossRef Full Text | Google Scholar
Lemieux, C., Otis, C., and Turmel, M. (2016). 連鎖性緑藻類の比較葉緑体ゲノム解析により,Klebsormidiophyceae,Coleochaetophyceae,Zygnematophyceaeにおける主要な構造変化が明らかになった。 Front. Plant Sci. 7:697. doi: 10.3389/fpls.2016.00697
CrossRef Full Text | Google Scholar
Lutz-Meindl, U. (2007). 植物生体における画像生成と元素分析のためのエネルギーフィルタリング透過電子顕微鏡の使用. Micron 38, 181-196. doi: 10.1016/j.micron.2006.03.017
CrossRef Full Text | Google Scholar
Meindl、U. (1993). 形態形成研究のモデルシステムとしてのマイクロステリアスの細胞. Microbiol. Rev. 57, 415-433.
Google Scholar
Pichrtová, M., Kulichova, J., and Holzinger, A. (2014). 極地生息地の共役緑藻類(Zygnematophyceae, Streptophyta)において、窒素制限と緩慢な乾燥が乾燥耐性を誘導する。 PLoS ONE 9:e113137. doi: 10.1371/journal.pone.0113137
CrossRef Full Text | Google Scholar
Pickett-Heaps, J. D., and Marchant, H. J. (1972). 緑藻類の系統:新しい提案. Cytobios 6, 255-264.
Google Scholar
Stamenkovic, M., Woelken, E., and Hanelt, D. (2014)(2014). 様々な地理的位置から収集したCosmarium株(Zygnematophyceae, Streptiophyta)の超微細構造は、最適温度とストレス温度の両方で種特異的な差異を示している。 Protoplasma 251, 1491-1509.
Google Scholar
.