大動脈弁狭窄症(AS)は先進国において最も頻度の高い弁膜症である. ASの診断は、古典的には心エコー検査で確定され、疾患の検出と重症度の評価の標準的なツールである(1)。 しかしながら、ASの重症度を評価することは、未だ困難である。 重症のASは通常、平均勾配>40mmHg、大動脈弁面積<1cm2、大動脈ジェット速度ピーク>4.0m/sと定義されます(2)。 しかし、一人の患者の平均勾配と弁面積の間には、しばしば食い違いが見られる(3)。 このような不一致は、LV駆出率の低下により心拍出量が低下している患者には理解しやすいが、LV機能が一見保たれている患者にも起こりうる(4)。 日常診療では、狭窄部や症状の重症度を過小評価し、大動脈弁置換術(AVR)を不適切に遅らせ、ひいては患者の予後に悪い影響を与える可能性があります(5-7)。 今回のCardiovascular Diagnosis and Therapyでは、OZKANがLV機能が保たれている患者における低勾配ASの概念についてエレガントに解説している(8)。 弁勾配の関係を流れパターンに統合することの重要性を最初に強調したのはPibarotら(5)のグループであり、一方、ASの重症度分類の矛盾を明確に示し、DumesnilらとともにASの新分類を提案したのはMinersら(3)が最初であった(6)。 AVA <1cm2の患者において、4つの流量勾配ASカテゴリーを識別することができる:正常流量/低勾配(NF/LG)、正常流量/高勾配(NF/HG)、低流量/高勾配(LF/HG)、低流量/低勾配(LF/LG)である。 LFはLV stroke volume <35 mL/m2を指標とし、LGは平均経大動脈圧較差<40 mmHgと定義される(12)。
Normal flow-low gradient
このパターンは患者の31-38%で見られ、ガイドラインに含まれる固有の矛盾であるASの程度の低い患者、あるいはこの疾患に短期間さらされた患者のグループを識別するようである。 この患者群は、LV縦方向の心筋機能が保たれていることが特徴で、BNP値やMoninのリスクスコアが低くなっている(12,13)。
Normal flow-high gradient
このパターンは最も多く(39-72%)、ガイドラインで提案された基準と完全に一致している(4,5,12)。 NF/LG群と比較すると、LV縦隔機能は保たれているものの、BNPは高く、無イベント生存率は低下している。 さらに、NF/HGの患者はより重症のASを持つようであり、この進行性疾患に長く曝されていることを示唆している。 症状がある場合、これらの患者は一般的にAVRに紹介されるが、無症状の場合、これらの患者の管理は最適なリスク層別化の必要性を強調するものである。 LV駆出率は保たれているにもかかわらず、指標となるLV stroke volumeが8071>35mL/m2未満、BNP値およびMoninのリスクスコアが高い、LV縦隔機能が大幅に低下していることが特徴である(14)。 注目すべきは、LV駆出率はLV収縮機能の粗い推定値であることである。 LV駆出率は内在する心筋機能とLV腔の形状の両方に影響される。 したがって、内在性心筋の短縮が同程度であれば、LV駆出率はLVの同心円性リモデリングの程度に関連して増加する傾向がある。 したがって、AS患者のようなLV同心円リモデリングが存在する場合、LV駆出率は心筋障害の程度を著しく過小評価する可能性がある。 したがって、正常な形状のLVでは正常であることが、同心円状にリモデリングしているLVでは異常である可能性がある。 さらに、LV出力の低下(内在性心筋機能障害と著しいLVリモデリングに関連)は、予想以上に低い経弁的勾配をもたらすかもしれない。 これらの患者の転帰は、NF/HGの患者とほぼ同じである。 症状がある場合、これらの患者は外科的に治療した方が生存率が高い傾向にある。
Low flow-low gradient
LF/LG patternの有病率は、最初に報告されたものより低いようである。 このパターンは、無症状の患者では7%、症状のある患者では15~35%である(4-6,12,14)。 このパターン、すなわち逆説的低流量ASは、最近強調されるようになった困難な臨床的実体である。 これは、より顕著なLV concentric remodelling、小さなLV cavity、グローバルなLV afterloadの増加、内在性心筋機能障害、心筋線維化、および悲惨な予後と関連している(12,15)。 無症状の患者において、3年後にAVRを行わずに生存している可能性は、NF/LGパターンでは5倍低く、NF/HG群では4.3倍高いことが示されている(12)。 この臨床的実体はしばしば誤診され、ASの重症度を過小評価し、その結果、手術の過小使用や不適切な遅延につながる可能性がある。 AVAとLGが小さい症候性患者に対して手術を拒否しないためには、この実体を認識することが重要である。
勾配と弁面積の不一致
LV駆出率が保たれている患者におけるAVAと勾配の不一致の原因としては、(I) 測定エラー、(II) 体格が小さい、 (III) 逆説的低流AS、および (IV) ガイドライン基準における固有の不一致に関する等級付けの不一致 (4,6,7,10,11) が考えられる。 まず、体格とLV寸法が小さい患者は、正常なストローク量とはいえ低いため、低い経弁的圧力勾配を示す可能性がある。 また、LV流出路の過小評価やパルス波ドップラーのサンプル位置のずれにより、一回拍出量やAVAが過小評価される可能性がある。 ドップラー・エコーによる一回拍出量と心房細動の測定値を確認するために、いくつかの方法を用いることができる。 例えば、著しい僧帽弁閉鎖不全症がない場合、Simpsonの方法(LV駆出率および容積を測定する容積法)により容易に一回拍出量を推定することが可能である。 これらの独立した方法で測定した一回拍出量がLV流出路で測定した一回拍出量と一致すれば、一回拍出量の測定精度について安心することができる。 第三に、paradoxical LF/LG は、LV concentric remodellingと心内膜下縦隔機能低下の両方からLF状態が生じるという新しい病態である。 このことは、ASの重症度を誤って推定することがないことを概説している。 第四に、勾配と弁膜面積の関係の不一致は、現行のガイドラインの矛盾に関連している場合がある。 重症ASの定義の統一により、これらの「重症」AS患者の一部は「中等症」ASに再分類されるかもしれない。 現在の前向きな臨床データと、以前の血行動態エコーや侵襲的なデータを組み合わせると、40mmHgの勾配は0.8cm2の弁面積により適合するのに対し、1cm2の弁面積は26mmHgの平均勾配と関連するようだ(3、6、16)。 さらに、LVEFORTが保たれている患者において、弁膜面積(重度)と弁膜勾配(中度)の間に矛盾がある場合、より包括的なドップラーエコー評価と、潜在的には他の診断テスト(BNP、マルチスライスCTによるカルシウムスコア、運動/ドーパミン負荷心エコー)が、疾患の重症度の確認と治療管理の指針として必要であるかもしれません。
臨床的意義と管理
日常診療では、AS重症度評価は古典的なAVA測定に流量勾配パターンを統合する必要がある。 一般的なルールとして、AVAが小さくLV駆出率が保たれている患者では、低い経弁勾配(<40mmHg)または速度(<4m/s)は重度のASの存在を除外するものではない。 さらに、LV駆出率が維持されている場合(>50%)でも、心筋収縮機能障害とASにおける低い経弁流の存在を除外することはできない。 NF/LG ASの患者は、古典的には心内膜下機能障害がないか、あってもごくわずかであり、比較的予後が良好である。 このNF/LGカテゴリーでは、AVRの適応は、症状が明らかにASに起因すると考えられる患者に限定されるべきである。 NF/HGカテゴリーでは、AVR(外科的または経皮的)は生存率と症状の両方を有意に改善する唯一の治療法である。 無症状の場合、個々のリスク層別化により、早期の手術が有効な患者を特定することができる。 他のカテゴリーでは、LF状態は内在する心筋機能障害とより進行した病態の証である。 LF/HGの症候性患者もまた、迅速なAVRが有益である。 無症状の場合は、個々のリスク層別化も推奨される。 運動負荷心電図検査は、弁膜コンプライアンスに制限のある患者やLV収縮予備能が枯渇した患者を発見するのに有効である(17,18)。 逆説的なLF/LGは無症状の患者であっても予後不良である。 このカテゴリーでは、手術の有用性は証明されていないが、一部の症候性患者ではAVRはおそらく有益であろう(7,19,20)(表1)。 臨床の場では、このような症例を見極めることは難しい。 手術を検討する前に、症状とASの重症度を照合する必要がある。 低リスクの患者には、AVRが推奨されるかもしれない。 高リスクの患者では,最も適切な治療方法と時期を決定するために,さらなる転帰研究が必要である」
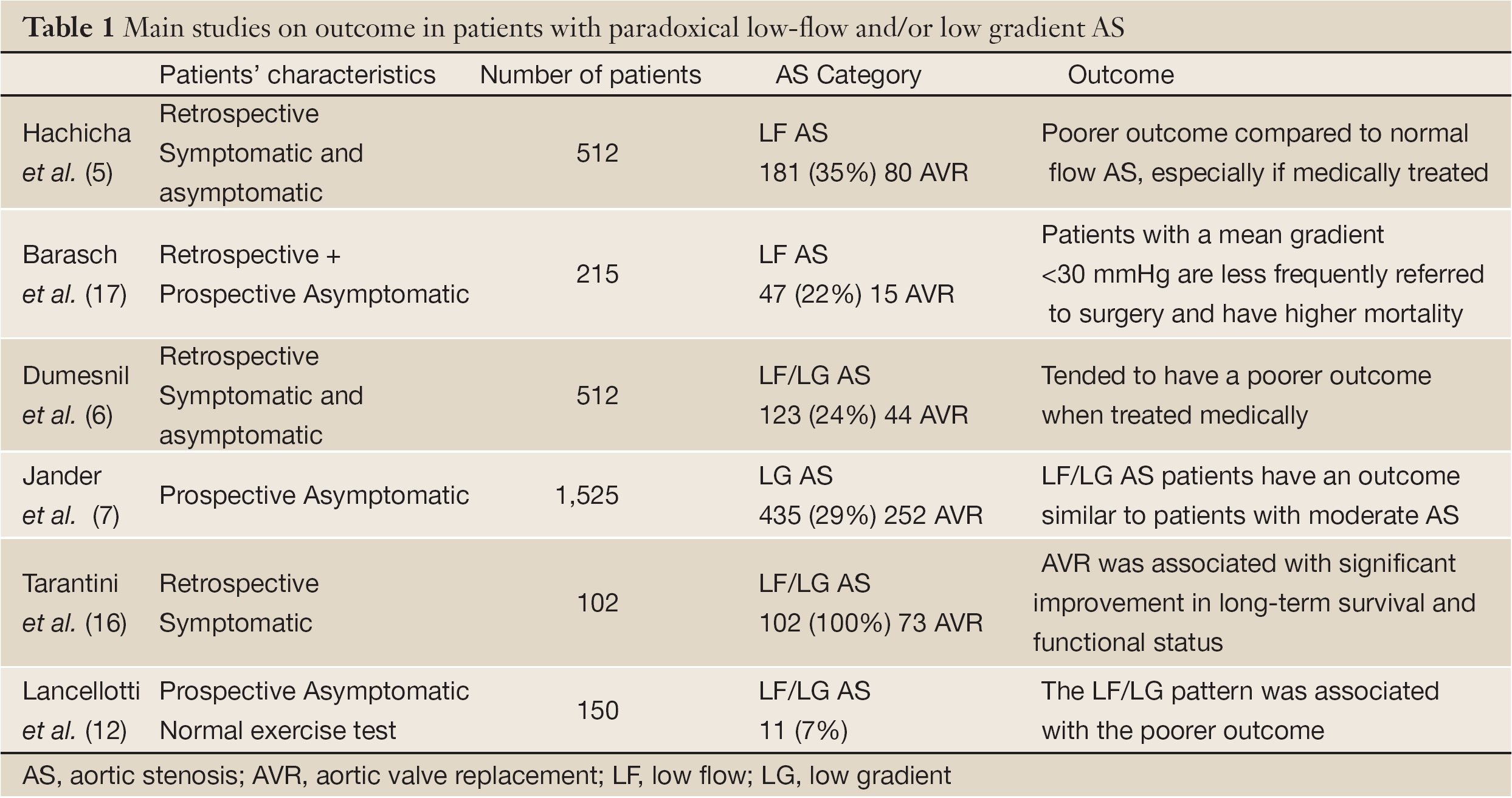
Full Table
謝辞
Disclosure: 著者らは利害関係を宣言しない.
- Lancellotti P, Donal E, Magne J, et al. 無症状の中~重症大動脈弁狭窄症におけるリスク層別化:弁膜、動脈および心室の相互作用の重要性について。 Heart 2010;96:1364-71.
- Bonow RO、Carabello BA、Kanu C、et al. ACC/AHA 2006 Guidelines for the Management with Valvular Heart Disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to revise the Guidelines of Patients With Valvular Heart Disease 1998): developed in collaboration with the Society of Cardiovascular Anesthesiologists: Endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons(心弁膜症の患者を対象とした管理に関するACC/AHA2006ガイドライン). 424>
- Minners J, Allgeier M, Gohlke-Baerwolf C, et al. 現在のガイドラインによる大動脈弁狭窄症の矛盾した等級付け:左心機能が明らかに正常な患者における血行動態の検討。
- Adda J, Mielot C, Giorgi R, et al. Low-Flow, Low-Gradient Severe Aortic Stenosis Despite Normal Ejection Fraction Is Associated With Severe Left Ventricular Dysfunction as Assessed by Speckle-Tracking Echocardi.心臓超音波による左室狭窄の評価(H22/9:1463-8.その他): 多施設共同研究。 また、大動脈狭窄症は、駆出率が保たれているにもかかわらず、逆説的な低流量・低勾配の重症大動脈狭窄症と、より高い後負荷および生存率の低下と関連することが示された。 Dumesnil JG, Pibarot P, Carabello B. Paradoxical low flow and/or low gradient severe aortic stenosis despite preserved left ventricular ejection fraction: implications for diagnosis and treatment.Circulation 2007;115:2856-64.
- Dumesnil JG, Pibarot P, Carabello B. Paradoxical low flow and/or low gradient severe aortic stenosis although preserved left ventricular ejection fraction. また、このような患者さんには、「低勾配の “重症 “大動脈弁狭窄症で駆出率が保たれている患者さんのアウトカム」を紹介しました。
- Ozkan A. Low gradient “severe” aortic stenosis with preserved left ventricular ejection fraction(左室駆出率が維持された低勾配の「重症」大動脈狭窄症).
- Dumesnil JG, Pibarot P, Akins C. New approaches to quantifying aortic stenosis severity.Cardiovasc Diagn Ther 2012;2:19-27.
- 大動脈弁狭窄症の重症度を定量化するための新しいアプローチ。 Curr Cardiol Rep 2008;10:91-7.
- Pibarot P, Dumesnil JG.による、大動脈弁狭窄症の重症度を定量化するための新しいアプローチ。 大動脈弁狭窄症の重症度評価:勾配が弁面積に合わない場合。
- Lancellotti P, Magne J. Valvuloarterial impedance in aortic stenosis: look at the load, but do not forget the flow.Heart 2010;96:1431-3.
- ランセロッティ P, マグネ J. 大動脈弁狭窄症のインピーダンス:負荷を見て、流れを忘れないで。
- Lancellotti P, Magne J, Donal E, et al. 無症状の重症大動脈弁狭窄症における臨床転帰は、新しい大動脈弁狭窄症等級分類の提案による洞察である。 J Am Coll Cardiol 2012;59:235-43.
- Monin JL, Lancellotti P, Monchi M, et al.Risk score for predicting outcome in patients with asymptomatic aortic stenosis.J Am Coll Cardiol 2012;59:235-43.
- Lancellotti P, Monchi M, et al.
- Lancellotti P, Donal E, Magne J, et al. 無症状の重症大動脈弁狭窄症におけるグローバル左室後負荷の左室機能への影響:2次元スペックルトラッキングスタディ. Eur J Echocardiogr 2010;11:537-43.
- Herrmann S, Störk S, Niemann M, et al. Low-gradient aortic valve stenosis myocardial fibrosis and its influence on function and outcome.大動脈弁狭窄症における心筋線維の低重量化、およびその影響。 J Am Coll Cardiol 2011;58:402-12.
- Zoghbi WA. 収縮機能が正常な低勾配の「重症」大動脈弁狭窄症:ガイドラインを改良する時期が来たか?
- Lancellotti P, Lebois F, Simon M, et al. 無症状の弁大動脈弁狭窄症における定量的運動ドップラーエコーの予後的重要性.Lancellotti P, Lebois F, Simon M, et al. 424>
- Maréchaux S, Hachicha Z, Bellouin A, et al. Usefulness of exercise-stress echocardiography for risk stratification of true asymptomatic patients with aortic valve stenosis.大動脈弁狭窄症における運動負荷心エコーの有用性.Circulation 2005;112:I377-82.
- Maréchaux S, Hachicha Z, Bellouin A, et al. また、大動脈弁狭窄症に対する弁置換術は、経弁的勾配が小さく、左室駆出率が0.50を超える重症の大動脈弁狭窄症に対して行われた。 このような場合、弁置換術の適応となるのは、左室収縮機能が正常で、かつ経弁膜勾配が低い重症孤立性大動脈弁狭窄症:病態生理と予後に関する洞察です。 J Heart Valve Dis 2008;17:81-8.
.