Lewis Structure for Oxalate ion is drawn by step in this tutorial step by step. C2O42-のルイス構造を描くには、全価電子の概念が使われます。 C2O42-のルイズ構造が完成したら、-2価の電荷と安定性があるはずです。
シュウ酸イオン|C2O42-
炭酸イオンは-2価の電荷を持っています。 シュウ酸イオンの炭素原子は2つです。
C2O42- ルイス構造
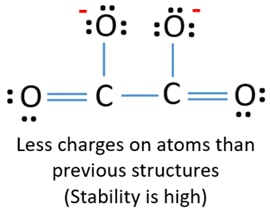
2個の炭素原子は1個の炭素原子と結合している。 同様に、他の2つの酸素原子も他の炭素原子と結合している。 C2O42-イオンのルイズ構造では、イオンはC-C結合を中心に対称です。
Steps of drawing lewis structure of C2O42-
以下のステップは、C2O42-ルイズ構造を描くために必要で、彼らはこのチュートリアルで詳細に説明されています。
these steps, like following facts are important to drawing the lewis structure.このようにlevis構造を作るには以下のことが重要です。
酸素は炭素原子よりも電子を保持することを好むので、レウィス構造では負の電荷を保持する必要がある。
CO32-の共鳴構造を正しく描くには、正しいルイス構造を描くことが重要です。
C2O42-の価電子数
炭素は周期表で4族に位置しています。 つまり、炭素は価電子帯に4個の電子を持っている。 酸素は第6族に位置します。
- 炭素原子が与える全価電子 = 4 * 2 = 8
C2O42-イオンには酸素原子が4個あるので、
- 酸素原子が与える全価電子 = 6 * 4 = 24
C2O42-イオンにはマイナス2個の電荷が存在することが解ります。 したがって、価電子に寄与する電子はあと2個あります。
- 全価電子=8+24+2=34
全価電子対
全価電子対=σ結合+π結合+価殻の孤立対
全価電子数は、全価電子数を2で割ると求めることができます。 C2O42-イオンの場合、総電子数は17個です。
C2O42-イオンの中心原子
中心原子になるには、より高い価数を持つことが重要です。 炭素は4価、酸素は2価なので、炭素が中心原子になる可能性が高くなります。
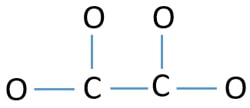
Lone pairs on atoms
- 上の図ではC-O結合が4つとC-C結合が1つとで5結合あります。
- まず、この12個の価電子対を外側の原子(酸素原子上)の孤立電子対としてマークします。 酸素原子1個は8進法(酸素原子は8個以上の電子を価電子帯に保持できない)により3個の孤立電子対を取ります。
- 酸素原子4個の場合、12個の電子対が使われます。
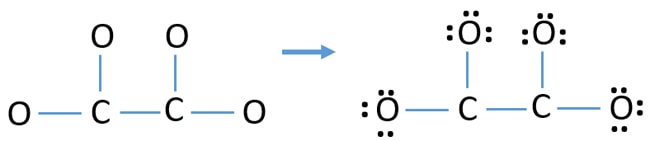
Charges on atoms
原子の電子対をマークした後(この場合は酸素原子のみ)、各原子に電荷があればマークしなければならないでしょう。 電荷のマークは、イオンの最適なルイス構造を決定するために使われるため、重要です。
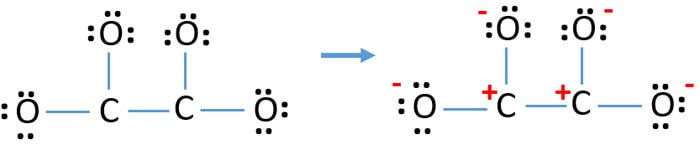
この構造は、イオン内のいたるところに電荷があるので非常に不安定になります。
安定性を確認し、孤立対を結合に変換して原子の電荷を最小にする
- 酸素原子は炭素原子より電気陰性度が高いので、負の電荷を持つはずです。 そうでなければ、負の電荷を保持する能力は炭素原子よりも酸素原子の方が大きいと言える。
- すべての原子が電荷を持っているので、描かれた構造は安定なものではない(ルイス構造は電荷が少なく安定なものであるべき)
- では、ローンペアまたはペアを結合に変換することで電荷を最小限にしようとする必要があります。 そこで酸素原子1個のローンペアをC-O結合に変換する。
- これで炭素原子1個と酸素原子1個の間に二重結合ができました(C=O結合が1つ)。
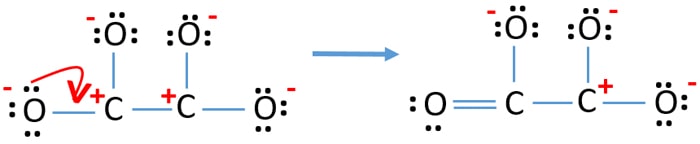
In new structure, the charges of atoms are reduced than previous structure.これは、炭素原子と酸素原子との間に3つの単結合(2つのC-O結合)があるためです。 酸素原子1個と炭素原子1個の電荷はゼロになった。 しかし、3個の酸素原子(マイナス電荷が-1個)ともう1個の炭素原子には電荷が残っています。 これで、このC2O42-の構造は、以前の構造よりも安定であることがお分かりいただけたと思います。
電荷をさらに減らす
別の酸素原子のローンペアをC-O結合に変換すると、以下のようになります。
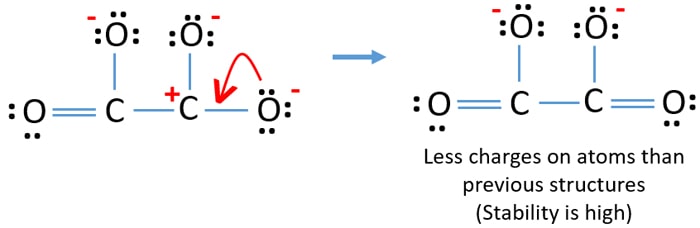
Lewis structure of C2O42- (carbonate) ion
Questions
Ask your chemistry questions and find the answer
Related Tutorials