 Alle materie, levend of niet, is opgebouwd uit chemische elementen; dit zijn fundamentele chemische stoffen in de zin dat ze zijn wat ze zijn – ze kunnen niet in een ander element worden veranderd. Elk element wordt onderscheiden door het aantal protonen
Alle materie, levend of niet, is opgebouwd uit chemische elementen; dit zijn fundamentele chemische stoffen in de zin dat ze zijn wat ze zijn – ze kunnen niet in een ander element worden veranderd. Elk element wordt onderscheiden door het aantal protonen , neutronen
, neutronen , en elektronen
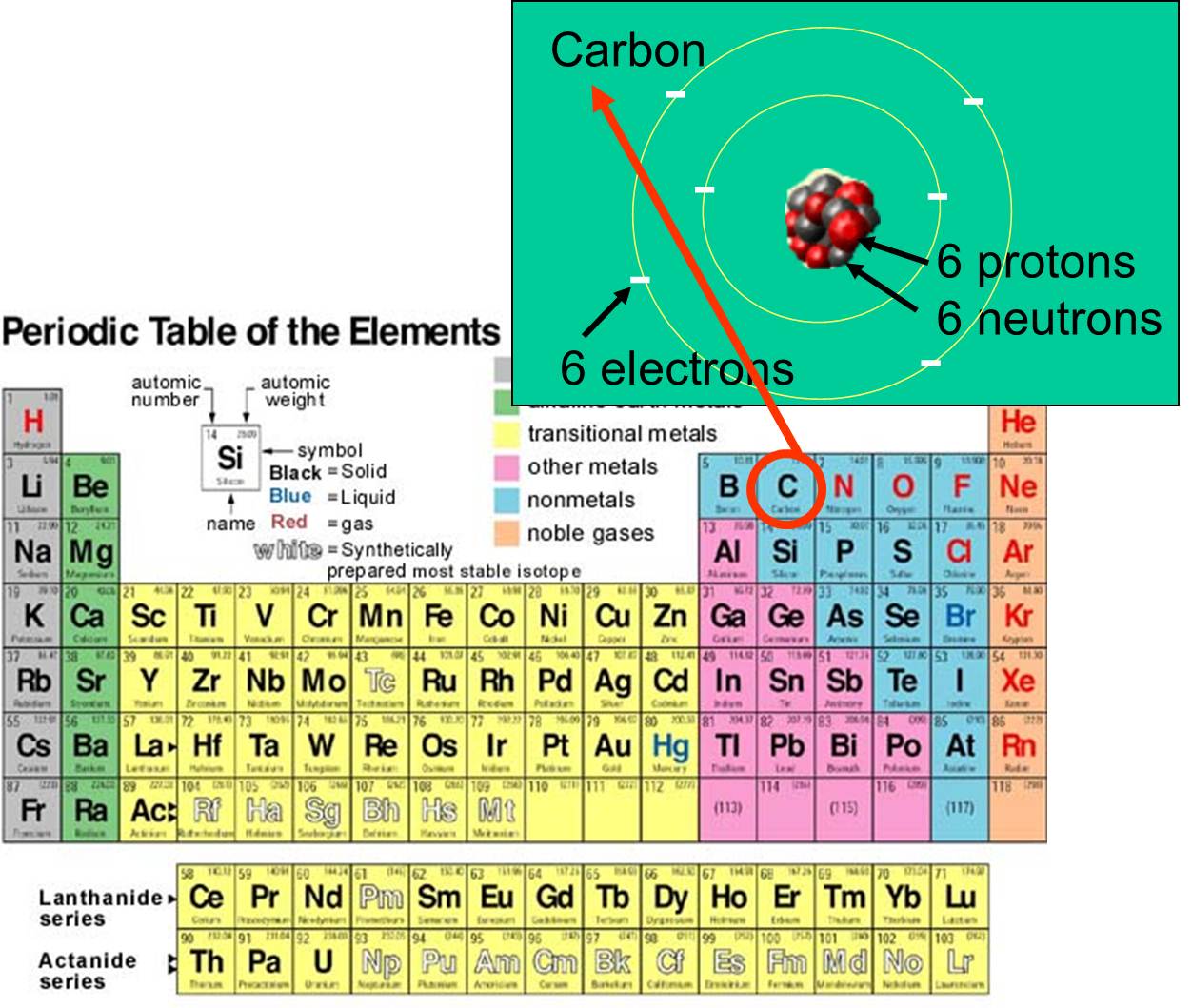
, en elektronen dat het bezit. Koolstof bijvoorbeeld heeft een atoomnummer van 6 en een atoommassa van ongeveer 12, omdat het 6 positief geladen protonen heeft en 6 neutronen die niet geladen zijn. De 6 geladen elektronen dragen zeer weinig bij tot de atoommassa. Er zijn 92 natuurlijk voorkomende elementen op aarde. De reeks elementen en hun subatomaire structuur zijn samengevat in het periodiek systeem der elementen, dat hiernaast is afgebeeld.
dat het bezit. Koolstof bijvoorbeeld heeft een atoomnummer van 6 en een atoommassa van ongeveer 12, omdat het 6 positief geladen protonen heeft en 6 neutronen die niet geladen zijn. De 6 geladen elektronen dragen zeer weinig bij tot de atoommassa. Er zijn 92 natuurlijk voorkomende elementen op aarde. De reeks elementen en hun subatomaire structuur zijn samengevat in het periodiek systeem der elementen, dat hiernaast is afgebeeld.
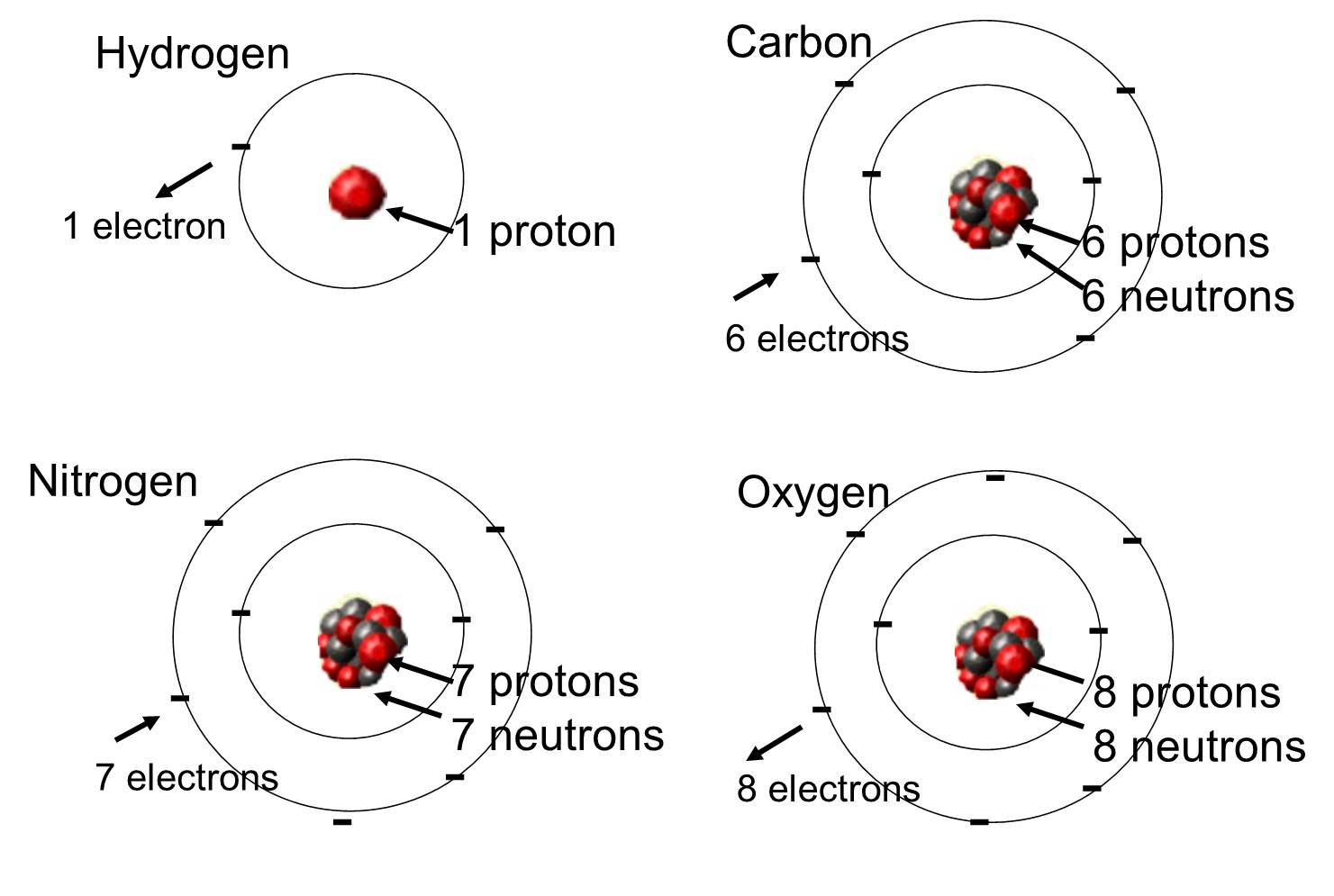
In levende organismen zijn de meest voorkomende elementen koolstof, waterstof en zuurstof. Deze drie elementen vormen samen met stikstof, fosfor en een handvol andere elementen het overgrote deel van de levende materie. Een atoom is een afzonderlijke eenheid van een chemisch element. Enkele van deze elementen die veel voorkomen in organische moleculen zijn hieronder weergegeven.
 Atomen kunnen zich met andere atomen verbinden door chemische bindingen te vormen.
Atomen kunnen zich met andere atomen verbinden door chemische bindingen te vormen.
Covalente bindingen
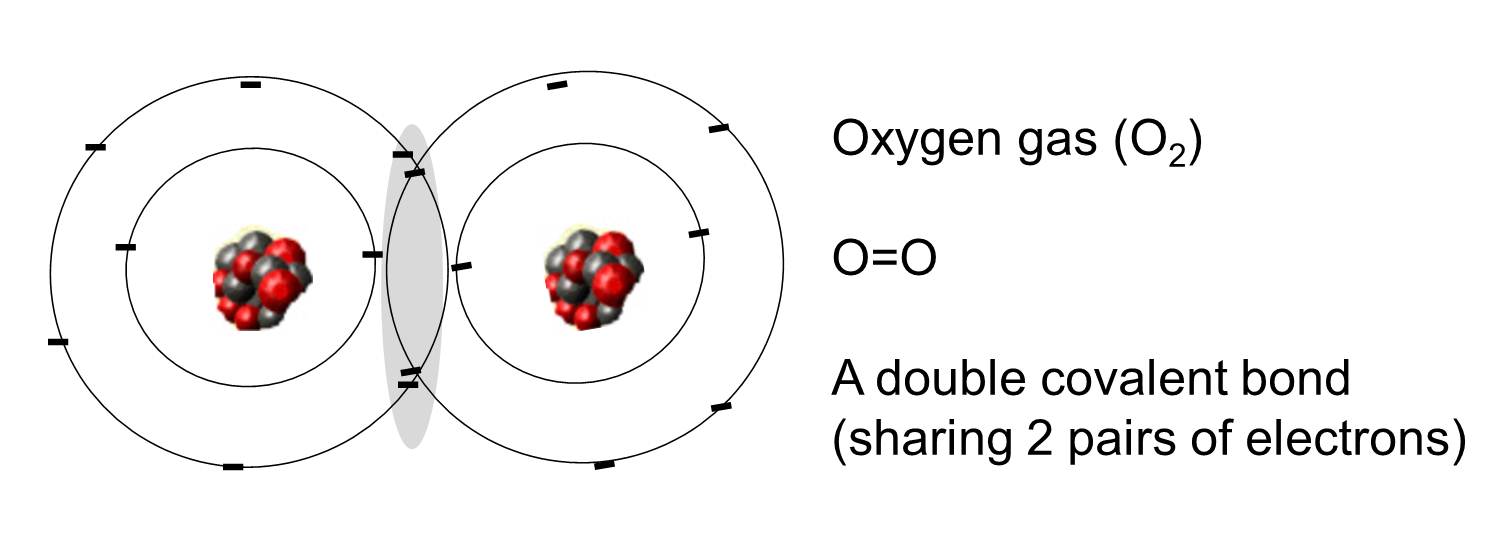
Een covalente binding is een binding waarbij een of meer elektronenparen door twee atomen worden gedeeld. De illustratie rechts toont twee zuurstofatomen die covalent gebonden zijn door het delen van twee elektronenparen zoals geïllustreerd in het gearceerde gebied.
De figuur hieronder toont een reeks moleculen die gevormd worden door covalente binding. Ga met de muis over elk molecuul om een korte beschrijving te zien.
, 
Water is een polair molecuul
Merk ook op dat het delen van elektronen niet altijd gelijk is. In een watermolecuul bijvoorbeeld brengen de negatief geladen elektronen meer tijd door in de buurt van het zwaardere zuurstofatoom.
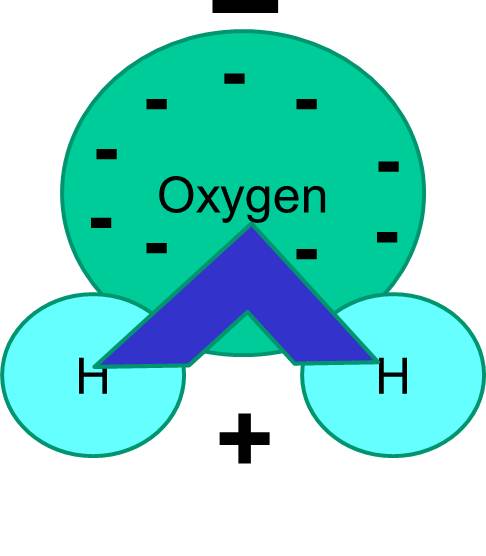
Het nettoresultaat is dat het ene uiteinde van het watermolecuul negatiever is dan het andere uiteinde. Water is dus een “polair” molecuul. We zullen zien dat deze polariteit belangrijke implicaties heeft voor vele biologische verschijnselen, waaronder de celstructuur. Je hebt misschien wel eens gehoord van de uitdrukking “gelijk is gelijk”. Dit betekent dat polaire moleculen goed oplossen in polaire vloeistoffen zoals water. Suikers (b.v. glucose) en zouten zijn polaire moleculen, en zij lossen op in water, omdat de positieve en negatieve delen van de twee soorten moleculen zich goed onder elkaar kunnen verdelen.
Ionische Bindingen
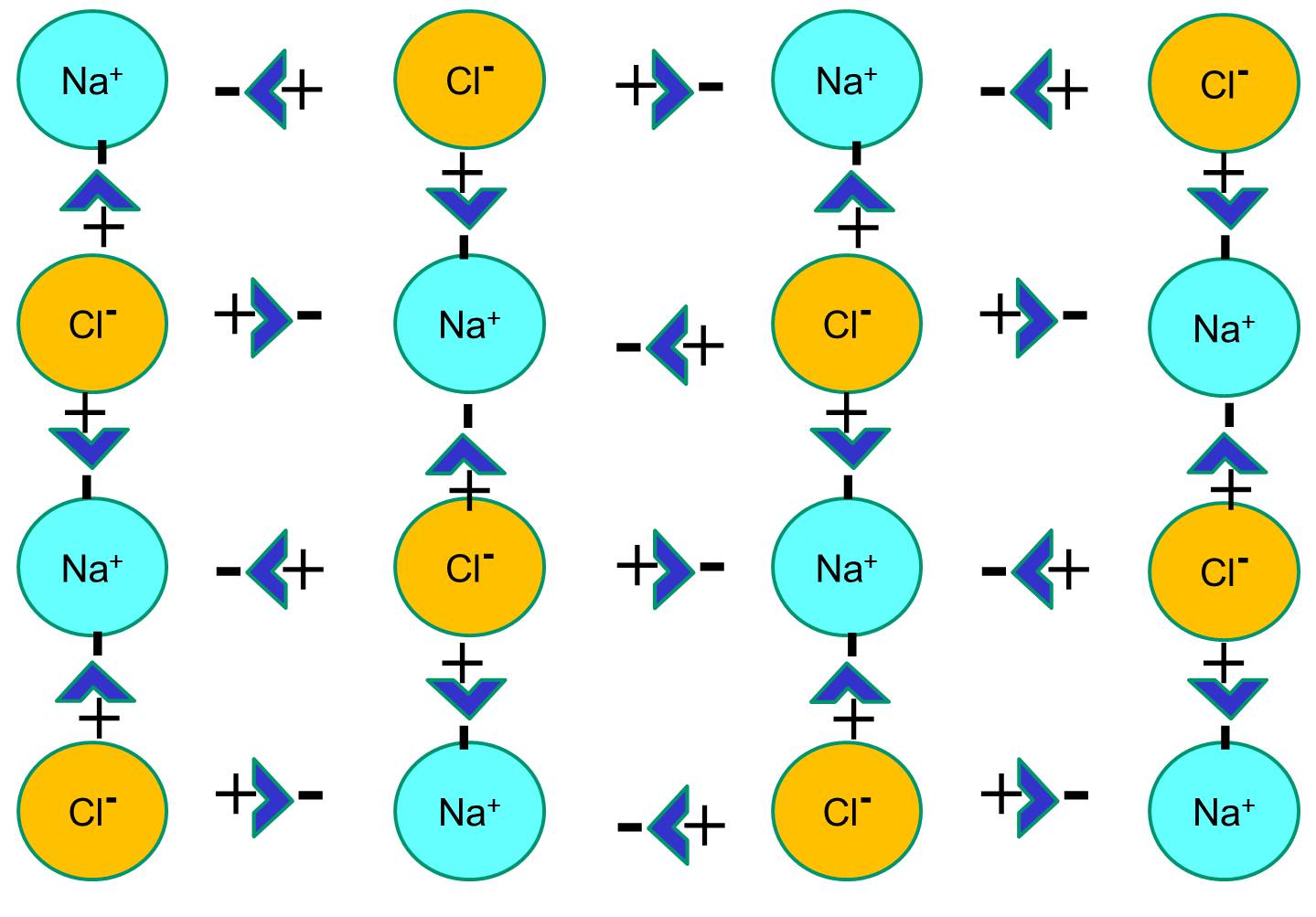
Natrium heeft een enkel elektron in zijn buitenste schil, en het is thermodynamisch stabieler als het dit elektron opgeeft. Dit verlies van een negatief elektron resulteert in een positief geladen natriumion, afgekort Na+. Chloor daarentegen heeft zeven elektronen in zijn buitenste orbitale schil, en het is thermodynamisch stabieler als het een extra elektron verwerft om de buitenste orbitale schil te vervolledigen. Dit resulteert in een negatief geladen chloride-ion, afgekort Na+. De positief geladen natriumionen en de negatief geladen chloride-ionen trekken elkaar aan en leiden tot de vorming van een ionische binding. In afwezigheid van water vormen natrium en chloride een kristalrooster door de aantrekkingskracht van negatieve en positieve ionen.
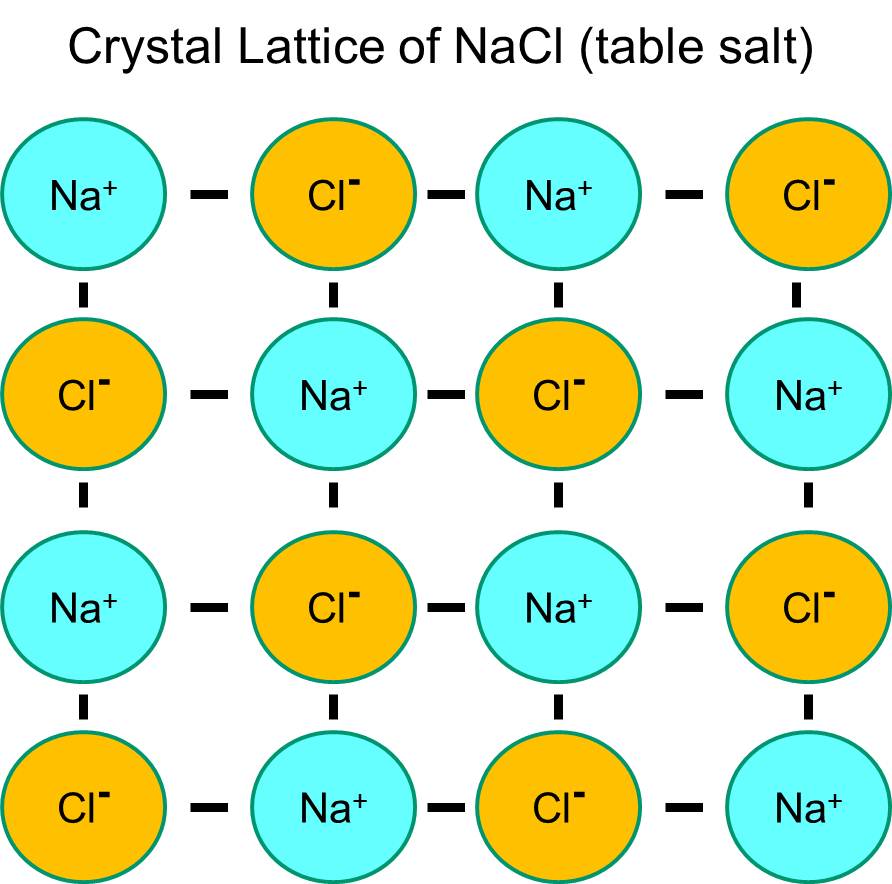
Als natriumchloridekristallen echter in water worden geplaatst, zullen de polaire watermoleculen de natrium- en chloride-atomen “hydrateren”, omdat de watermoleculen polair zijn. In de illustratie hieronder stellen de donkerblauwe V-vormige figuren watermoleculen voor, die polair zijn. De positieve uiteinden van de watermoleculen worden aangetrokken door de negatief geladen chloride-ionen, terwijl de negatieve pool van de watermolecule wordt aangetrokken door de positieve natrium-ionen. Het resultaat is dat de ionen gehydrateerd worden en het kristalrooster oplost in de waterige oplossing. Dit is precies wat er gebeurt als je kristallijn tafelzout toevoegt aan een glas water.