 Cała materia, żywa lub nie, składa się z pierwiastków chemicznych; są to podstawowe związki chemiczne w tym sensie, że są tym, czym są – nie można ich zmienić w inny pierwiastek. Każdy pierwiastek jest wyróżniony przez liczbę protonów
Cała materia, żywa lub nie, składa się z pierwiastków chemicznych; są to podstawowe związki chemiczne w tym sensie, że są tym, czym są – nie można ich zmienić w inny pierwiastek. Każdy pierwiastek jest wyróżniony przez liczbę protonów , neutronów
, neutronów i elektronów
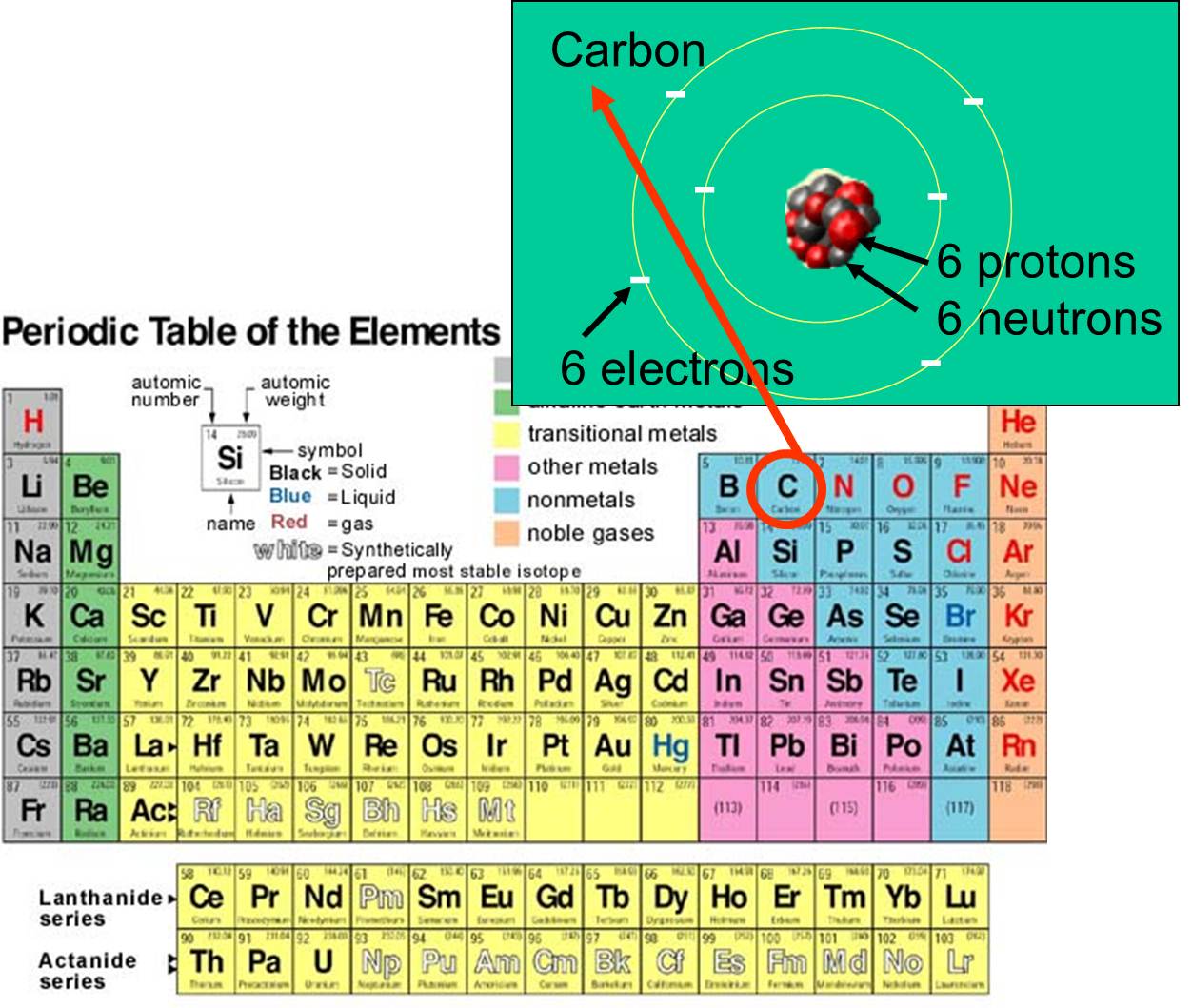
i elektronów , które posiada. Na przykład, liczba atomowa węgla wynosi 6, a jego masa atomowa około 12, ponieważ posiada on 6 dodatnio naładowanych protonów i 6 nienaładowanych neutronów. Sześć naładowanych elektronów wnosi bardzo niewiele do masy atomowej. Na Ziemi występują 92 naturalnie występujące pierwiastki. Układ pierwiastków i ich struktura subatomowa są podsumowane przez układ okresowy pierwiastków, pokazany po prawej stronie.
, które posiada. Na przykład, liczba atomowa węgla wynosi 6, a jego masa atomowa około 12, ponieważ posiada on 6 dodatnio naładowanych protonów i 6 nienaładowanych neutronów. Sześć naładowanych elektronów wnosi bardzo niewiele do masy atomowej. Na Ziemi występują 92 naturalnie występujące pierwiastki. Układ pierwiastków i ich struktura subatomowa są podsumowane przez układ okresowy pierwiastków, pokazany po prawej stronie.
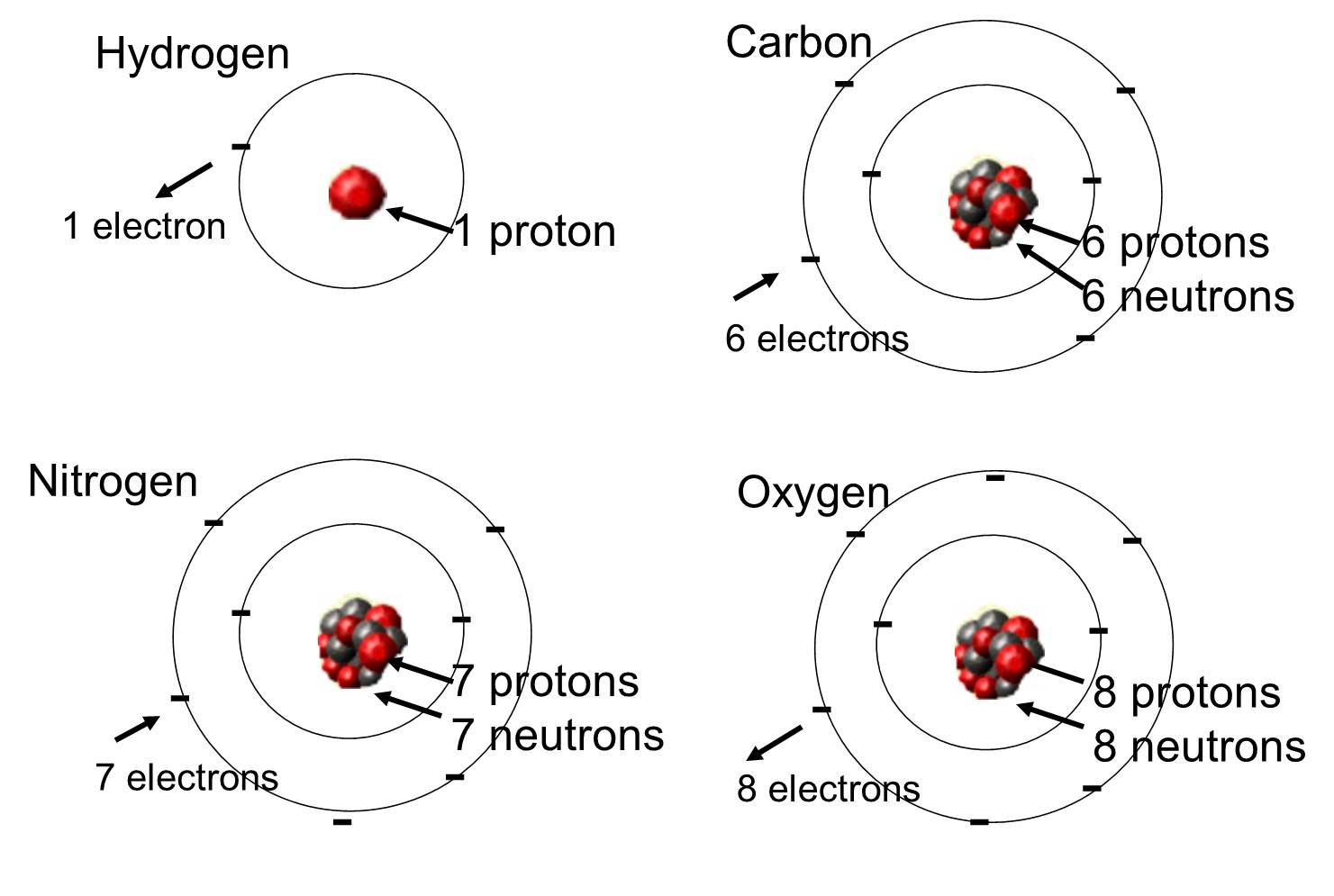
W organizmach żywych najbardziej obfitymi pierwiastkami są węgiel, wodór i tlen. Te trzy pierwiastki wraz z azotem, fosforem i kilkoma innymi stanowią zdecydowaną większość żywej materii. Atom to pojedyncza jednostka pierwiastka chemicznego. Poniżej przedstawiono niektóre z tych pierwiastków, które występują w cząsteczkach organicznych.
 Atomy mogą łączyć się z innymi atomami poprzez tworzenie wiązań chemicznych.
Atomy mogą łączyć się z innymi atomami poprzez tworzenie wiązań chemicznych.
Wiązania kowalencyjne
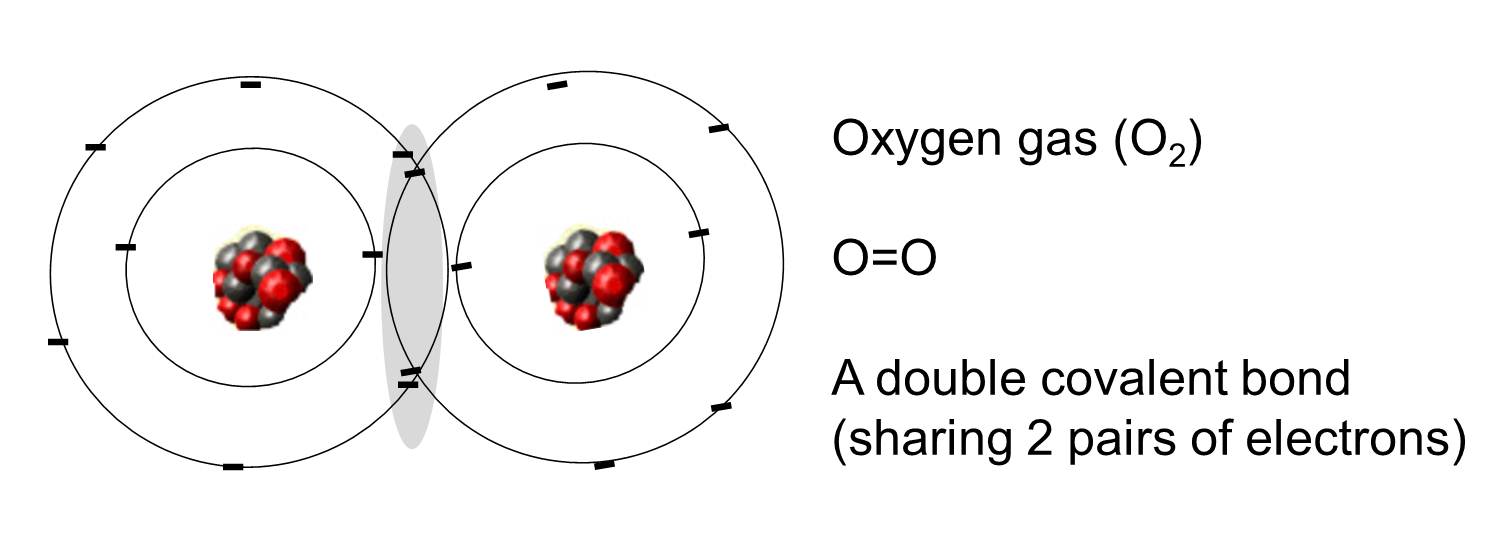
Wiązanie kowalencyjne to takie, w którym jedna lub więcej par elektronów jest współdzielona przez dwa atomy. Ilustracja po prawej stronie przedstawia dwa atomy tlenu, które są połączone kowalencyjnie poprzez współdzielenie dwóch par elektronów, jak pokazano w zacieniowanym obszarze.
Następny rysunek przedstawia serię cząsteczek utworzonych przez wiązanie kowalencyjne. Najedź myszką na każdą cząsteczkę, aby zobaczyć krótki opis.
, 
Woda jest polarną cząsteczką
Zauważ również, że współdzielenie elektronów nie zawsze jest równe. Na przykład, w cząsteczce wody, ujemnie naładowane elektrony spędzają więcej czasu w pobliżu cięższego atomu tlenu.
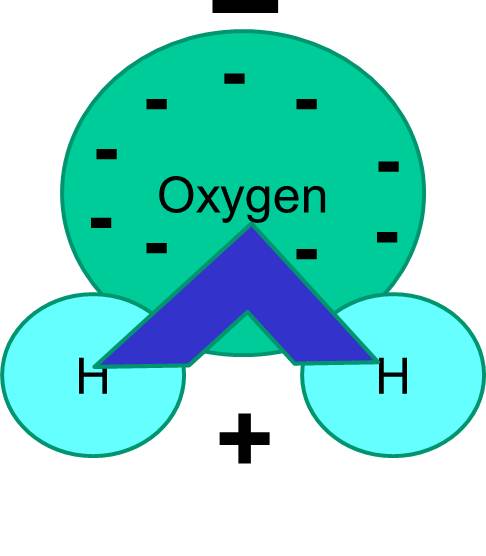
Wynikiem netto jest to, że cząsteczka wody ma jeden koniec, który jest bardziej ujemny w stosunku do drugiego końca. Woda jest więc cząsteczką „polarną”. Zobaczymy, że ta polarność ma ważne implikacje dla wielu zjawisk biologicznych, w tym dla struktury komórek. Być może słyszałeś wyrażenie „podobne rozpuszcza podobne”. Oznacza to, że polarne cząsteczki dobrze rozpuszczają się w polarnych cieczach, takich jak woda. Cukry (np. glukoza) i sole są cząsteczkami polarnymi i rozpuszczają się w wodzie, ponieważ dodatnie i ujemne części tych dwóch rodzajów cząsteczek mogą się wygodnie rozłożyć między sobą.
Wiązania jonowe
Sód posiada jeden elektron w swojej najbardziej zewnętrznej powłoce orbitalnej, i jest termodynamicznie bardziej stabilny, jeśli zrezygnuje z tego elektronu. Ta utrata ujemnego elektronu powoduje powstanie dodatnio naładowanego jonu sodu, oznaczanego skrótem Na+. Chlor, z drugiej strony, posiada siedem elektronów w swojej najbardziej zewnętrznej powłoce orbitalnej i jest bardziej stabilny termodynamicznie, jeśli pozyska dodatkowy elektron w celu uzupełnienia zewnętrznej powłoki orbitalnej. W wyniku tego powstaje ujemnie naładowany jon chlorkowy, zwany w skrócie Na+. Dodatnio naładowane jony sodu i ujemnie naładowane jony chlorkowe przyciągają się wzajemnie, co prowadzi do utworzenia wiązania jonowego. W nieobecności wody, sód i chlorek tworzą siatkę krystaliczną z powodu przyciągania jonów ujemnych i dodatnich.
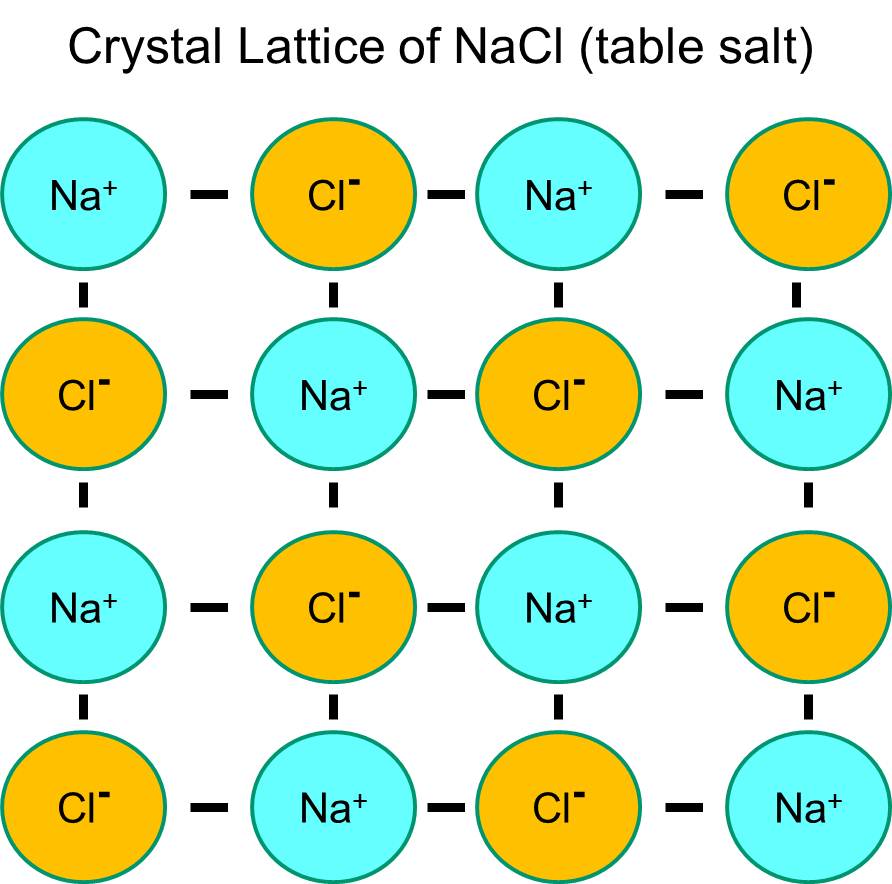
Jednakże, jeśli kryształy chlorku sodu zostaną umieszczone w wodzie, polarne cząsteczki wody „uwodnią” atomy sodu i chlorku, ponieważ cząsteczki wody są polarne. Na poniższej ilustracji ciemniejsze niebieskie figury w kształcie litery V reprezentują cząsteczki wody, które są polarne. Dodatnie końce cząsteczek wody są przyciągane przez ujemnie naładowane jony chlorkowe, podczas gdy ujemny biegun cząsteczki wody jest przyciągany przez dodatnie jony sodu. W wyniku tego jony zostają uwodnione, a sieć krystaliczna rozpuszcza się w roztworze wodnym. Dokładnie to samo dzieje się po dodaniu krystalicznej soli kuchennej do szklanki wody.
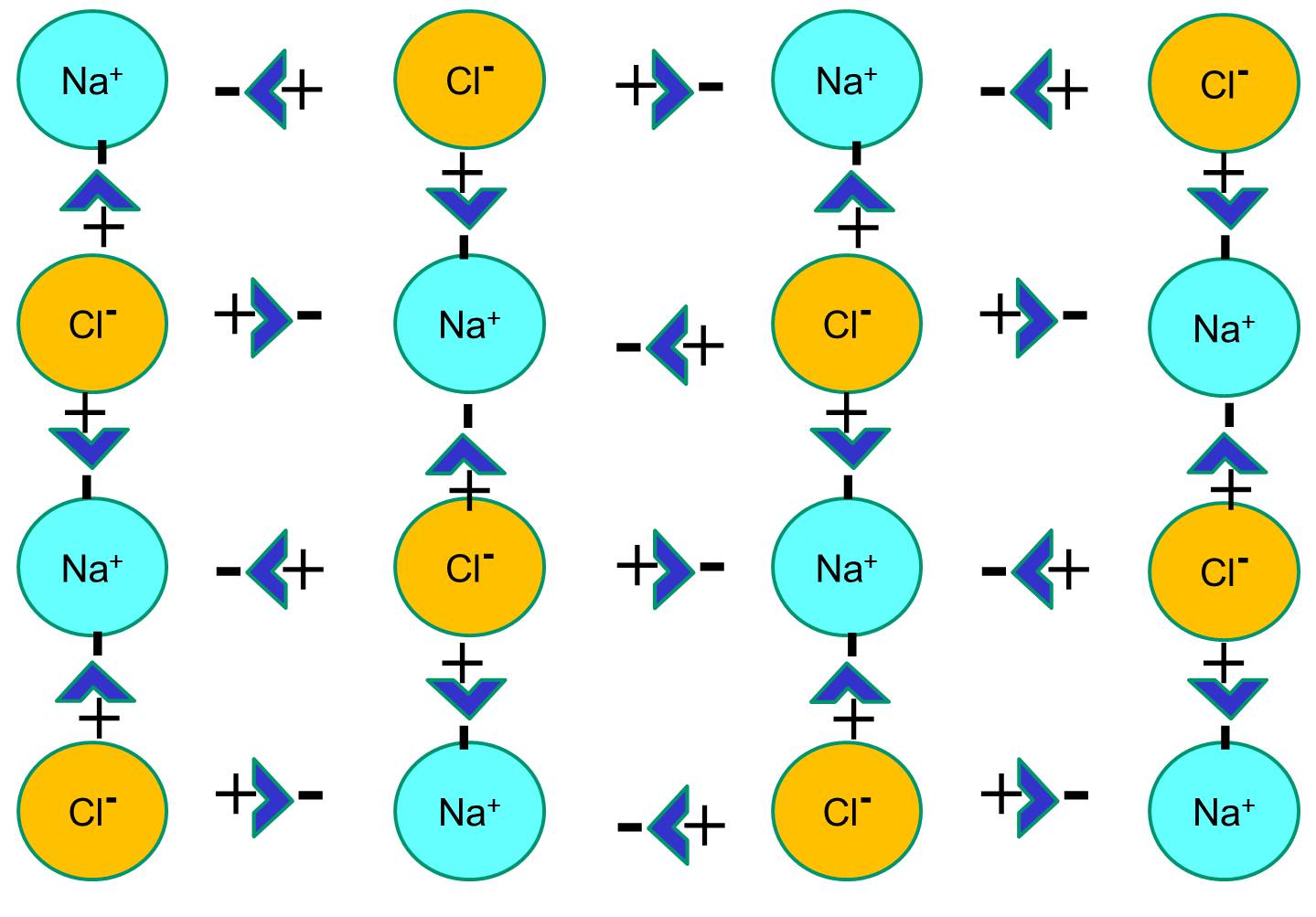
.