 Toda a matéria, viva ou não, é composta por elementos químicos; estes são produtos químicos fundamentais no sentido em que são o que são – não podem ser transformados em outro elemento. Cada elemento distingue-se pelo número de protões
Toda a matéria, viva ou não, é composta por elementos químicos; estes são produtos químicos fundamentais no sentido em que são o que são – não podem ser transformados em outro elemento. Cada elemento distingue-se pelo número de protões , neutrões
, neutrões , e electrões
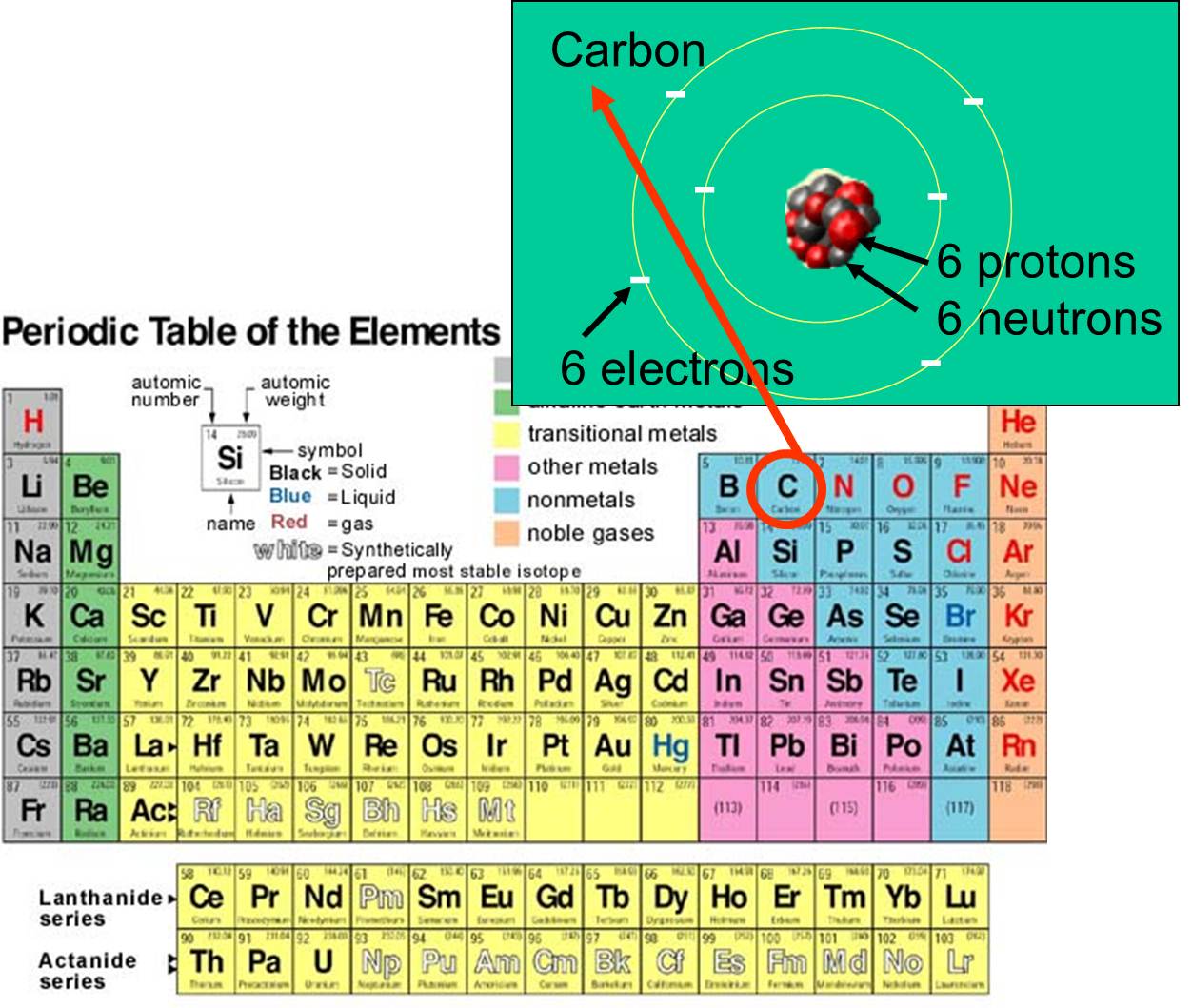
, e electrões que possui. Por exemplo, o número atômico do carbono é 6, e tem uma massa atômica de cerca de 12, porque tem 6 prótons positivamente carregados e 6 nêutrons não carregados. Os 6 elétrons carregados contribuem muito pouco para a massa atômica. Existem 92 elementos que ocorrem naturalmente na Terra. O conjunto de elementos e sua estrutura subatômica são resumidos pela tabela periódica dos elementos, mostrada à direita.
que possui. Por exemplo, o número atômico do carbono é 6, e tem uma massa atômica de cerca de 12, porque tem 6 prótons positivamente carregados e 6 nêutrons não carregados. Os 6 elétrons carregados contribuem muito pouco para a massa atômica. Existem 92 elementos que ocorrem naturalmente na Terra. O conjunto de elementos e sua estrutura subatômica são resumidos pela tabela periódica dos elementos, mostrada à direita.
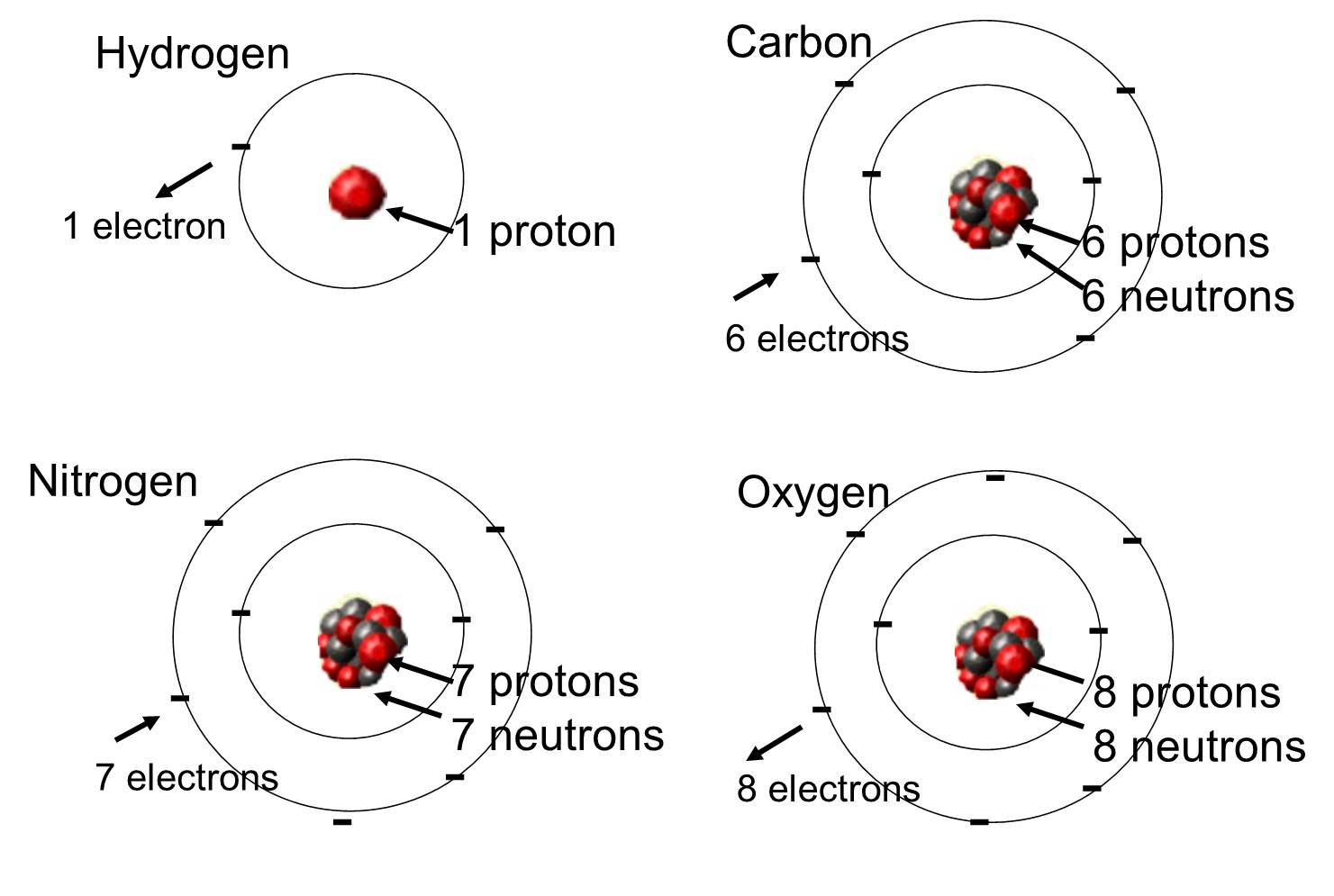
Em organismos vivos os elementos mais abundantes são o carbono, hidrogênio e oxigênio. Estes três elementos, juntamente com nitrogênio, fósforo e um punhado de outros elementos, representam a grande maioria da matéria viva. Um átomo é uma única unidade de um elemento químico. Alguns destes elementos que são abundantes em moléculas orgânicas são mostrados abaixo.
 Os átomos podem combinar-se com outros átomos formando ligações químicas.
Os átomos podem combinar-se com outros átomos formando ligações químicas.
Ligações covalentes
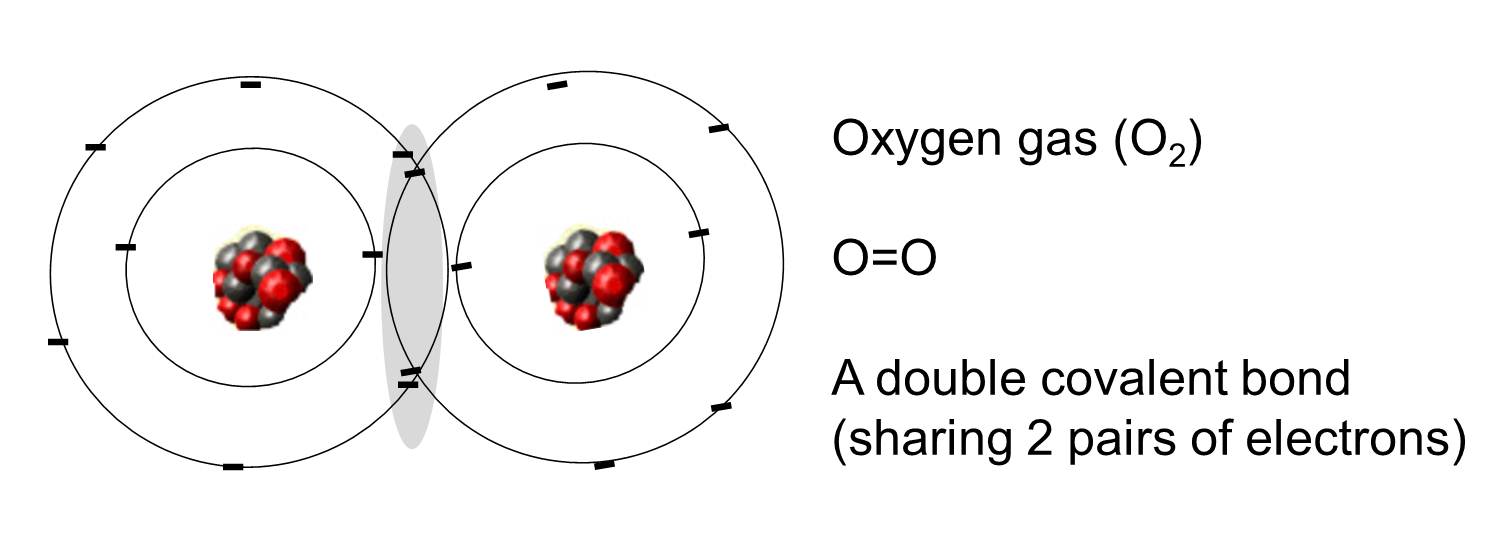
Uma ligação covalente é aquela em que um ou mais pares de elétrons são compartilhados por dois átomos. A ilustração à direita mostra dois átomos de oxigênio que são covalentemente ligados pela partilha de dois pares de elétrons como ilustrado na área sombreada.
A figura abaixo mostra uma série de moléculas formadas por ligação covalente. Rato sobre cada molécula para ver uma breve descrição.
, 
A água é uma Molécula Polar
Note também que a partilha de electrões nem sempre é igual. Por exemplo, numa molécula de água, os electrões com carga negativa passam mais tempo na proximidade do átomo de oxigénio mais pesado.
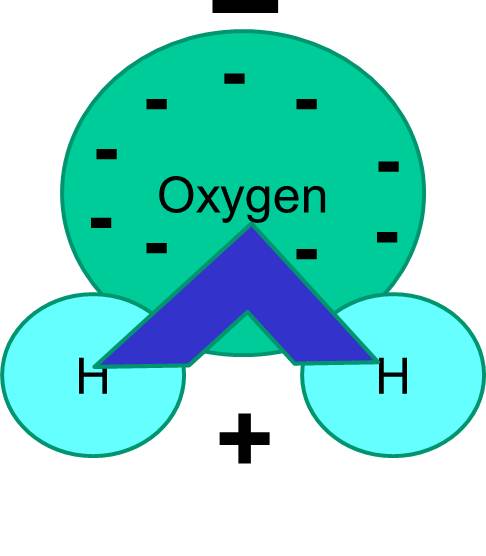
O resultado líquido é que a molécula de água tem uma extremidade que é mais negativa em relação à outra extremidade. A água é, portanto, uma molécula “polar”. Veremos que esta polaridade tem implicações importantes para muitos fenómenos biológicos, incluindo a estrutura celular. Você já deve ter ouvido a expressão “como se dissolve como”. O que isto significa é que as moléculas polares dissolvem-se bem em fluidos polares como a água. Açúcares (por exemplo, glucose) e sais são moléculas polares, e dissolvem-se na água, porque as partes positivas e negativas dos dois tipos de moléculas podem se distribuir confortavelmente uma entre as outras.
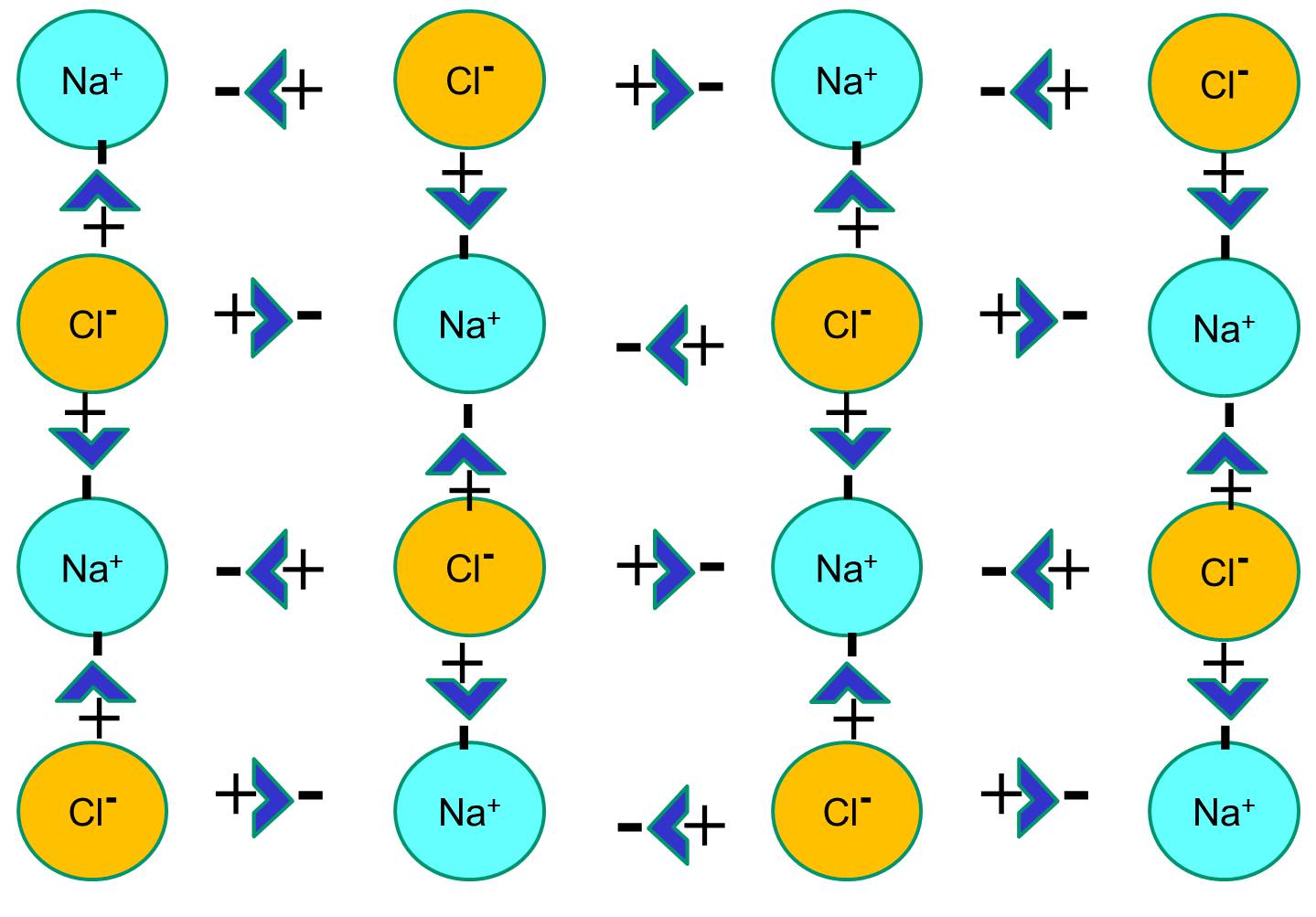
Ligações iónicas
O sódio tem um único electrão na sua casca orbital mais externa, e é termodinamicamente mais estável se desistir deste electrão. Esta perda de um elétron negativo resulta em um íon de sódio carregado positivamente, abreviado Na+. O cloro, por outro lado, tem sete elétrons na sua casca orbital externa, e é mais estável termodinamicamente se adquirir um elétron extra para completar a casca orbital externa. Isto resulta num ião cloreto carregado negativamente, abreviado Na+. Os íons sódio carregados positivamente e os íons cloreto carregados negativamente atraem uns aos outros e resultam na formação de uma ligação iônica. Na ausência de água, sódio e cloreto formam uma malha de cristal devido à atração de íons negativos e positivos.
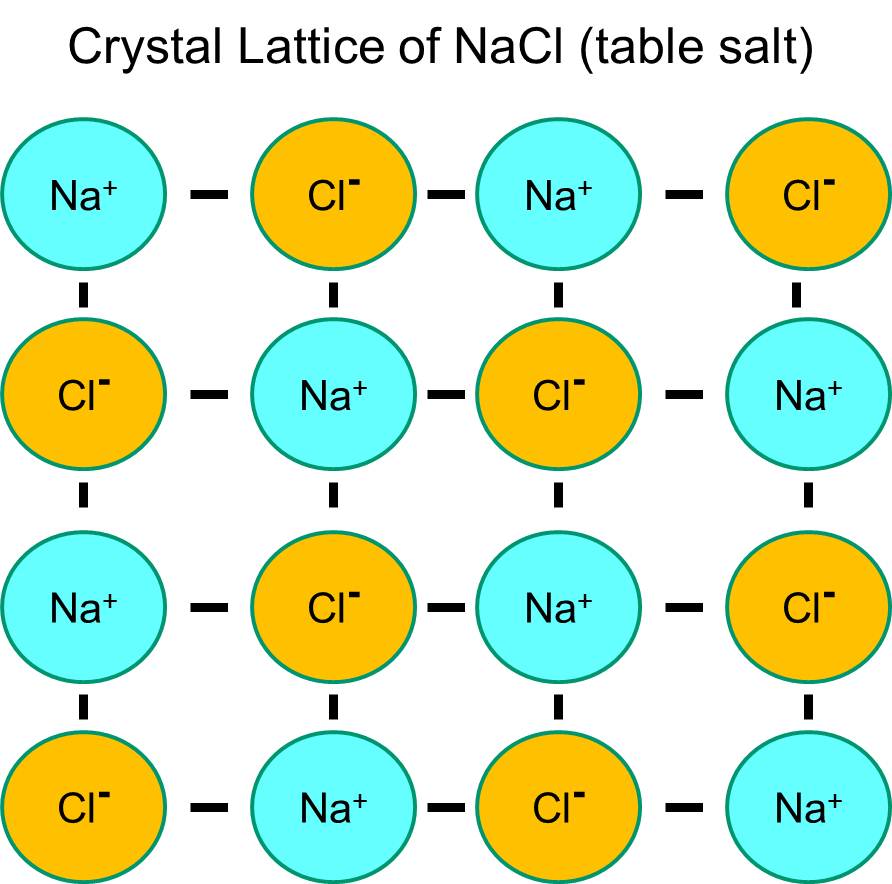
No entanto, se os cristais de cloreto de sódio forem colocados na água, as moléculas polares da água “hidratarão” os átomos de sódio e cloreto porque as moléculas da água são polares. Na ilustração abaixo as figuras em V, de cor azul escura, representam moléculas de água, que são polares. As extremidades positivas das moléculas da água são atraídas pelos íons cloreto carregados negativamente, enquanto o pólo negativo da molécula da água é atraído para os íons sódio positivo. Como resultado, os íons são hidratados e a malha de cristal dissolve-se na solução aquosa. Isto é exactamente o que acontece quando se adiciona sal de mesa cristalino a um copo de água.