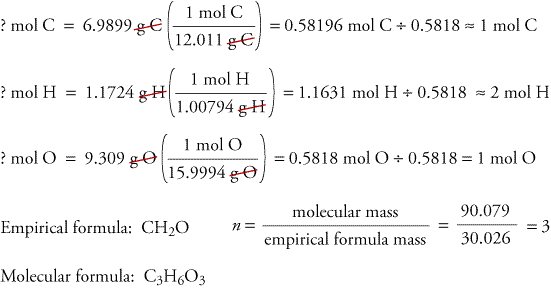Obținerea formulelor empirice și moleculare din datele de combustie
Formulele empirice și moleculare pentru compușii care conțin numai carbon și hidrogen (CaHb) sau carbon, hidrogen și oxigen (CaHbOc) pot fi determinate printr-un procedeu numit analiza combustiei. Pașii pentru acest procedeu sunt
Cântăriți o probă din compusul care urmează să fie analizat și plasați-o în aparatul prezentat în imaginea de mai jos.
Ardeți complet compusul. Singurii produși ai arderii unui compus care conține numai carbon și hidrogen (CaHb) sau carbon, hidrogen și oxigen (CaHbOc) sunt dioxidul de carbon și apa.
H2O2 și CO2 sunt aspirate prin două tuburi. Un tub conține o substanță care absoarbe apa, iar celălalt conține o substanță care absoarbe dioxidul de carbon. Cântărește fiecare dintre aceste tuburi înainte și după combustie. Creșterea de masă în primul tub este masa de H2O care s-a format în urma combustiei, iar creșterea de masă pentru cel de-al doilea tub este masa de CO2 formată.
Să presupunem că tot carbonul din compus a fost transformat în CO2 și a fost reținut în cel de-al doilea tub. Calculați masa de carbon din compus pornind de la masa de carbon din masa măsurată de CO2 formată.
Să presupunem că tot hidrogenul din compus a fost transformat în H2O și blocat în primul tub. Calculați masa hidrogenului din compus pornind de la masa de hidrogen din masa măsurată de apă.
Dacă compusul conține oxigen, precum și carbon și hidrogen, calculați masa oxigenului scăzând masa de carbon și hidrogen din masa totală a probei inițiale de compus.
Utilizați aceste date pentru a determina formulele empirice și moleculare în mod obișnuit.
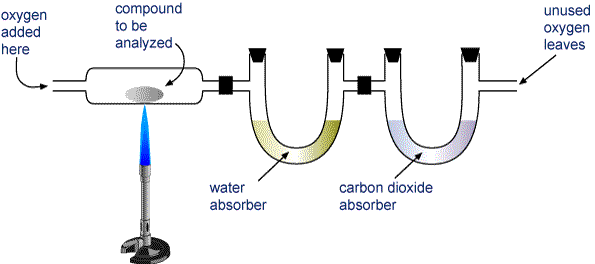
Aparat pentru analiza combustiei Un compus care conține carbon și hidrogen (CaHb) sau carbon, hidrogen și oxigen (CaHbOc) este ars complet pentru a forma H2O și CO2. Produsele sunt trase prin două tuburi. Primul tub absoarbe apa, iar al doilea tub absoarbe dioxidul de carbon.
Pentru a ilustra modul în care formulele empirice și moleculare pot fi determinate din datele obținute din analiza combustiei, să luăm în considerare o substanță numită trioxan. Formaldehida, CH2O, este instabilă ca gaz pur, formând cu ușurință un amestec de o substanță numită trioxan și un polimer numit paraformaldehidă. Acesta este motivul pentru care formaldehida este dizolvată într-un solvent, cum ar fi apa, înainte de a fi vândută și utilizată. Formula moleculară a trioxanului, care conține carbon, hidrogen și oxigen, poate fi determinată cu ajutorul datelor din două experimente diferite. În primul experiment, 17,471 g de trioxan sunt arse în aparatul prezentat mai sus și se formează 10,477 g H2O și 25,612 gCO2. În al doilea experiment, se constată că masa moleculară a trioxanului este de 90,079.
Se poate obține formula moleculară a unui compus din formula sa empirică și din masa sa moleculară. (A se vedea textul pentru o reamintire a modului în care se face acest lucru.) Pentru a obține formula empirică, trebuie să determinăm masa în grame a carbonului, hidrogenului și oxigenului din 17,471 g de trioxan. Astfel, trebuie să efectuăm acești pași generali.
În primul rând, convertiți din datele date în grame de carbon, hidrogen și oxigen.
În al doilea rând, determinați formula empirică pornind de la gramele de carbon, hidrogen și oxigen.
În al treilea rând, determinați formula moleculară pornind de la formula empirică și de la masa moleculară dată.
Pentru că presupunem că tot carbonul din trioxan a reacționatpentru a se forma în CO2, putem afla masa de carbon din 17,471 g de trioxan prin calcularea masei de carbon din 25,612 g de CO2.

Pentru că presupunem că tot hidrogenul din trioxan a reacționat pentru a forma H2O,putem afla masa de hidrogen din 17,471 g trioxan calculând masa hidrogenului din 10.477 g H2O.

Pentru că trioxanul conține numai carbon, hidrogen și oxigen, putem calcula masa de oxigen scăzând masele de carbon și hidrogen din masa totală a trioxanului.
? g O = 17,471 g trioxan – 6,9899 g C – 1,1724 g H = 9.309 g O
Calculăm acum formula empirică, masa formulei empirice și formula moleculară.
EșantionFață de studiu: Calcularea formulelor moleculare din datele de combustie
Tip-off- Doriți să calculați formula moleculară a unui compus care conține numai carbon și hidrogen (CaHb) sau carbon,hidrogen și oxigen (CaHbOc) și vi se dau masa sa moleculară și masele de CO2 și H2Oformate în arderea unei anumite mase de compus.
Procedură generală
Calculați numărul de grame de carbon din compus prin calcularea numărului de grame de carbon din cantitatea dată de CO2.
Calculează numărul de grame de hidrogen din compus prin calcularea numărului de grame de hidrogen din cantitatea dată de H2O.
Dacă compusul conține oxigen, se calculează numărul de grame de oxigen din el scăzând masele de carbon și hidrogen din masa totală dată a compusului.
? g O = (dat) g total – (calculat) g C – (calculat) g H
Calculați formula empirică a compusului din gramele de carbon, hidrogen și oxigen.
Calculați masa formulei pentru formula empirică și împărțiți masa moleculară dată la masa formulei empirice pentru a obține n.
Înmulțiți fiecare indice din formula empirică cu n pentru a obține formula moleculară.
EXEMPLU – Obținerea unei formule moleculare din date de combustie:
Dianabol este unul dintre steroizii anabolizanți care a fost folosit de uniiatleți pentru a crește dimensiunea și forța mușchilor lor. Este asemănător cu hormonul masculin testosteron. Unele studii indică faptul că efectele dorite ale medicamentului sunt minime, iar efectele secundare, care includ sterilitatea șicreșterea riscului de cancer la ficat și boli de inimă, îi împiedică pe cei mai mulți oameni să îl folosească. Formula moleculară a Dianabolului, care constă din carbon, hidrogen și oxigen, poate fi determinată cu ajutorul datelor din două experimente diferite. În primul experiment, se ard 14,765 g de Dianabol și se formează 43,257 g de CO2 și 12,395 g de H2O.În cel de-al doilea experiment, se constată că masa moleculară a Dianabolului este de 300,44. Care este formula moleculară a Dianabolului?
Soluție:
.