DOI: 10.17235/reed.2016.4095/2016
ORIGINAL PAPERS
Asocierea dintre localizarea polipilor de colon la momentul inițial și colonoscopia de supraveghere – Un studiu retrospectiv
Ana Oliveira, Paulo Freire, Paulo Souto, Manuela Ferreira, Sofia Mendes, Clotilde Lérias, Pedro Amaro, Francisco Portela și Carlos Sofia
Departamentul de Gastroenterologie. Centro Hospitalar e Universitário de Coimbra. Coimbra, Portugalia.
Correspondență
ABSTRACT
Introducere: Mai mulți factori sunt utilizați pentru a stratifica probabilitatea de recidivă a polipilor. Cu toate acestea, nu există studii care să coreleze localizarea polipilor inițiali și a celor recurenți. Scopul acestui studiu a fost de a verifica dacă localizarea polipilor la colonoscopia de supraveghere a fost corelată cu localizarea polipilor extirpați anterior la colonoscopia inițială.
Metode: Un studiu retrospectiv al pacienților supuși colonoscopiei cu prezența și excizia tuturor polipilor, urmată de o colonoscopie de supraveghere. Localizarea polipilor a fost împărțită în proximal/distal față de flexura splenică și rect. Au fost evaluate, de asemenea, caracteristicile și ratele recurente la aceeași localizare a colonului.
Rezultate: Dintre cei 346 de pacienți care au fost supuși colonoscopiei repetate, la 268 (77,4%) a fost detectat cel puțin 1 polip. Pentru toate segmentele a existat un risc crescut de polipi recurenți în aceeași locație și a fost de aproximativ patru ori mai mare în segmentele de colon proximal (OR 3,5; IC 2,1-6,0) și distal (OR 3,8; IC 2,1-6,8), urmat de trei ori mai mare în rect (OR 2,6; IC 1,5-4,6). Nu s-a constatat nicio diferență între ratele de recidivă la nivelul aceluiași segment, luând în considerare morfologia polipilor, dimensiunea, tehnica de polipectomie utilizată și clasificarea histologică.
Concluzie: Pare să existe o asociere semnificativă între localizarea polipilor la momentul inițial și colonoscopia de supraveghere.
Locuțiuni cheie: Colon. Polip. Localizare. Recidivă.
Introducere
Adenomii de colon și rect sunt leziuni neoplazice benigne comune descoperite la aproximativ 25% dintre pacienții supuși colonoscopiei (1). Cancerul colorectal (CCR) este al treilea cel mai frecvent cancer și a patra cauză de deces prin cancer la nivel mondial (2). Colonoscopia și detectarea și rezecția endoscopică a leziunilor precanceroase duc la o reducere a incidenței și mortalității cauzate de CCR (3). Această reducere a riscului pare să fie mai puternică pentru colonul distal. Cu toate acestea, s-a observat o reducere cu 77% a incidenței și o scădere cu 29-37% a deceselor legate de CCR cu ajutorul colonoscopiei (4,5). Colonoscopia de supraveghere este recomandată la pacienții cu polipi adenomatoși anteriori, din cauza riscului de leziuni metacrone, recurente și noi (6). Riscul de a găsi adenoame la colonoscopia de supraveghere depinde de rezultatele colonoscopiei inițiale. Rata este mai mare la pacienții cu adenoame avansate, intermediară în cazul adenoamelor neavansate și mai mică la pacienții fără adenoame (7). În ciuda importanței colonoscopiei, cancerele de colon de interval sunt descoperite după o colonoscopie anterioară cu polipectomie sau cu rezultate negative (3,8). Acest lucru se poate întâmpla din cauza mai multor factori, cum ar fi leziuni ratate, recidiva polipilor îndepărtați incomplet sau leziuni noi care s-au dezvoltat de la colonoscopia anterioară (9). Există mai mulți factori utilizați pentru a stratifica probabilitatea de recidivă a polipilor, inclusiv histologia, dimensiunea și numărul acestora. Unele studii favorizează, de asemenea, colonul proximal ca marker al recurenței viitoare a adenomului (10), sau chiar o anumită asociere între recurența proximală sau distală (7,11). Astfel, scopul acestui studiu a fost de a verifica dacă localizarea polipilor la colonoscopia de supraveghere a fost asociată cu localizarea polipilor extirpați anterior la colonoscopia de bază.
Material și metode
Am efectuat un studiu retrospectiv al pacienților supuși la două colonoscopii: o colonoscopie index cu polipi și o colonoscopie de supraveghere cu sau fără polipi. Am definit o asociere pozitivă în ceea ce privește recurența polipilor în aceeași locație dacă cel puțin un polip metacronic la colonoscopia de supraveghere se afla în același segment de colon, ca la una sau mai multe dintre colonoscopiile index.
Pacienții au fost înrolați de la Departamentul de Gastroenterologie din ianuarie 2004 până în decembrie 2014. Criteriile de includere au inclus pacienți cu vârsta peste 18 ani, cu două colonoscopii de înaltă calitate, cu un interval de cel puțin un an între ele și excizia tuturor polipilor detectați în colonoscopia de referință. Criteriile colonoscopiei de înaltă calitate au presupus ca aceasta să fi fost efectuată de un colonoscopist cu experiență, gradul de curățare intestinală evaluat cu scala Ottawa Bowel Preparation Scale (OBPS) să fi fost excelent sau bun și să se fi realizat intubația cecală. Au fost analizate dosarele medicale ale pacienților. Am colectat datele demografice ale pacienților, inclusiv sexul și vârsta. Au fost înregistrate datele din rapoartele de colonoscopie, inclusiv numărul de polipi, dimensiunea, morfologia și localizarea lor, precum și tehnica de rezecție. Leziunile au fost clasificate în conformitate cu Clasificarea de la Paris (12). Au fost excluse leziunile nepolipoide de tip 0 și polipii mai mari de 20 mm. Am clasificat localizarea polipilor în proximal sau distal față de flexura splenică și rect. Tehnica de rezecție a fost împărțită în rezecție cu forceps de biopsie la rece, excizie standard cu snare și injecție submucoasă, urmată de rezecție. Aceste date au fost colectate din ambele colonoscopii. Raportul histologic a fost obținut de la toți polipii îndepărtați și recuperați din ambele colonoscopii. Diagnosticul histopatologic a fost clasificat în conformitate cu Clasificarea de la Viena revizuită (13). Polipii au fost, de asemenea, clasificați în funcție de arhitectura glandulară în tubulari, tubulovilloși, viloși și zimțați. Aceste date au fost apoi utilizate pentru a stratifica adenoamele în adenoame avansate și neavansate. Astfel, un adenom avansat a fost considerat un adenom avansat atunci când avea 1 cm sau mai mult și prezenta histologie viloasă sau displazie de grad înalt (6). Analizele histologice ale marginilor de rezecție au fost clasificate astfel: rezecție completă (R0), marginile de rezecție nu au putut fi evaluate complet (Rx) sau a fost prezentă o leziune reziduală (R1). Criteriile de excludere au inclus pacienții supuși unei intervenții chirurgicale la nivelul colonului sau cu antecedente de CCR înainte de colonoscopia de bază, boli inflamatorii intestinale sau sindrom de polipoză.
Comitetul de etică a aprobat studiul. Toți autorii au avut acces la date și au revizuit și aprobat manuscrisul final.
Analize statistice
Datele noastre preliminare indică faptul că polipii detectați în timpul colonoscopiei de supraveghere vor apărea în aceeași locație cu cei observați la momentul inițial în cel puțin 20% din cazuri. Stabilind α la 0,05, puterea la 80% și raportul caz-control la 1:2, am estimat că ar fi necesari 195 de pacienți.
Variabilele categoriale au fost exprimate ca frecvență și procent. Variabilele continue au fost exprimate ca medie (derivare standard, DS). Testul Kolmogorov-Smirnov a fost utilizat pentru a evalua normalitatea. Variabilele categoriale au fost comparate cu testul Chi pătrat, iar variabilele continue au fost comparate cu testul t al lui Student pentru datele distribuite normal sau cu testul U al lui Mann-Whitney dacă datele nu prezentau o distribuție normală. Pentru a determina concordanța dintre rezultatele celor două colonoscopii s-a utilizat testul Kappa al lui Cohen. Odds ratio (OR) a fost calculat cu un interval de încredere (IC) de 95%; un IC care nu a inclus 1,0 a indicat faptul că a existat o relație semnificativă între variabile. Diferențele dintre date au fost considerate a fi semnificative din punct de vedere statistic atunci când valoarea p bilaterală a fost mai mică de 0,05.
În primul rând, au fost analizate Rezultatele ambelor colonoscopii. Apoi, a fost calculată concordanța ratelor de recurență pentru aceeași localizare în colonoscopia de bază și în colonoscopia de supraveghere. Am evaluat în continuare posibilii factori care ar putea contribui la recurența polipilor în aceeași locație, cum ar fi caracteristicile polipilor sau caracteristicile histologice.
Analiza datelor a fost realizată cu ajutorul programului Statistical Package for Social Sciences-SPSS (SPSS Inc. USA), IBM®, software de calculator pentru Mac OS X (versiunea 21).
Rezultate
Dintre cei 346 de pacienți supuși la două colonoscopii de înaltă calitate cu polipi la colonoscopia index, 78 nu au avut polipi la colonoscopia de supraveghere. Prin urmare, un total de 268 de pacienți au fost înrolați în studiu (Fig. 1). Pacienții au avut o vârstă medie de 64 (SD 10) ani, variind de la 29 la 82 de ani, cu predominanță masculină (64,9%).
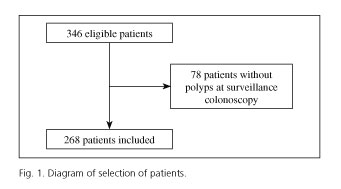
Perioada medie de interval între cele două colonoscopii a fost de 37 (SD 20) luni.
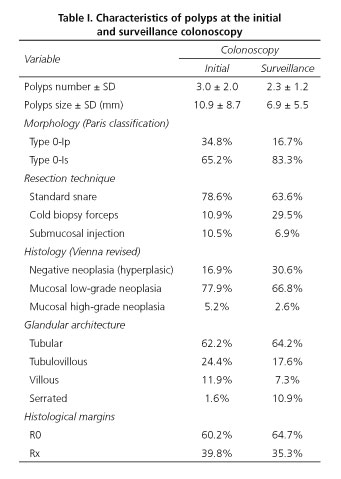
Caracteristicile polipilor găsiți la colonoscopia inițială și de supraveghere sunt descrise în tabelul I. La colonoscopia inițială, numărul mediu de polipi detectați și rezecați a fost de 3,0 (SD 2,0), iar la colonoscopia de supraveghere acest număr a fost mai mic de 2,3 (SD 1,2). În ceea ce privește caracteristicile polipilor, la prima colonoscopie, dimensiunea medie a fost de 10,9 mm (SD 8,7), iar la a doua colonoscopie polipii au fost mai mici, măsurând în medie 6,9 mm (SD 5,5). Inițial, morfologia a fost de tip 0-Ip la 34,8% și de tip 0-Is la 65,2%; iar la a doua colonoscopie am continuat să observăm că morfologia sesilă a fost predominantă, dar într-o proporție mai mare, având în vedere că procentul de polipi de tip 0-Is a fost de 83,3%. Arhitectura glandulară a fost similară în ambele cazuri, cu excepția incidenței mai mari a polipilor zimțați la colonoscopia de supraveghere (1,6% vs. 10,9%).
La colonoscopia inițială, 42,5% dintre pacienți aveau polipi în colonul proximal, 75,0% în colonul distal și 30,2% în rect. La colonoscopia de supraveghere, distribuția a fost similară: 52,6% în colonul proximal, 60,1% în colonul distal și 25,0% în rect. Rata generală de concordanță a localizării polipilor între colonoscopii a fost de 44%. Tabelul II prezintă probabilitatea de recurență la nivelul aceluiași segment de colon. Pentru toate segmentele colonului există un risc crescut de recurență a polipilor în aceeași locație. Acest risc este similar atât pentru segmentele proximale (OR 3,5; IC 2,1-6,0), cât și pentru cele distale ale colonului (OR 3,8; IC 2,1-6,8), urmate de rect (OR 2,6; IC 1,5-4,6), p < 0,001. Valorile Kappa au fost de 0,29 (IC 95%; 0,19-0,41) și 0,27 (0,16-0,38) pentru colonul proximal și, respectiv, distal, ceea ce arată o putere de concordanță destul de bună și 0,20 (IC 0,08-0,33) pentru rect, ceea ce înseamnă o concordanță slabă, p < 0.001 (tabelul III).


Analiza diferiților factori care ar putea contribui la recurența polipilor în aceeași localizare nu arată diferențe semnificative din punct de vedere statistic (tabelul IV). Cu toate acestea, a existat o mică predominanță pentru o recurență mai mare la același segment atunci când rezecția a fost efectuată cu injecție submucoasă (70,4%, comparativ cu forcepsul de biopsie (68,3%) și snare (61,4%) și pentru polipii hiperplastici (75,7%), comparativ cu polipii cu displazie de grad scăzut (66,7%) sau de grad înalt (66,7%). Nu a existat nicio diferență în ceea ce privește marginile histologice și, deși Rx (68,1%) a fost mai frecventă decât rezecția completă (53,3%), acest lucru nu a avut semnificație statistică (p = 0,511). De asemenea, nu a existat nicio diferență în ceea ce privește probabilitatea de recidivă la aceeași localizare după stratificare în cazul adenomului avansat (70,8%), adenomului neavansat (61,9%) și adenomului hiperplastic (75,7%), p = 0,216. Timpul dintre colonoscopii nu a fost asociat cu recurența polipilor în același loc (36 vs. 38 luni).

Discuție
În studiul nostru am găsit o asociere semnificativă între localizarea inițială a polipilor și cea recurentă. Pentru toate segmentele colonului, prezența polipilor la colonoscopia inițială conferă un risc semnificativ de recurență în aceeași localizare la colonoscopia de supraveghere. Acest risc este de aproximativ patru ori mai mare în colonul distal, urmat îndeaproape de colonul proximal. Există mai multe explicații posibile pentru această rată ridicată de concordanță a localizării. În primul rând, la pacienții cu antecedente de rezecție a polipilor, colonoscopistul poate spori atenția asupra locurilor de detectare anterioară a polipilor. Un alt motiv este legat de reapariția polipilor din cauza îndepărtării incomplete. Cu scopul de a reduce rezecția incompletă ca factor de recurență, am exclus leziunile plate și mai mari. De asemenea, în acest studiu, marginile histologice ale rezecției (leziune completă vs. leziune reziduală) nu au fost implicate în rata de recurență. Rata de ratare a polipilor este de aproximativ 20% și crește pe măsură ce dimensiunea leziunilor scade (14). Adenoamele lipsă pot explica, de asemenea, polipii recurenți, deși am încercat să reducem acest factor prin selectarea doar a colonoscopiilor de înaltă calitate. O altă posibilitate pentru această rată ridicată a acordului de localizare este legată de dezvoltarea de noi leziuni. Aceste noi leziuni se pot datora absenței unui efect inhibitor după îndepărtarea polipilor (7) sau efectelor locale care favorizează carcinogeneza, cum ar fi inflamația sau leziunile repetate/persistente (9). În plus, aceste noi leziuni pot fi asociate cu o cale de carcinogeneză diferită și mai rapidă. S-a demonstrat că cancerele de interval după polipectomie apar mai frecvent decât era de așteptat în segmentul de polipectomie anterioară (9). Acest studiu consolidează aceste constatări anterioare, demonstrând că polipii tind, de asemenea, să recidiveze în aceeași locație. În cazul cancerelor de interval, studiile arată că 70-80% se datorează predominant leziunilor lipsă, mai degrabă decât unor leziuni noi (15,16).
Se știe că ratele de recurență a adenomului sunt estimate la aproximativ 30-40%, la 3 până la 4 ani după colonoscopia inițială (8,17). Riscul de recurență a adenoamelor la colonoscopia de supraveghere depinde de constatările de la cea anterioară. Riscul este mai mare în cazul adenoamelor avansate și/sau multiple (7,10,18). Pornind de la această ipoteză, am analizat caracteristicile polipilor (dimensiune, morfologie și histologie), marginile de rezecție (prezența țesutului hiperplazic sau adenomatos), precum și tehnica utilizată pentru efectuarea polipectomiei. Nu am găsit niciun factor semnificativ din punct de vedere statistic care ar putea contribui la recidivă în aceeași localizare. Chiar și după stratificarea adenomului în adenom avansat, nu a existat un factor de recurență.
Nu pare să existe o asociere între probabilitatea de detectare a adenoamelor în colonoscopia de supraveghere după o colonoscopie cu doar polipi hiperplazici (19). În studiul nostru, am constatat că la a doua colonoscopie a existat un număr crescut de polipi hiperplazici, deși tipul histologic nu a contribuit la recurența în același loc. Acest lucru poate fi justificat ca o reacție locală care induce o hiperproliferare a mucoasei, deoarece polipii hiperplazici sunt compuși din componente celulare normale. Leziunile hiperplastice pot dobândi mutații, în special K-ras, dar și mutații BRAF, care au potențialul de a transforma aceste leziuni în cancer (20-22). Nu doar polipii hiperplastici, ci și polipii zimțați au potențial de CCR (23). Polipii zimțați au fost identificați mai frecvent la a doua colonoscopie (deși nu au contribuit ca factor de recurență). Acest lucru poate fi explicat prin diferențe în momentul în care patologii și-au făcut analiza. Polipii zimțați clasificați de obicei ca hiperplastici sunt acum clasificați în același grup cu tumorile zimțate. Polipii zimțați sesili sau adenoamele zimțate sunt în mod normal mici sau plate, pot crește mai repede și pot progresa pe o cale diferită de carcinogeneză. Ei sunt, de asemenea, asociați cu o rată mai mare de îndepărtare incompletă (24,25).
Există limitări în studiul nostru. Populația studiată include un eșantion mic, înregistrat retrospectiv, și a fost realizat într-un spital universitar, astfel încât aceste Rezultate pot să nu fie reprezentative pentru populația generală. În studiul nostru, nu am inclus nici factorii de risc potențiali asociați cu dezvoltarea cancerului/polipilor, cum ar fi fumatul (26), consumul de carne roșie și indicele de masă corporală ridicat (27), nici factorii de protecție, cum ar fi acidul acetilsalicilic sau medicamentele antiinflamatoare nesteroidiene (28) și ingestia de fructe (29). Deși colonoscopiști cu înaltă pregătire au efectuat toate colonoscopiile, echipa a inclus mai mulți medici care au trecut de la colonoscopia de bază la cea de supraveghere. În plus, așa cum s-a afirmat anterior, trebuie întotdeauna luată în considerare posibilitatea de a rata adenoame.
În concluzie, pare să existe o asociere semnificativă în ceea ce privește localizarea polipilor la colonoscopia de bază și cea de supraveghere. Acest lucru ar putea avea implicații viitoare în ceea ce privește execuția tehnică și acuratețea colonoscopiilor, inclusiv avertizarea pentru o inspecție precaută a segmentelor în care polipii au fost îndepărtați anterior. De asemenea, ar fi interesant de explorat rolul unui efect de câmp, prin compararea caracteristicilor histologice și a caracteristicilor moleculare ale mucoasei din apropierea polipilor extirpați cu mucoasa rămasă. Aceste constatări necesită cercetări suplimentare, în mod ideal prin intermediul unui studiu prospectiv și multicentric cu o populație de studiu mai mare.
1. Giacosa A, Frascio F, Munizzi F. Epidemiologia polipilor colorectali. Tech Coloproctol 2004;2:s243-7. DOI: 10.1007/s10151-004-0169-y.
2. Ferlay J, Soerjomataram I, Dikshit R, et al. Incidența și mortalitatea prin cancer la nivel mondial: Surse, metode și modele majore în GLOBOCAN 2012. Int J Cancer 2014;136(5):E359-86. DOI: 10.1002/ijc.29210.
3. Zauber AG, Winawer SJ, O’Brien MJ, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer-cancer deaths. N Engl J Med 2012;366:687-696. DOI: 10.1056/NEJMoa1100370.
4. Brenner H, Chang-Claude J, Seiler CM, et al. Protecția împotriva cancerului colorectal după colonoscopie: Un studiu caz-control, bazat pe populație. Ann Intern Med 2011;154:22-30. DOI: 10.7326/0003-4819-154-1-201101040-00004.
5. Baxter N, Goldwasser M, Paszat L, et al. Association of colonoscopy and death from colorectal cancer. Annals of Internal Medicine 2009;150:1-8. DOI: 10.7326/0003-4819-150-1-200901060-00306.
6. Lieberman DA, Rex DK, Sidney JW, et al. Guidelines for colonoscopy surveillance after cancer resection: A consensus update by the American Cancer Society and the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2012;143:844-57. DOI: 10.1053/j.gastro.2012.06.001.
7. Pinsky P, Schoen R, Weissfeld J, et al. The yield of surveillance colonoscopy by adenoma history and time to examination. Clin Gastroenterol Hepatol 2009;7:86-92. DOI: 10.1016/j.cgh.2008.07.014.
8. Lieberman DA, Weiss DG, Harford WV, et al. Five year colon surveillance after screening colonoscopy. Gastroenterology 2007;133:1077-85. DOI: 10.1053/j.gastro.2007.07.006.
9. Brenner H, Chang-Claude J, Jansen L, et al. Cancere colorectale apărute după colonoscopia cu detectarea polipilor: Locurile polipilor și locurile de apariție a cancerelor. Int J Cancer 2013;133:1672-9. DOI: 10.1002/ijc.28166.
10. Martínez ME, Samplier R, Marshall JR, et all. Caracteristicile adenomului ca factori de risc pentru recurența adenoamelor avansate. Gastroenterology 2001;120:1077-83. DOI: 10.1053/gast.2001.23247.
11. Avidan B, Sonnenberg A, Schnell TG, et al. Noua apariție și recurența neoplasmelor în decurs de 5 ani de la o colonoscopie de screening. Am J Gastroenterol 2002;97:1524-9. DOI: 10.1111/j.1572-0241.2002.05801.x.
12. Participanți la atelierul de lucru de la Paris. Clasificarea endoscopică de la Paris a leziunilor neoplazice superficiale: esofag, stomac și colon: 30 noiembrie – 1 decembrie 2002. Gastrointest Endosc 2003;58:S3-S43.
13. Schlemper RJ, Riddell RH, Kato Y, et al. Clasificarea de la Viena a neoplaziilor epiteliale gastrointestinale. Gut 2000;47:251-5. DOI: 10.1136/gut.47.2.251.
14. Heresbach D, Barrioz T, Lapalus MG, et al. Rata de ratare a polipilor neoplastici colorectali: un studiu prospectiv multicentric al colonoscopiilor video back-to-back. Endoscopy 2008;40:284-90. DOI: 10.1055/s-2007-995618.
15. Pohl H, Robertson D. Cancerele colorectale detectate după colonoscopie rezultă frecvent din leziuni ratate. Clin Gastroenterol Hepatol. 2010;8:858-64. DOI: 10.1016/j.cgh.2010.06.028.
16. Singh H, Nugent Z, Demers AA, et al. Rata și predictorii cancerelor colorectale timpurii / ratate după colonoscopie în Manitoba: un studiu bazat pe populație. Am J Gastroenterol 2010;105:2588-96. DOI: 10.1038/ajg.2010.390.
17. Schoen RE. Supravegherea după examene de colonoscopie pozitive și negative: probleme, randamente și utilizare. Am J Gastroenterol 2003; 98:1237-46.
18. Huang Y, Gong W, Su B, et al. Recurența și supravegherea adenomului colorectal după polipectomie într-o populație din sudul Chinei. J Gastroenterol 2010;45:838-45. DOI: 10.1007/s00535-010-0227-3.
19. Laiyemo AO, Murphy G, Sansbury L, et al. Polipii hiperplastici și riscul de recurență a adenomului în cadrul studiului Polyp Prevention Trial. Clin Gastroenterol Hepatol 2009;7:192-7. DOI: 10.1016/j.cgh.2008.08.031.
20. Chan TL, Zhao W, Leung SY, et al. Mutații BRAF și KRAS în polipii hiperplastici colorectali și adenoamele zimțate. Cancer Res 2003;63:4878-81.
21. Spring KJ, Zhao ZZ, Karamatic R, et al. Prevalența ridicată a adenoamelor zimțate sesile cu mutații BRAF: Un studiu prospectiv al pacienților supuși colonoscopiei. Gastroenterology 2006;131:1400-7. DOI: 10.1053/j.gastro.2006.08.038.
22. Morimoto LM, Newcomb PA, Ulrich CM, et al. Factori de risc pentru polipi hiperplastici și adenomatoși: Dovezi pentru potențialul malign? Cancer Epidemiol Biomarkers Prev 2002;11:1012-8.
23. Snover DC. Actualizare privind calea zimțată către carcinomul colorectal. Hum Pathol 2011;42:1-10. DOI: 10.1016/j.humpath.2010.06.002.
24. Pohl H, Srivastava A, Bensen SP, et al. Incomplete polyp resection during colonoscopy-Results of the complete adenoma resection (CARE) study. Gastroenterology 2013;144:74-80. DOI: 10.1053/j.gastro.2012.09.043.
25. Lazarus R1, Junttila OE, Karttunen TJ, et al. The risk of metachronous neoplasia in patients with serrated adenoma. Am J Clin Pathol 2005;123:349-59. DOI: 10.1309/VBAGV3BR96N2EQTR.
26. Botteri E, Iodice S, Bagnardi V, et al. Fumatul și cancerul colorectal: O meta-analiză. JAMA 2008;300:2765-78. DOI: 10.1001/jama.2008.839.
27. Song X, Pukkala E, Dyba T, et al. Indicele de masă corporală și incidența cancerului: Studiul FINRISK. Eur J Epidemiol 2014;29:477-87. DOI: 10.1007/s10654-014-9934-z.
28. Din FV, Theodoratou E, Farrington SM, et al. Efectul aspirinei și al AINS asupra riscului și supraviețuirii de cancer colorectal. Gut 2010; 59:1670-9. DOI: 10.1136/gut.2009.203000.
29. Koushik A, Hunter DJ, Spiegelman D, et al. Fructe, legume și riscul de cancer de colon într-o analiză combinată a 14 studii de cohortă. J Natl Cancer Inst 2007;99:1471-83. DOI: 10.1093/jnci/djm155.