Dată multitudinea de funcții pe care trebuie să le îndeplinească un bioreactor, poate vă întrebați cum le poate îndeplini pe toate. De ce componente are nevoie? De unde știți care sunt în prezent condițiile din bioreactor și cum le puteți corecta? Și, în cele din urmă, doar pentru perspectivă: cum luați datele capturate în timpul unui bioproces discontinuu, le afișați într-un mod semnificativ și apoi le salvați și le evaluați, păstrându-le în același timp organizate?
Cei mai importanți parametri de proces și mecanismele de reglare a acestora sunt abordați mai jos:
- Mixarea culturii
- Controlul temperaturii
- Controlul pH-ului
- Alimentarea cu nutrienți
- Gazarea
- Presiunea. control
- Prevenirea formării de spumă
Mixarea culturii
Cultura dintr-un bioreactor trebuie să fie amestecată bine în permanență. Dacă nutrienții din bioreactor nu sunt suficient de bine dispersați, condițiile din anumite părți ale bioreactorului se vor abate semnificativ de la cele ideale. pH-ul ar putea fi prea acid, de exemplu, sau aportul de nutrienți ar putea fi insuficient. Abaterile de acest tip nu numai că reduc eficiența bioprocesului planificat, dar pot favoriza și modificările genetice. Distribuția temperaturii este o preocupare suplimentară. Fără o agitare uniformă, microorganismele sau culturile de celule de-a lungul marginii vasului vor fi literalmente fierte, în timp ce cele din mijloc se vor răci. Dacă ați încălzit vreodată supa în cuptorul cu microunde și apoi ați mâncat-o cu mare nerăbdare fără să o amestecați, veți ști la ce ne referim.
Viteza tipică de agitare variază, printre altele, în funcție de organismul cultivat:
| Organism | Viteza de amestecare | ||||
| Bacterii, Drojdii, ciuperci | 500 – 1500 min-1 | ||||
| Mamifere, Celule de insecte sau de plante | 30 – 300 min-1 | ||||
Ajustarea vitezelor de agitare pentru cultivarea fie a microorganismelor, a celulelor vegetale, a celulelor animale sau a celulelor de insecte este foarte importantă, deoarece acestea reacționează diferit la stresul de forfecare, i.e.e., tulpina mecanică provocată de agitare. În funcție de linia celulară, culturile de celule pot avea un răspuns mult mai intens la o agitare prea viguroasă, adică pur și simplu mor, o tendință pe care oamenii de știință o descriu mai exact (și mai diplomatic) ca fiind „sensibilă la stresul de forfecare”. Disponibilitatea oxigenului poate fi variată în timpul bioprocesului prin modificarea vitezei de agitare, asigurând astfel o creștere optimă a celulelor.
Măsurarea și controlul temperaturii
Microorganismele și culturile celulare deopotrivă au enzime care funcționează cel mai bine în anumite intervale de temperatură și pH. Dacă condițiile nu se încadrează în aceste intervale, bioprocesul dorit se va desfășura mult mai lent, deoarece creșterea și performanța metabolică depind în mare măsură de aceste enzime, adică de proteinele active din punct de vedere catalitic. În cel mai rău caz, condițiile nefavorabile de mediu le pot chiar distruge. Culturile de celule de mamifere se simt cel mai bine într-o gamă foarte îngustă de temperaturi – una care este prezentă din punctul lor de vedere doar atunci când temperatura din interiorul vasului de cultură este de 37 °C.
De aceea, în bioreactor se utilizează un senzor cu rezistență de platină, cunoscut sub numele de senzor Pt100, pentru a determina temperatura. Acesta are o rezistență de 100 Ω la 0 °C și acoperă destul de bine domeniul de măsurare așteptat, relevant din punct de vedere biologic, atunci când este calibrat în mod corespunzător.
Domeniul tipic de temperatură variază, printre altele, în funcție de organismul cultivat:
| Organism | Domeniul de temperatură | ||||
| Bacterii, Drojdii, Ciuperci | +20 °C până la +60 °C | ||||
| Mamifere, Celule de insecte sau de plante | +25 °C până la +37 °C | ||||
În cazul în care lucrați la temperaturi apropiate sau sub temperatura camerei, veți avea nevoie de un sistem de răcire activ, cum ar fi un răcitor cu recirculare. Pentru majoritatea bioproceselor, temperatura trebuie să rămână constantă pe toată durata cultivării. Cu toate acestea, pentru unele produse, cum ar fi penicilina sau proteinele recombinante (adică proteinele obținute prin bioinginerie cu ajutorul organismelor modificate genetic), schimbarea temperaturii la sfârșitul fazei de creștere activează gene importante pentru formarea produsului și, prin urmare, este benefică. În cazul metodelor de producție care implică culturi celulare, temperatura este uneori scăzută și la sfârșitul bioprocesului (o tehnică cunoscută sub numele de „schimbare de temperatură” în biotehnologie), astfel încât produsul finit să rămână stabil pentru utilizare ulterioară.
Există mai multe moduri de utilizare a unui circuit de încălzire și/sau răcire pentru reglarea temperaturii:
-
-
- Un bloc de încălzire electrică cu spirală de răcire încorporată
- Un tampon de încălzire din silicon înfășurat în jurul vasului de cultură după sterilizare
- Un mantaua dublă în care circulă apă. Temperatura este reglată prin intermediul unui încălzitor electric sau a aburului și a unei supape solenoide pentru admisia apei de răcire
-
Măsurarea și controlul pH-ului
Măsurarea și controlul pH-ului este un aspect foarte important al bioproceselor, deoarece modificările pH-ului pot modifica semnificativ condițiile de creștere – de obicei cu consecințe majore. Mediile de cultură includ de obicei tampoane, adică substanțe care atenuează modificările prea bruște ale pH-ului cauzate de adăugarea unui acid sau a unei baze. Deoarece un acid care se scurge în mediul de cultură poate deteriora multe linii celulare, oamenii de știință îmbogățesc adesea cu grijă amestecul de gaze utilizat în cultura celulară cu CO2, mai degrabă decât să adauge un acid lichid. Gazul se dizolvă apoi în mediul de cultură, permițând dioxidului de carbon să influențeze pH-ul în combinație cu un tampon.
Intervale tipice de pH în funcție de organismul cultivat:
| Organism | pH | ||||
| Bacterii, drojdii, ciuperci | 4.5 – 7,0 | ||||
| Celule de mamifere | 6.7 – 7,4 | ||||
| Celule de insecte | 6,2 – 6,9 | ||||
| Celule de plante | 5.5 | ||||
Pentru măsurarea pH-ului în timpul bioprocesului, fiecare bioreactor este echipat cu un senzor de pH cunoscut sub numele de electrod combinat pentru pH. Bioreactorul poate corecta orice abatere a pH-ului; în acest scop, o soluție acidă și/sau o soluție alcalină este pusă la dispoziție și conectată la vasul de cultură prin intermediul unor tuburi și pompe. Concentrația acidului și a bazei trebuie selectată cu pricepere pentru ca acest lucru să funcționeze – dacă este prea mare, picăturile de acid sau de bază concentrată pot deteriora microorganismele și culturile celulare înainte ca acestea să fie distribuite în bioreactor. Dacă, pe de altă parte, concentrația este prea mică, operatorii vor trebui să adauge mai mult acid sau bază, diluând inutil mediul de cultură.
Aducerea de nutrienți
În timpul unui bioproces, microorganismele consumă, de obicei, o gamă largă de nutrienți. Compoziția de bază a unui mediu nutritiv constă, de obicei, din apă, o sursă de energie utilizabilă pentru organism (de exemplu, glucoză), precum și nutrienții de care acesta are nevoie (carbon, azot și fosfor), săruri și oligoelemente. În funcție de organism, sunt necesari și alți compuși care nu pot fi sintetizați de sine stătător (vitamine, aminoacizi esențiali etc.).
În funcție de strategia bioprocesului, acești nutrienți sunt fie puși toți la dispoziție la începutul unui bioproces (bioproces discontinuu), fie adăugați în timp, cum ar fi într-un proces de tip „fed-batch” sau într-un proces continuu.
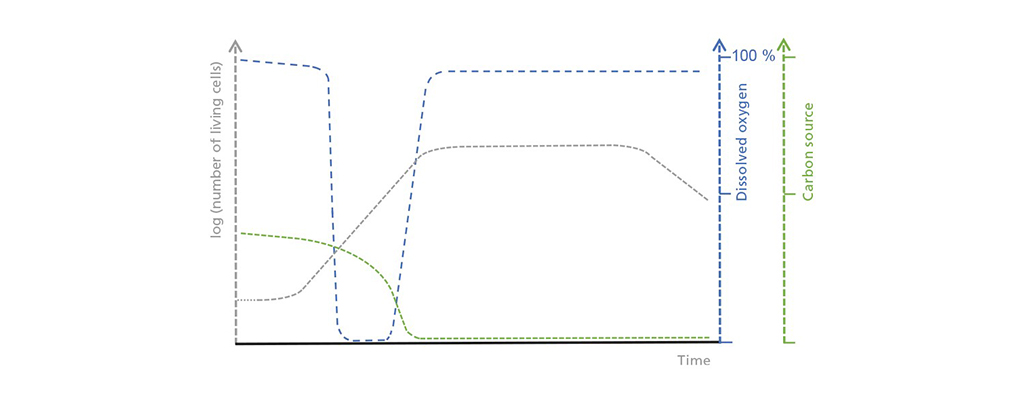
Ilustrație schematică a corelațiilor dintre concentrația de celule vii, oxigenul dizolvat și sursa de carbon limitativă în funcționarea discontinuă. În faza inițială de decalaj, concentrația de celule vii crește doar lent, ceea ce duce la o absorbție moderată, dar constantă a sursei de carbon. Consumul de oxigen crește în timpul fazei de creștere exponențială până când depășește aportul posibil de oxigen. Odată ce sursa de carbon este epuizată, începe faza staționară și este urmată de o fază moartă, în timpul căreia numărul de celule vii scade drastic.
Dacă doriți să aflați mai multe despre diferitele strategii de hrănire, aruncați o privire pe blogul nostru: The Difference Between Batch, Fed-batch and Continuous Process.
Gazarea
În timpul bioprocesului, bioreactorul alimentează mediul de cultură cu un amestec de gaze sterile, cum ar fi aerul. Agitarea constantă nu numai că distribuie substanțele nutritive – ci și reduce dimensiunea bulelor de gaz care apar în vasul de cultură, eliberând astfel eficient oxigenul în soluția nutritivă. Acest lucru este important, deoarece microorganismele și culturile celulare pot absorbi doar oxigenul care a fost dizolvat în soluția nutritivă.
Cerințele de oxigen variază: bacteriile aerobe au nevoie de oxigen, în timp ce altele preferă amestecuri de gaze, cum ar fi gazul de sinteză („syngas”). Cu toate acestea, organismele anaerobe se pot lipsi complet de gazare, hrănindu-se doar cu substanțe anorganice și organice din mediul de cultură, cum ar fi nitrații sau fumaratul.
În comparație cu microorganismele, culturile celulare sunt gazate cu mai mult decât cu aer – conținutul de oxigen al amestecului de gaze poate fi influențat, de asemenea, folosind azot pur și oxigen pur. Compoziția exactă depinde de aplicația culturii celulare. Pentru a menține constantă atmosfera de gaz, bioreactorul are nevoie de sisteme de control precise.
La începutul bioprocesului, de exemplu, o cultură are adesea nevoie de mai puțin oxigen – și, prin urmare, de o alimentare cu gaz mai mică – deoarece creșterea progresează încă lent. Mai târziu, însă, o creștere mai rapidă necesită mult mai mult oxigen. Pe lângă asigurarea unei alimentări constante cu gazul sau amestecul de gaze dorit, bioreactorul furnizează, de asemenea, cantitatea potrivită de gaz la momentul potrivit. Pentru a face acest lucru, bioreactorul are orificii de gaz conectate la aerul presurizat din clădire, la un compresor sau la o butelie de gaz.
Rata de gazare este de obicei măsurată în litri pe minut. Pentru a avea un parametru generic aplicabil la diverse bioreactoare, rata este, de asemenea, frecvent indicată ca rată specifică de gazare, care se referă la multiplii volumului de lucru (volumele vasului pe minut, vvm) și este exprimată ca min-1. O valoare tipică pentru bioprocesele microbiene este de 1 până la 1,5 ori volumul de lucru pe minut. Pentru un bioreactor cu un volum de lucru de 4 L, rata maximă de gazare ar fi, prin urmare, de 4 L * 2 L L L-1 min-1 = 8 L min-1. În culturile celulare, dimpotrivă, rata maximă este adesea de 10% până la 15% din volumul de lucru pe minut, ca o modalitate de a menține bulele de gaz mici și de a preveni astfel formarea de spumă și deteriorarea celulelor prin spargerea bulelor.
Modificarea ratei de gazare nu este însă singura modalitate de a controla eficiența cu care bioreactorul furnizează oxigen și alte gaze mediului de cultură. Cu cât este mai mare suprafața numărului total al tuturor bulelor de gaz din bioreactor – adică cu cât bulele de gaz în sine sunt mai fin distribuite – cu atât mai eficient va fi transferat oxigenul din faza gazoasă în faza lichidă. Acest lucru înseamnă, de exemplu, că mărirea vitezei de agitare poate îmbunătăți oxigenarea microorganismelor, deoarece agitatorul face bulele de gaz și mai mici și, astfel, crește suprafața totală a tuturor bulelor de gaz din bioreactor.
Reglarea precisă a pO2 – și, prin urmare, controlul precis al vitezei de gazare și al compoziției gazului – este foarte importantă, deoarece, în mod normal, pO2 nu ar trebui să fie factorul care să împiedice creșterea culturii. Cu toate acestea, dacă este insuficient controlată, pO2 devine factorul limitativ.
Din moment ce gazul de alimentare a bioreactorului este, de obicei, uscat, umiditatea din bioreactor poate fi colectată în fluxul de ieșire în timpul gazării. La o rată mare de gazare, nu numai că nivelul de umplere ar scădea, dar umiditatea ar bloca și filtrul de evacuare, împiedicând o aerisire corespunzătoare și permițând acumularea de presiune. Pentru a evita acest efect, bioreactoarele sunt echipate cu un răcitor de evacuare eficient, unde umiditatea din evacuare se condensează și se poate scurge înapoi în bioreactor înainte de a ajunge la filtrul de evacuare.
Măsurarea și controlul presiunii
Cu cât presiunea din recipient este mai mare, cu atât mai mult oxigen este dizolvat. Vasele de cultură din sticlă sunt frecvent omologate doar pentru o presiune de până la 0,5 bar, ceea ce nu reprezintă nici măcar jumătate din presiunea unei anvelope de bicicletă umplute moderat. La o presiune de funcționare mai mare, vasele de cultură din sticlă ușor deteriorate pot exploda, ceea ce reprezintă un risc de siguranță. De aceea, ar trebui să asigurați întotdeauna o linie de evacuare liberă și nepresurizată din bioreactor, menținând filtrul de evacuare uscat și înlocuindu-l în mod regulat – în acest proces, veți asigura, desigur, și integritatea vasului de cultură. Spre deosebire de vasele de cultură din sticlă, bioreactoarele din oțel inoxidabil sunt proiectate pentru presiuni mai mari și, chiar și în configurația lor standard, sunt adecvate pentru presiuni de până la 2 bar (o anvelopă de bicicletă bine umplută). În plus, astfel de sisteme sunt adesea echipate cu un mecanism de control al presiunii bazat pe un senzor de presiune în bioreactor și o supapă proporțională în conducta de evacuare. Acestea nu numai că pot măsura presiunea din bioreactor – dar o pot și controla în mod activ.

Prevenirea formării spumei
În afara căzilor de baie și a paharelor de bere, spuma este un efect secundar destul de nepopular, în special în bioreactoare. Spuma se formează la interfața dintre faza lichidă și cea gazoasă din vasul de cultură și își poate găsi rapid drumul până sub placa superioară. În cel mai rău caz, aceasta blochează apoi filtrul de evacuare, care, la rândul său, blochează fluxul de gaz. Prin urmare, majoritatea bioreactoarelor sunt echipate cu un sistem de combatere a formării spumei. Antispumele mecanice din spațiul de cap sunt rezervate bioreactoarelor destul de mari din oțel inoxidabil, în timp ce sistemele de control antispumă bazate pe agenți chimici (cum ar fi PPG, Struktol sau antispumele pe bază de siliciu) pot fi găsite în bioreactoare mai mici.
Un sistem tipic de control antispumă constă într-un senzor instalat la o anumită înălțime în vasul de cultură. Dacă înălțimea spumei atinge senzorul, un agent antispumant este pompat dintr-un rezervor în vasul de cultură. Acești agenți antispumă sunt activi la interfața lichid-gaz și sporesc tendința de colapsare a bulelor de spumă. În cazurile deosebit de încăpățânate în care spuma nu se dizolvă imediat, se repetă procedura după un timp prestabilit (o strategie de „întârziere a împușcării &”). Se recomandă prudență atunci când se utilizează un agent antispumant – dacă distribuiți chiar și puțin mai mult decât este necesar, acesta se poate așeza ca o a doua piele pe suprafața lichidului, ceea ce împiedică schimbul de gaze. Agenții antispumanți contracarează, de asemenea, transferul eficient de oxigen, deoarece modificarea tensiunii superficiale favorizează colapsul bulelor de gaz din bioreactor, reducând astfel suprafața disponibilă pentru schimbul de gaze. Selectarea agentului adecvat depinde, de asemenea, de bioprocesul în cauză, deoarece bacteriile și celulele reacționează diferit la anumite substanțe chimice.
Bonus: Beneficiile utilizării unui software SCADA
În zilele noastre, rezultatele generate într-un bioreactor ar trebui să fie colectate și evaluate cât mai centralizat posibil, deoarece aceasta este singura modalitate de a implementa în mod eficient algoritmi moderni, big data, pentru a genera mai multe informații și pentru a înțelege mai bine modul în care funcționează un proces. Aceasta este sarcina software-ului SCADA. În prima etapă, toate datele de la bioreactor pot fi citite – fără nicio contribuție majoră din partea utilizatorului – și stocate la nivel central pentru a le evalua singure sau pentru a le compara cu alte date de lot. Acest lucru declanșează rapid idei pentru noi experimente și, eventual, chiar strategii complexe de loturi. Un software SCADA profesional vă permite să le planificați cu ușurință și apoi să controlați bioreactorul, care, în mod ideal, va fi un proces complet automatizat. În plus, software-ul SCADA integrează, de asemenea, mai multe componente din mediul bioreactorului. Printre acestea se numără instrumente pentru optimizarea procesului folosind tehnica design-of-experiment (DoE) sau senzori software puternici, care pot fi utilizați simultan pentru a calcula informații suplimentare direct din parametrii procesului discontinuu și chiar pentru a regla acești parametri. De exemplu, coeficientul respirator (RQ) poate fi utilizat pentru a obține o estimare a activității metabolice prin intermediul raportului dintre dioxidul de carbon excretat și oxigenul absorbit.
Există atât de multe posibilități – în special atunci când bioreactorul și software-ul SCADA sunt perfect adaptate – încât nu am putea să le descriem pe toate. Dacă sunteți interesat să aflați mai multe despre tot ceea ce are de oferit un software SCADA modern, aruncați o privire la software-ul eve® bioprocess platform software

.