Introducere
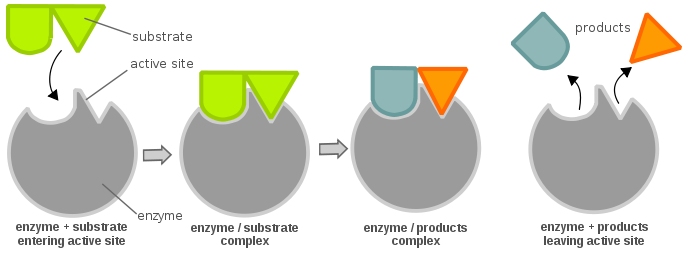
Sitemele active ale unei enzime sunt de obicei compuse din reziduuri de aminoacizi; în funcție de reziduurile de aminoacizi prezente, specificitatea substratului poate varia foarte mult. În funcție de nivelul pH-ului, proprietățile fizice (în principal sarcina electrică) ale unei enzime se pot modifica. O schimbare a sarcinii electrice poate modifica interacțiunea dintre reziduurile de aminoacizi din situsul activ și substratul care intră. Acestea fiind spuse, substratul se poate lega de situsul activ prin intermediul legăturii de hidrogen sau al forțelor van der Waals. Odată ce substratul se leagă de situsul activ, acesta formează un complex enzimă-substrat care este apoi implicat în alte reacții chimice.
Pentru ca o enzimă să fie activă și să fie favorabilă din punct de vedere energetic pentru a permite ca o reacție chimică să avanseze, un substrat trebuie să se lege de „situsul activ” al enzimei. Un situs activ poate fi considerat ca o încuietoare, iar substratul ca o cheie; acest lucru este cunoscut sub numele de modelul de încuietoare și cheie. O cheie (substratul) trebuie să fie introdusă și rotită (reacție chimică), apoi lacătul (enzima) se deschide (producerea de produse). Rețineți că o enzimă poate avea mai mult de un situs activ. O altă teorie privind relația situs activ-substrat este teoria adaptării induse, care este destul de opusă teoriei „lacătului și cheii” (în care situsul activ este aparent inflexibil). În teoria ajustării induse, situsul activ al enzimei este foarte flexibil și își schimbă conformația doar atunci când substratul se leagă de el.
Enzimele acționează ca un catalizator prin scăderea energiei libere Gibbs de activare a complexului enzimă-substrat. Mai jos sunt prezentate două figuri care arată o reacție enzimatică de bază cu și fără catalizator:
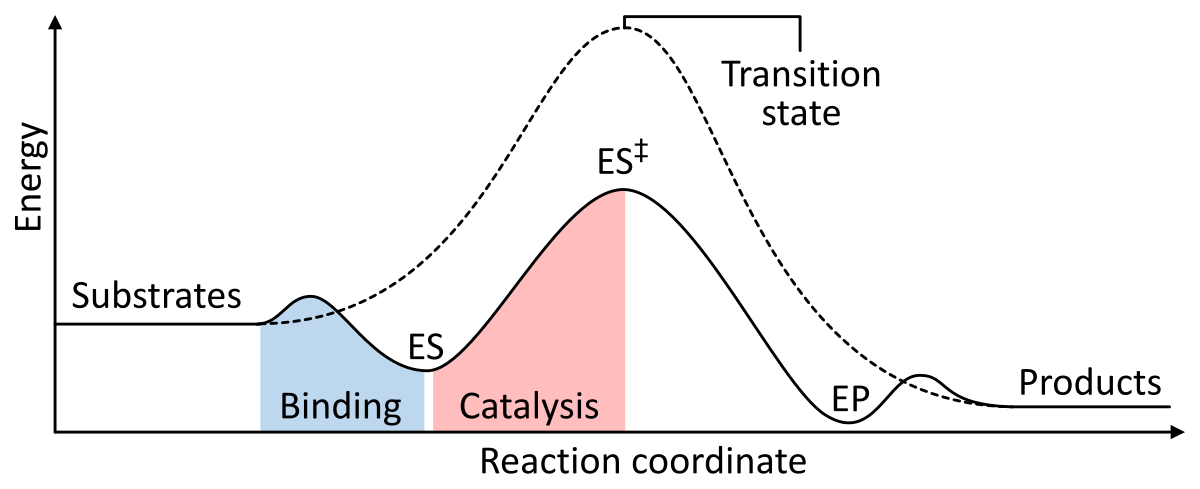
Figura 1: Energiile etapelor unei reacții chimice. Necatalizate (linie punctată), substraturile au nevoie de multă energie de activare pentru a ajunge într-o stare de tranziție, care apoi se descompune în produse cu energie mai mică. Atunci când este catalizată de o enzimă (linie continuă), enzima leagă substraturile (ES), apoi stabilizează starea de tranziție (ES‡) pentru a reduce energia de activare necesară pentru a produce produși (EP) care sunt în cele din urmă eliberați. din Wikipedia.
Eficiența enzimei poate fi determinată după cum urmează: considerăm o reacție enzimatică simplă:
Biochimistul german Leonor Michaelis și biochimistul canadian Maud Menten au derivat o ecuație care descrie acest sistem, cunoscută mai târziu sub numele de „Ecuația Michaelis-Menten”, prezentată mai jos:
\}{K_M + } \tag{1}\}]
Această ecuație dă rata reacției la o anumită concentrație de substrat, presupunând un Vmax cunoscut, care este rata maximă la care reacția poate continua, și KM, constanta Michaelis. Cu toate acestea, într-o aplicație practică a lui Michaelis-Menten, V0 este adesea măsurat, iar Vmax este observat ca o saturație sau un platou într-un grafic de date. Deoarece concentrația de substrat este cunoscută, KM este de obicei valoarea calculată de interes.
Pentru \(K_M\), se presupune că \(V_0= \dfrac{V_{max}}{2}\):
\}}{K_M + } \tag{2}\]
\) \dfrac{V_{max}}{2} = V_{max} \tag{3}\]
\ = \dfrac{V_{max}}{\dfrac{V_{max}}{2}} \tag{4} \\]
\ = 2 \tag{5}\]
\ \tag{6}\]
Constanta Michaelis poate fi considerată ca fiind viteza cu care substratul se desprinde de enzimă, ceea ce poate avea loc fie în cazul în care complexul substrat-enzimă devine produs, fie substratul se desprinde de enzimă. KM poate fi prezentat sub forma unei ecuații.
\
În care k-1 este constanta de viteză la care substratul se desprinde de enzimă, ceea ce duce la disocierea complexului enzimă-substrat, k2 este constanta de viteză în care complexul substrat-enzimă dispare și se transformă în produs, iar K1 este constanta de viteză pentru formarea complexului substrat-enzimă. Prin urmare, KM poate fi privită ca rata de dispariție a complexului substrat-enzimă împărțită la rata de formare a complexului substrat-enzimă, care este nivelul la care jumătate din substrat este legat de enzimă. KM este un indicator util pentru prezența unui inhibitor, deoarece putem căuta modificări ale KM și le putem compara cu martorul nostru (sisteme biologice despre care știm că nu au niciun inhibitor). KM este o variabilă dependentă, iar valoarea sa se poate modifica din mai multe motive, inclusiv nivelul pH-ului sistemului, temperatura sau orice altă condiție care ar putea afecta o reacție chimică. O KM mică indică faptul că substratul are o afinitate mare pentru enzimă.
Ecuația Michaelis-Menten este cea mai utilă în măsurarea eficienței enzimei dacă v0 este reprezentată grafic cu , după cum urmează:
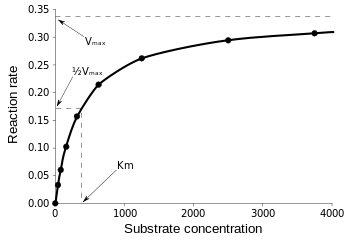
Figura 3: Diagrama vitezei de reacție și a constantei Michaelis-Menten. din Wikipedia.
Vmax este viteza maximă la care reacția se poate desfășura, indiferent de , ceea ce înseamnă că, chiar dacă adăugați mai mult substrat, reacția nu poate merge mai repede. Acest lucru se datorează faptului că la Vmax toate situsurile active de pe enzimă sunt ocupate. După toate explicațiile privind diferitele forme de ecuații cinetice ale enzimelor, ajungem la concluzia noastră privind eficiența catalitică. Referindu-ne din nou la figura 3, avem:
\_o}{\dfrac{k_{-1} + k_2}{k_1} + }\right) \tag{8}\}]
Rețineți că \(k_2\) descrie o reacție ireversibilă, spre deosebire de o expresie de echilibru, în comparație cu k-1 și k1. k2 aici este cunoscut și sub numele de kcat, eficiența catalitică a enzimei. Din discuția anterioară, v0 este viteza de reacție măsurată, care reprezintă formarea produsului în timp, astfel încât se poate concluziona că o ecuație ar arăta astfel:
\}{dt} = k_2_0 \tag{9}\]
Unde 0 este concentrația totală a enzimei.
Se știe, de asemenea, că VMax se observă atunci când tot complexul enzimă-substrat dispare și se transformă în produși, deci putem face următoarea presupunere:
\_0 \tag{10} \]
și după rearanjare, avem această ecuație:
\_0} \tag{11}\]
Aceasta este ecuația pentru calcularea eficienței catalitice, care va fi folosită după ce vom obține date din experimente și după ce vom folosi ecuația Michaelis-Menten. Cu un kcat mai mare , enzima este eficientă deoarece este nevoie de mai puțină enzimă.
.