Apoptoza

Apoptoza, sau moartea celulară programată, este un mod foarte bine reglementat de eliminare selectivă a celulelor de către un organism. Acest proces joacă un rol important în embriogeneză, în menținerea dimensiunii unui organism și în eliminarea celulelor deteriorate sau aberante. Importanța apoptozei în sănătatea umană este subliniată de numeroasele boli care rezultă din apoptoza aberantă. Dereglarea apoptozei a fost asociată cu diverse tipuri de cancer, tulburări neurologice și cardiovasculare și boli autoimune.
În mod obișnuit, facem distincția între două tipuri diferite de apoptoză: calea intrinsecă, mediată de mitocondrii ca răspuns la stimuli interni, cum ar fi deteriorarea ADN-ului, și calea extrinsecă, mediată de receptorii extracelulari ai morții (de exemplu, legarea FasL la receptorul FasLG) (Figura 1) (Figura 1). Ambele căi se bazează pe proteaze numite caspaze inițiatoare care activează o cascadă de caspaze efectoare, ceea ce duce la apoptoză. Interconectarea între căile intrinsecă și extrinsecă este mediată prin intermediul agonistului de moarte cu domeniul de interacțiune BH-3 (Bid).
Calea intrinsecă (figura 1) este inițiată de proteinele de homologie Bcl-2. În calea clasică a apoptozei, proteinele Bcl-2 Bax și Bak sunt activate ca răspuns la stimuli interni, cum ar fi deteriorarea ADN-ului sau stresul oxidativ. Aceste două proteine interacționează ulterior cu Bid și sunt inserate în membrana mitocondrială externă. Acest lucru are ca rezultat ceea ce este considerat punctul de neîntoarcere în apoptoză – permeabilizarea membranei exterioare mitocondriale (MOMP). MOMP duce la eliberarea în citoplasmă a factorilor pro-apoptotici, cum ar fi citocromul c. Citocromul c din citoplasmă se leagă de APAF-1 și dATP pentru a recruta pro-caspaza- 9, formând apoptosomul. Formarea apptosomului declanșează scindarea pro-caspazei-9 în forma sa proteazică activă, caspaza-9. Caspaza-9 este o caspază inițiatoare care apoi activează caspazele efectoare din aval, cum ar fi caspaza-3 și -7, prin proteoliză, declanșând cascada caspazelor care duce la apoptoză.
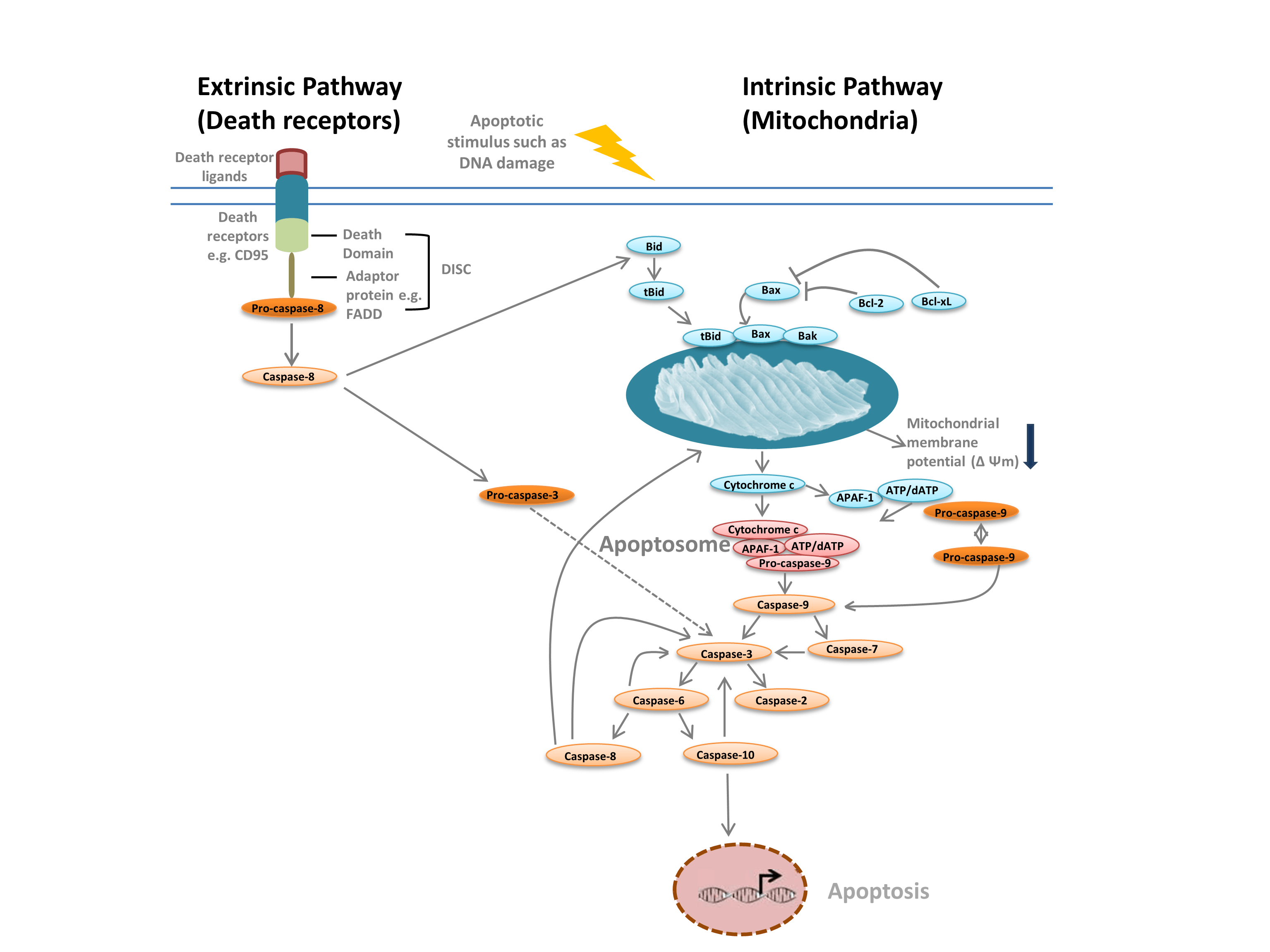
Fig. 1. Căile apoptozei.
Calea extrinsecă este declanșată de legarea liganzilor la receptorii de moarte. La legarea ligandului, receptorii morții se oligomerizează și recrutează proteine adaptoare precum FADD. Acest lucru permite recrutarea pro-caspazei-8, forma inactivă a inițiatorului caspazei-8, și formarea complexului de semnalizare care induce moartea (DISC). Pro-caspaza-8 se oligomerizează și este scindată în forma sa activă, caspaza-8, care, la rândul său, scindează și activează caspaza-3 efectoare. Caspaza-3, la rândul său, activează proteolitice diferite alte caspaze, ducând astfel la apoptoză. În unele cazuri, activarea căii extrinseci poate duce, de asemenea, la activarea căii intrinseci, mediată prin Bid.
Apoptoza este distinctă de moartea celulară neprogramată/necroza. Necroza este un proces nereglementat inițiat de leziuni externe și este diferită de apoptoză în mai multe moduri esențiale (tabelul 1). Cu toate acestea, pe măsură ce am învățat mai multe despre apoptoză și necroză și am identificat noi mecanisme de moarte celulară, cum ar fi necroptoza, linia de demarcație dintre apoptoză și necroză a devenit mai neclară. Cu toate acestea, trăsăturile distinctive prezentate în tabelul 1 sunt încă linii directoare utile.
Tabel 1. Caracteristici ale apoptozei și necrozei.
| Apoptoza | Necroza |
| Celele se micșorează | Celele se umflă |
| Fagocitele/macrofagele înghit celulele | Celula se eliberează resturi de celule |
| Procesul este neinflamator | Procesul este inflamator |
Este util să împărțim acest proces în etape atunci când analizăm apoptoza:
- Apoptoza este inițiată și cascadele de semnalizare sunt activate
- Celele se micșorează și se rotunjesc, mediată de caspaze
- Organitele își schimbă forma și membranele încep să sângereze
- Începe condensarea nucleară
- Se poate observa fragmentarea ADN-ului
- Se formează corpuri apoptotice
- Corpurile apoptotice sunt fagocitate
Aceste etape apoptotice, împreună cu mediatorii cunoscuți ai apoptozei, pot fi folosite ca identificatori ai apoptozei. Atunci când alegeți un test de apoptoză, gândiți-vă la întrebarea pe care doriți să o puneți – testele de activitate a caspazelor sunt indicatori excelenți ai inițierii apoptozei, în timp ce testele de fragmentare a ADN-ului pot fi utilizate pentru a identifica celulele aflate în stadiile târzii ale apoptozei, când acestea sunt ireversibil angajate în moarte celulară programată.
Când se efectuează teste de apoptoză, este întotdeauna înțelept să se includă coloranți de viabilitate, cum ar fi iodura de propidiu (PI), pentru a diferenția celulele apoptotice de celulele necrotice și pentru a inspecta vizual celulele sau țesuturile la microscop pentru indicatorii morfologici cheie ai apoptozei.
Evaluarea apoptozei
1. Modificări morfologice
Imagistica în timp real a celulelor vii poate fi utilizată pentru a urmări apoptoza în timp real și este deosebit de utilă pentru identificarea sângerărilor membranare. În cazul țesuturilor, microscopia electronică de transmisie poate fi utilizată pentru a identifica multe dintre modificările structurale care însoțesc etapele apoptozei. De asemenea, țesuturile pot fi colorate cu hematoxilină și eozină pentru a vizualiza macrofagele care au înghițit celulele apoptotice. Portocaliul de acridină (AO) este un alt colorant utilizat în mod obișnuit pentru a vizualiza celulele apoptotice. Acest colorant popular pentru viabilitate și proliferare poate fi utilizat pentru a evalua apoptoza, deoarece spectrul său de emisie se transformă în portocaliu atunci când se află în mediul acid al lizozomului; acest lucru face ca acest colorant să fie util pentru identificarea celulelor apoptotice înghițite. Coloranții care se leagă de ADN, cum ar fi DAPI, Hoechst, iodura de propidiu (PI) și 7-AAD, pot fi utilizați pentru a vizualiza sângerarea nucleară, în timp ce micșorarea celulelor poate fi detectată fie într-un citometru în flux ca o reducere a dispersiei înainte (FSC), fie vizual, utilizând microscopia optică.
2. Modificări ale potențialului membranar mitocondrial
Modificările potențialului membranar indică faptul că o celulă a trecut punctul de neîntoarcere și este acum angajată în apoptoză. O prăbușire a potențialului de membrană mitocondrială poate fi detectată prin citometrie de flux sau imunofluorescență folosind coloranți potențiometrici.
Esterul etilic al tetrametilrhodaminei (TMRE), esterul metilic al tetrametilrhodaminei (TMRM) și JC-1 sunt coloranți potențiometrici utilizați în mod obișnuit. TMRE și TMRM se agregă în mitocondriile celulelor neapoptotice și devin fluorescente în portocaliu sau roșu aprins. În celulele apoptotice cu potențial de membrană mitocondrială redus, acești coloranți se găsesc în citoplasmă în forma lor monomerică și prezintă o fluorescență roșie redusă. Coloranții pot fi utilizați în combinație cu testele cu inhibitori de caspază marcați cu fluorofori (FLICA) (a se vedea secțiunea următoare) pentru a identifica celulele apoptotice pe baza a două caracteristici: reducerea potențialului membranei mitocondriale și activarea caspazei (figura 2).
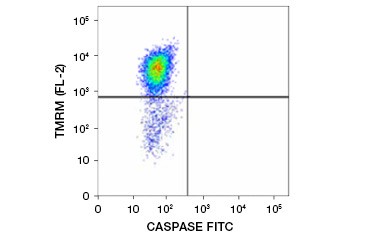
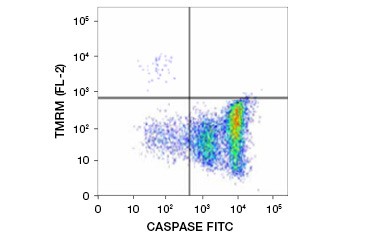
Fig. 2. Detectarea reducerii potențialului membranar mitocondrial și a activării caspazelor prin citometrie de flux. Pierderea simultană a fluorescenței portocalii de la TMRM și creșterea simultană a fluorescenței verzi, care arată activarea caspazei măsurată cu ajutorul kitului FAM-FLICA Polycaspase, arată celulele apoptotice (cadranul din dreapta jos).
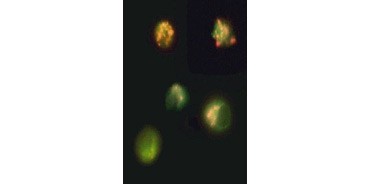
Fig. 3. Descompunerea potențialului membranar mitocondrial vizualizat cu ajutorul JC-1. Celulele Jurkat au fost colorate cu MitoPT JC-1. Celulele neapoptotice (sus) prezintă mitocondrii colorate în roșu, în timp ce celulele aflate în diferite stadii de apoptoză prezintă fluorescență citoplasmatică verde.
JC-1 se agregă, de asemenea, în mitocondriile celulelor neapoptotice și se găsește difuzat în întreaga celulă în celulele apoptotice. Spre deosebire de TMRE și TMRM , care prezintă o fluorescență redusă, JC-1 își schimbă culoarea, de la roșu la verde. Acest lucru permite o distincție ușoară între celulele neapoptotice cu fluorescență roșie și celulele apoptotice cu fluorescență verde (figura 3). Aceste teste pot fi citite cu ajutorul microscopiei cu fluorescență, al unui citometru de flux sau al unui cititor de microplăci echipat corespunzător.
3. Activarea caspazei
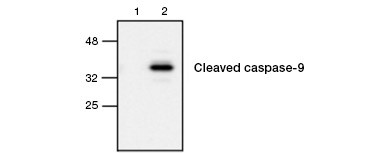
Fig. 4. Caspaza-9 activă este detectată prin Western blot. Analiza Western blot a celulelor netratate (banda 1) și tratate cu etopozidă (banda 2) probate cu anticorpul Rabbit anti-caspase-9 (activă). Caspaza-9 activă, scindată, este detectată numai la inducerea apoptozei cu etopozid.
Activarea caspazei este o caracteristică definitorie a apoptozei. Caspazele apoptotice cheie frecvent analizate sunt caspazele inițiatoare 3, 6 și 7 și caspazele efectoare 2, 8, 9 și 10. Activarea caspazelor poate fi identificată fie prin reducerea dimensiunii pro-caspazelor pe măsură ce acestea sunt scindate, fie prin utilizarea anticorpilor care interacționează numai cu forma activată scindată (figura 4). Ambele abordări pot fi citite prin Western blotting, în timp ce ultima abordare poate fi adaptată, de asemenea, pentru teste fluorescente și imunohistochimice prin alegerea anticorpilor conjugați cu fluorofori sau biotină. Aceste teste sunt compatibile atât cu celulele fixate, cât și cu cele nefixate.
Un lucru care trebuie reținut este faptul că caspazele inițiatoare sunt mult în amonte în calea de semnalizare a apoptozei și că activarea lor nu duce întotdeauna la apoptoză. Prin urmare, este înțelept să se împerecheze testele pentru caspazele inițiatoare cu cele pentru caspazele efectoare sau, și mai bine, cu sonde pentru evenimentele din aval de punctul de neîntoarcere, cum ar fi MOMP.
O altă clasă de teste de activare a caspazelor este reprezentată de substraturile caspazelor marcate cu fluorofori, cum ar fi testele FLICA. Testele FLICA se leagă covalent și ireversibil de caspazele activate; orice inhibitor nelegat difuzează în afara celulelor și/sau poate fi eliminat prin spălări. Acești inhibitori sunt disponibili fuzionați cu coloranți roșii sau verzi. Intensitatea fluorescenței poate fi utilizată ca o măsură cantitativă a activității caspazelor – celulele apoptotice cu activitate caspazică ridicată vor prezenta mai multă fluorescență decât cele cu activitate caspazică scăzută. Testele FLICA sunt compatibile cu celule vii, secțiuni de țesut și secțiuni subțiri congelate, dar nu cu celule fixate sau țesuturi incluse în parafină și pot fi citite prin cuantificarea intensității fluorescenței cu ajutorul microscopiei de fluorescență, citometriei în flux (figura 2) sau al unui cititor de microplăci.
Pentru a trage concluzii solide din testele de activitate a caspazelor este întotdeauna înțelept să se aleagă mai mult de o țintă.
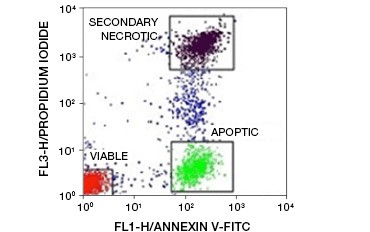
Fig. 5. Conjugatele Annexin-V pot fi utilizate pentru a distinge celulele apoptotice de cele necrotice și viabile. Dot-plot care arată celulele Ramos colorate cu anexină V:FITC față de iodura de propidiu. Pot fi observate trei populații distincte.
4. Externalizarea fosfatidilserinei
O caracteristică cheie a apoptozei care este detectabilă chiar și în stadii incipiente este externalizarea fosfatidilserinei (PS), un fosfolipid care se găsește exclusiv în membrana internă a celulelor sănătoase. Annexin-V se leagă de fosfatidilserină, iar conjugatele de annexină-V pot fi astfel utilizate pentru a evalua apoptoza. Aceste teste se efectuează în mod obișnuit prin citometrie în flux, utilizând annexina-V marcată cu fluorocarburi. Prin combinarea acestui colorant cu orice colorant de viabilitate, cum ar fi PI, se pot distinge celulele apoptotice de cele necrotice. În aceste experimente de citometrie în flux cu două culori, se pot distinge cu ușurință trei populații: celule viabile anexin-V/PI dublu negative, celule apoptotice anexin-V pozitive/PI negative și celule necrotice secundare anexin-V/PI dublu pozitive
(figura 5).
Externalizarea fosfatidilserinei este un proces dinamic, reversibil, până când o celulă este angajată în apoptoză după MOMP. Cu ajutorul conjugatelor de anexină-V este imposibil să se distingă etapele timpurii, reversibile ale apoptozei de etapele ulterioare ale apoptozei, atunci când o celulă este angajată în moarte. Sondele pSIVA (Polarity-sensitive indicator of viability and apoptosis) sunt biosenzori care se leagă în mod reversibil de PS și, astfel, se activează și se dezactivează pe măsură ce PS trece de la membrana externă la cea internă (figura 6). Un alt avantaj al testului pSIVA este că, spre deosebire de conjugatele de anexină-V, sondele pSIVA pot fi adăugate direct în celulele dumneavoastră fără etape de spălare. Acest test poate fi citit cu ajutorul imunocitochimiei și al microscopiei de imunofluorescență, inclusiv cu ajutorul imagisticii celulelor vii, ceea ce permite compararea cu ușurință a diferențelor dintre ratele de apoptoză ca răspuns la diferite tratamente experimentale în timp real. Deoarece apoptoza este monitorizată în timp real, acest test nu este compatibil cu celulele fixate.
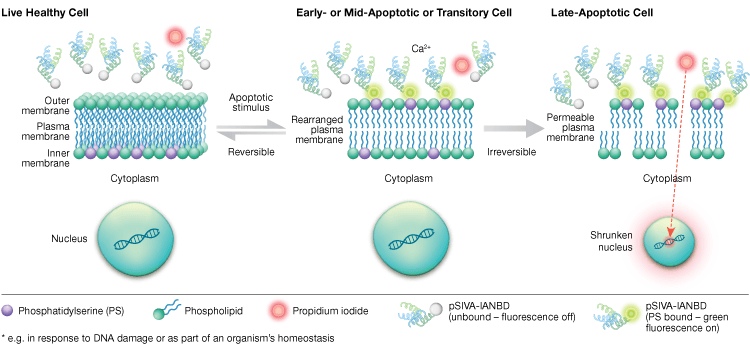
Fig. 6. Testul pSIVA poate distinge celulele vii, apoptotice timpurii și apoptotice târzii prin monitorizarea externalizării și internalizării fosfatidilserinei în timp real.
5. Fragmentarea ADN-ului
Fragmentarea ADN-ului este una dintre etapele ulterioare ale apoptozei și este în mod obișnuit analizată prin detectarea scării ADN folosind electroforeza pe bază de agaroză sau metoda TUNEL (Terminal deoxynucleotidyl transferase dUTP nick end labeling).
O caracteristică definitorie a apoptozei este fragmentarea ADN-ului în fragmente de ~180 bp de către endonucleaze activate de caspază. ADN-ul genomic extras, rulat pe un gel de agaroză, va prezenta astfel o scriere caracteristică a ADN-ului care nu se observă la celulele care mor prin alte mecanisme, cum ar fi necroza.
Metoda TUNEL este o altă modalitate de detectare a creării oligonucleozomilor de către endonucleaza activată de caspază. Clivarea ADN-ului are ca rezultat apariția grupărilor hidroxil 3′ (grupări 3′-OH). Testul TUNEL utilizează enzima deoxinucleotidil transferază terminală (TdT) pentru a adăuga BrdU la aceste grupe 3′-OH. BrdU încorporat poate fi apoi detectat cu ajutorul anticorpilor anti-BrdU marcați cu biotină sau cu un fluorofor. Acest test este compatibil cu citometria de flux, precum și cu imunohistochimia și imunofluorescența și poate fi transformat într-o citire radiomarcată prin utilizarea de -TdR în loc de BrdU. Celulele trebuie să fie fixate după încorporarea BrdU înainte de colorare.
Fragmentarea ADN-ului poate fi, de asemenea, măsurată prin citometrie în flux folosind testul sub-G1. Fragmentele mici de ADN, ~180 bp, generate în timpul apoptozei se scurg din celule, scăzând conținutul total de ADN al celulelor apoptotice. Prin colorarea ADN-ului cu PI, celulele apoptotice hipodiploide pot fi numărate în vârful sub-G1 al histogramei PI.
6. Panouri de markeri de apoptoză multiplex
În cele din urmă, mulți vânzători vând panouri pentru analiza imunoenzimatică multiplexă a populațiilor de celule. Aceste panouri pot testa mai mulți markeri de apoptoză în același timp.
Indiferent de metoda utilizată pentru a detecta apoptoza, trebuie incluse controale adecvate, deoarece condițiile experimentale și tipul de celule pot modifica performanța unor teste. Includeți întotdeauna controale pozitive și negative. Includeți controale tratate cu vehicul pentru a ține cont de efectele solvenților, controale specifice aplicației pentru a controla factori precum autofluorescența în experimentele de imunofluorescență și controale de încărcare pentru Western blotting.
Tabelul 2. Rezumat al testelor pentru detectarea semnelor distinctive ale apoptozei.
| Stadiul de apoptoză | Reactivi pentru a permite detecția | Aplicații |
| PS flipping | conjugate de anexină-V, sonde pSIVA | Citometrie de flux, microscopie |
| Cascadele de semnalizare inițiate | FLICA, anticorpi anti caspază | Citometrie în flux, microscopie, Western blot |
| MOMP | TMRM, TMRE, JC-1 | Citometrie în flux, microscopie, cititor de microplăci |
| Retragerea celulelor | Citometrie în flux, microscopie | |
| Sângerare membranară | hematoxilină + eozină | Microscopie |
| Condensare nucleară | DAPI, Hoechst, PI, 7-AAD | Microscopie |
| Fragmentarea ADN-ului | TUNEL, Sub-G1 assay, DNA laddering | Gel de agaroză, citometrie în flux, microscopie |
| Fagocitoza corpilor apoptotici | Acridină portocalie, hematoxilină + eozină | Citometrie în flux, microscopie luminoasă și electronică |
.