Caperone moleculare
Caperonele moleculare cuprind o gamă largă de proteine care joacă roluri cheie în homeostazia celulară și sunt responsabile pentru asistarea în plierea proteinelor, asamblarea proteinelor multimerice, translocarea proteinelor în interiorul și între celule, degradarea proteinelor nedorite sau prost pliate în timpul proceselor celulare normale și stabilizarea proteinelor prin prevenirea agregării și asistarea la replierea în condiții de stres (Lindquist, 1986; Lindquist și Craig, 1988).
Proteinele despre care s-a raportat că au activitate de chaperon au fost descoperite inițial ca fiind cele supraexprimate în timpul șocului termic și, prin urmare, au fost denumite proteine de șoc termic (Hsp). În afară de șocul termic, alte condiții de stres, cum ar fi condițiile de limitare a carbonului, azotului sau fosfaților, au fost, de asemenea, cunoscute pentru a induce chaperone moleculare. Aceste proteine sunt clasificate în funcție de greutatea lor moleculară în cinci familii majore: (a) familia Hsp100, (b) familia Hsp90, (c) familia Hsp70, (d) familia Hsp60 și (e) familia proteinelor mici de șoc termic (sHsp) (Bohen et al., 1995; Schirmer et al., 1996; Bukau și Horwich, 1998). Chaperonii sunt, de asemenea, clasificați în funcție de modul lor de acțiune în: (a) Foldaze, chaperone care ajută la replierea proteinelor desfășurate prin utilizarea ATP, de exemplu, Hsp70 și Hsp60, (b) Holdaze, chaperone care leagă intermediarii de pliere și previn agregarea, de exemplu, sHsp și Hsp40, și (c) Dezagregări, chaperone care dezagregă în mod activ agregatele proteice dăunătoare, ceea ce ar putea duce la fragmente mici ale acestora, de exemplu, membrii superfamiliei AAA + ATPază și Hsp100. Acest tip de clasificare este valabil cu câteva excepții (Richter et al., 2010; Kim et al., 2013). O mare parte din înțelegerea noastră cu privire la mecanismele de pliere a proteinelor asistate de chaperoni a fost derivată din lucrările asupra familiilor de chaperoni Hsp60 și Hsp70. Această trecere în revistă se concentrează asupra clasei Hsp60 de chaperoni moleculari, evidențiind Hsp60 cu structură și funcție atipică.
Familia Hsp60/Chaperonine
Chaperoninele de 60 kDa formează inele oligomerice mari și sunt denumite și chaperonine. Chaperoninele pot fi subclasificate în continuare în două grupe pe baza cerinței de co-chaperonine și a localizării lor celulare. Chaperoninele de tip I se găsesc în citoplasma procariotelor și în mitocondriile și cloroplastul eucariotelor. Acestea au nevoie de asistența cochaperoninei, și anume Hsp10, care acționează ca un capac pe inel. Chaperonina de tip I, bine studiată, este cunoscută sub numele de sistemul GroEL-GroES din Escherichia coli. Omologii săi sunt Cpn60/Cpn20 în cloroplaste și mtHsp60/mtHsp10 în mitocondrie (Cheng et al., 1989; Hayer-Hartl et al., 1995; Dickson et al., 2000). Chaperoninele de tip II se găsesc în citoplasma eucariotelor și în microorganismele arhaebacteriene. Acestea au un capac încorporat și, prin urmare, nu au nevoie de cochaperonine pentru funcția lor (Ranson et al., 1998). Printre exemplele de chaperonine de tip II se numără mașinăria eucariotă TriC/CCT (complexul inelar TCP-1/complexul TCP-1 care conține chaperonina), care este alcătuit din 8 subunități și termosomul din archaebacterii. Spre deosebire de chaperoninele de tip I, capturarea independentă de substrat a chaperoninelor de tip II necesită asistența prefoldinei și a omologilor Hsp70 (Iizuka et al., 2004; Cuéllar et al., 2008). Recent, a fost raportat un al treilea grup, cunoscut sub numele de chaperonine de tip III, care sunt similare din punct de vedere structural cu chaperoninele de tip II, dar distincte din punct de vedere mecanic și filogenetic atât de chaperoninele de tip I, cât și de cele de tip II, de exemplu, chaperonina Carboxydothermus hydrogenoformans (Ch-CPN) (Techtmann și Robb, 2010; An et al., 2017; Figura 1). Chaperoninele de tip I, II și III sunt, de asemenea, cunoscute sub numele de chaperonine de grup I, II și III.
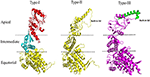
Figura 1. Caracteristici structurale ale chaperoninelor de tip I, tip II și tip III. Figura 2. Analiza comparativă a structurii chaperoninelor de tip I, tip II și tip III. Structurile au fost descărcate de la RCSB cu codurile PDB: 1AON, 3RUW și, respectiv, 5X9U. Chaperonina de tip I este delimitată în domeniile apical, intermediar și ecuatorial, ale căror regiuni analoge sunt prezentate în chaperoninele de tip II și III cu ajutorul liniilor punctate. Chaperonina de tip II are un capac încorporat caracteristic în structură, care joacă rolul de cochaperonină GroES al chaperoninei de tip I. Chaperoninele de tip III sunt similare din punct de vedere structural cu chaperoninele de tip II în ceea ce privește capacul încorporat. Cu toate acestea, secvența, structura și funcția capacului sunt distincte în cazul chaperoninelor de tip II și de tip III (An et al., 2017). Programul PyMOL (PyMOL Molecular Graphics System, versiunea 1.3) a fost utilizat pentru a genera această figură.
Structura-funcția chaperoninelor de tip I: citosol procariotic
E. coli GroEL-GroES
Studii structurale și funcționale asupra E. coli GroEL-GroES
Studii structurale și funcționale asupra E. coli GroEL-GroES
. coli GroEL au arătat că acesta formează o structură tetradecameră compusă din două inele heptamerice suprapuse formând o cavitate, care își schimbă caracterul din predominant hidrofob în hidrofil la legarea GroES. Plierea proteinei substrat are loc în această cavitate cu ajutorul cochaperoninei GroES, care este o structură heptamerică de tip capac (Mande et al., 1996). Fiecare monomer GroES are o dimensiune de 10 kDa. Monomerul GroEL este delimitat în trei domenii, și anume domeniul apical, intermediar și ecuatorial. Fiecare monomer are o dimensiune de ~57 kDa.
Există două modele propuse pentru plierea proteinei substrat mediată de GroEL-GroES. Modelul asimetric/sevențial, care este acceptat pe scară largă. În acest model, GroEL și GroES sunt prezente în mod stoichiometric în raport 2:1 (raport de subunități 14:7). În celălalt model, cunoscut sub numele de model simetric/simultan, care se bazează pe complexul GroEL-GroES observat recent, ambele inele ale lui GroEL sunt acoperite de cochaperonina GroES în raportul stoichiometric de 1:1, adică (GroEL-GroES)2, și raportul de subunități de 14:14 (Sameshima et al., 2008; Ye și Lorimer, 2013; Fei et al., 2014). Complexul simetric (GroEL-GroES)2 a fost observat atât în prezența, cât și în absența proteinei substrat, sugerând o stare intermediară tranzitorie în ciclul reacției de pliere.
Structura-funcția chaperoninelor de tip I: Organite endosimbiotice
Chiperonine cloroplastice și mitocondriale
Chiperoninele cloroplastice sunt denumite de obicei Cpn60 (omologii GroEL) și Cpn10 (omologii GroES). Chaperoninele Cpn60 sunt alcătuite din mai multe subunități care sunt divergente în două tipuri înrudite, dar distincte, α și β (Dickson et al., 2000; Hill și Hemmingsen, 2001). Spre deosebire de chaperoninele bacteriene, care conțin subunități multiple și preferă homo-oligomerizarea (Ojha et al., 2005; Gould et al., 2007), chaperoninele din cloroplaste formează hetero-oligomeri cu cele două tipuri de subunități α și β ale sale. Heterogenitatea există, de asemenea, în structura co-chaperoninei. Cpn10 este similară cochaperoninei standard, formând un singur inel heptameric de subunități de 10 kDa (Koumoto et al., 2001; Sharkia et al., 2003). Cpn20 are două secvențe polipeptidice asemănătoare cu Cpn10 unite în tandem. Cpn20 purificat există ca o structură tetramerică asemănătoare unui inel care conține o subunitate de 20 kDa. Este pe deplin funcțional in vitro, ajutând la replierea proteinei denaturate în prezența atât a Cpn60 din cloroplast cât și a GroEL din E. coli (Tang et al., 2006). Mai mult, Cpn10 din Chlamydomonas reinhardtii ajută GroEL numai în prezența Cpn20 (Tsai et al., 2012). Astfel, există o eterogenitate considerabilă în asamblarea oligomerică a chaperoninelor cloroplastice.
Se știe că chaperonina mitocondrială umană, mtHsp60, are un mecanism de pliere a proteinelor (proteină mitocondrială) distinct de sistemul GroEL-GroES și necesită un singur inel heptameric pentru a-și îndeplini funcția de pliere a proteinelor împreună cu cochaperonina sa, mtHsp10 (Viitanen et al., 1992; Nielsen și Cowan, 1998). Cu toate acestea, structura cristalină a chaperoninei mitocondriale în complex cu cochaperonina sa, mtHsp60-mtHsp10, descrie un stadiu intermediar unic în care mtHsp60-mtHsp10 formează o structură simetrică de tip fotbal cu inel dublu simetric, (mtHsp60)14 + 2 (mtHsp10)7.
Caperonine de tip I: caracteristici necanonice
Caperonine multiple la nivelul speciilor
Analiza genomurilor complet secvențiate sugerează că aproximativ 30% din toate datele de secvențe genomice posedă copii multiple ale secvențelor de gene care codifică chaperonine (Lund, 2009; Kumar et al, 2015). Distribuția acestor chaperonine multiple pe baza unei analize filogenetice extinse sugerează că multiplele copii ale genelor de chaperonine există predominant în cinci filoane, și anume: (a) phylum Actinobacteria, (b) phylum Firmicutes, (c) phylum Cyanobacteria, (d) phylum Chlamydia și (e) phylum α-Proteobacteria (Kumar et al, 2015).
Actinobacterii
Actinobacteriile sunt bacterii Gram-pozitive și posedă un conținut ridicat de G + C în genomurile lor, de exemplu, Mycobacterium tuberculosis, Mycobacterium leprae și Bifidobacterium longum. Aceste specii posedă, de obicei, două copii ale genelor chaperoninei, una dintre copii fiind prezentă într-o structură de tip operon. Cealaltă copie a Cpn60 există ca o genă independentă, fără prezența genei Cpn10 (Rinke de Wit et al., 1992). Genele de chaperonină actinobacteriană se află sub controlul reglator al factorului de transcripție HrcA, care se leagă de secvența CIRCE (controlling inverted repeat of chaperone expression) din amonte (Duchêne et al., 1994; Grandvalet et al., 1998). În unele cazuri, reglarea este mediată prin legarea factorului de transcripție HspR la secvența HAIR (HspR Associated Inverted Repeat) din amonte (Barreiro et al., 2004).
Firmicute
Firmicutele sunt bacterii Gram-pozitive și posedă un conținut scăzut de G + C în genomurile lor, de exemplu, Staphylococcus aureus, Desulfitobacterium dehalogenans și C. hydrogenoformans. Se știe că firmicutele posedă atât gene de chaperonină de tip I, de tip procariotic, cât și gene de chaperonină de tip arhael, clasificate ca fiind de tip III. Chaperoninele de tip I sunt dispuse într-un aranjament operonic cu cochaperonina, în timp ce gena chaperoninei de tip III este localizată în operonul dnaK. Atât genele chaperoninei de tip I, cât și cele de tip III sunt reglementate de factorul de transcripție HrcA (Techtmann și Robb, 2010).
Chlamydiae
Chlamydiae sunt în principal agenți patogeni intracelulari obligatorii, de exemplu, Chlamydia trachomatis, Chlamydia pneumonia și Chlamydia psittaci. Speciile de chlamydii posedă trei copii ale genelor chaperoninei (McNally și Fares, 2007). Aranjamentul operonic sugerează că există doar o singură copie a genelor chaperoninei împreună cu cochaperonina sa. Cu toate acestea, alte gene de chaperonină sunt localizate separat. Reglarea genelor chaperoninei chlamydiale este complexă. Prima copie a genei chaperoninei este indusă de șocul termic și este reglată de sistemul HrcA-CIRCE. Cea de-a doua copie a genei chaperoninei este indusă atunci când Chlamydia se află în interiorul monocitelor sau macrofagelor (Kol et al., 1999), iar cea de-a treia copie a genei chaperoninei este indusă atunci când Chlamydia se află în celulele Hep-2 (Gérard et al., 2004). Astfel de tipuri de expresie și de reglare a genelor chaperoninei sugerează modele specifice ciclului de viață și roluri funcționale independente pentru acestea.
α-proteobacterii
Rhizobia, care aparțin clasei α-proteobacteriilor, sunt organisme simbiotice care trăiesc în asociere cu plantele leguminoase în nodulii rădăcinilor și sunt implicate în fixarea azotului, de exemplu, Bradyrhizobium japonicum, Rhizobium leguminosarum. Rizobiile conțin cel mai mare număr de copii de chaperonine. B. japonicum are șapte copii ale genelor chaperoninei (Fischer et al., 1993). R. leguminosarum este un organism bine caracterizat și are trei copii ale genelor chaperoninei. Dispunerea genelor la toate aceste organisme sugerează că cele trei copii ale genei chaperoninei formează operoni separați cu genele lor respective de co-chaperonină (George et al., 2004). Unul dintre operonii de chaperonină este localizat pe insula genomică care conține gene implicate în fixarea azotului. Acesta este reglementat de factorii NiF care reglează genele de fixare a azotului (Ogawa și Long, 1995). Cea de-a doua copie a genei chaperoninei nu este bine studiată și se știe că este implicată în proprietatea de chaperonare a mai multor proteine substrat model (George et al., 2004).
Cianobacterii
Cianobacteriile sunt în mare parte bacterii fotosintetice, de exemplu, Synechococcus platensis, Prochlorocococcus marinus și Anabaena variabilis. Aproximativ 90% din secvențele genomice ale speciilor de cianobacterii conțin două copii ale genelor de chaperonină, una dintre ele fiind dispusă pe un operon, în timp ce cealaltă genă de chaperonină este codificată separat. Unele specii de cianobacterii care conțin trei copii ale genelor chaperoninei, unde două dintre genele sale de chaperonină fiind localizate cu respectivele cochaperonine în operon, în timp ce a treia copie a genelor de chaperonină este independentă (Lund, 2009; Kumar et al., 2015). Genele chaperoninei care există în aranjament operonic cu cochaperoninele lor sunt gene esențiale, în timp ce cele care există independent de cochaperonină sunt neesențiale (Sato et al., 2008). Cele două gene de chaperonină cianobacteriană sunt reglementate pozitiv de RpoH și negativ de proteinele HrcA. La șocul termic, una dintre genele chaperoninei este indusă rapid, în timp ce cealaltă genă de chaperonină este indusă treptat (Kojima și Nakamoto, 2007; Rajaram și Apte, 2010). Se știe că gena chaperoninei care este indusă treptat la șocul termic este direct implicată în fotosinteză.
Evolutionary Lineage
Pe măsură ce mai multe secvențe genomice devin disponibile, analiza genelor chaperoninei sugerează că distribuția și frecvența multiplelor copii ale genelor chaperoninei în phyla și organisme continuă să crească (Lund, 2009; Kumar et al., 2015). Pentru a înțelege cauza multiplicității genelor chaperoninei se datorează fie transferului orizontal de gene, fie duplicării genelor, a fost efectuată o analiză filogenetică a proteinelor GroEL între specii, care a relevat faptul că cauzele existenței multiplelor copii ale genelor GroEL sunt neuniforme. În câteva cazuri există un eveniment de duplicare a genelor urmat de selecție evolutivă, cum ar fi cel observat la GroEL-urile myxobacteriene, la prima și a doua copie a GroEL-urilor mycobacteriene și la câteva GroEL-uri rizobiale. În cazul celui de-al treilea omolog GroEL micobacterian, al câtorva GroEL-uri rizobiale și al GroEL-urilor metanosarcinale, a avut loc un transfer orizontal de gene (Goyal et al., 2006; Kumar et al., 2015).
A fost propus anterior în laboratorul nostru că GroEL-ul micobacterian a fost duplicat și a suferit diverse presiuni selective pentru a îndeplini un rol structural și funcțional distinctiv pe parcursul evoluției (Goyal et al., 2006). Studiile biofizice și biochimice asupra GroEL-urilor M. tuberculosis purificate prin recombinare au arătat că GroEL1 și GroEL2 există ca specii oligomerice inferioare, spre deosebire de structura GroEL tetradecamerică a E. coli (Qamra et al., 2004). Structura cristalină a GroEL2 din M. tuberculosis în forma sa dimerică a evidențiat prezența unor reziduuri distincte în regiunea de interfață, probabil responsabile de modificarea oligomerizării (figura 2; Qamra și Mande, 2004). Studiile de amestecare a genelor și de schimbare a domeniilor la M. tuberculosis GroEL1 sugerează că domeniul ecuatorial este responsabil pentru oligomerizarea eșuată. Domeniul apical poate rezista la inserții și ștergeri mari (Kumar et al., 2009). Cam în aceeași perioadă s-a demonstrat că GroEL1 a evoluat pentru a lega în mod promiscuu acizi nucleici (Basu et al., 2009) și că oligomerizarea este facilitată de fosforilarea reziduurilor de serină (Kumar et al., 2009). Deoarece GroEL2 este cunoscută ca fiind o chaperonină esențială la micobacterii, în timp ce asamblarea oligomerică a GroEL1 este reglată post-translațional, s-a raportat că asamblarea tetradecamerică și comunicarea precisă între domenii sunt condiții prealabile pentru activitatea chaperoninei (Chilukoti et al., 2015).
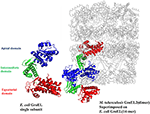
Figura 2. Structura cristalină a GroEL2 din M. tuberculosis suprapusă peste structura GroEL-ES din E. coli. Structura lui M. tuberculosis GroEL2 (PDB ID:1SJP) prezintă un statut oligomeric inferior (dimer). Colorate în albastru, verde și roșu sunt domeniul apical, intermediar și, respectiv, ecuatorial. Comparativ cu E. coli GroEL (PDB ID: 1AON) prezentat în culoarea gri, interacțiunea intersubunități este mediată prin domeniul apical în structura M. tuberculosis GroEL2, în timp ce interacțiunea intersubunități este prin domeniul ecuatorial în E. coli GroEL. Subunitatea unică a M. tuberculosis GroEL2 este aliniată la inelul GroEL legat de E. coli GroES, reprezentând modelul asimetric. Structura GroES a fost eliminată pentru simplificare. O singură subunitate a E. coli GroEL a fost prezentată cu aceleași domenii codificate prin culoare în comparație cu M. tuberculosis GroEL2 pentru o analiză comparativă. Programul PyMOL (PyMOL Molecular Graphics System, versiunea 1.3) a fost utilizat pentru a genera această figură.
Diversitate funcțională
Este important să se examineze dacă prezența mai multor copii ale chaperoninelor este responsabilă pentru a se comporta ca chaperonine canonice sau dacă acestea au deviat pentru a îndeplini funcții noi. De asemenea, este important să se observe dacă aceste chaperonine multiple acționează asupra unor substraturi comune sau asupra unor rezerve distincte de substraturi. GroEL-urile sunt foarte bine conservate în diferite specii și s-a demonstrat că omologii chaperoninelor din alte bacterii pot funcționa în E. coli, ceea ce sugerează suprapunerea proteinelor substrat și un mecanism comun al funcției GroEL. Interacțiunile proteinelor substrat cu GroEL sunt de natură hidrofobă, astfel încât expunerea mediată de modificări conformaționale a domeniilor apical și ecuatorial din cavitate joacă un rol esențial în recunoașterea substratului și ajută la plierea proteinei. Legarea proteinelor substrat la GroEL se face prin intermediul domeniilor α/β ale proteinelor fără similaritate de secvență (Kerner et al., 2005; Kumar și Mande, 2011), iar studiile ulterioare sugerează că GroEL leagă selectiv substraturi globulare mai degrabă decât polipeptide extinse (Robinson et al., 1994; Goldberg et al., 1997). S-a raportat, de asemenea, că mai multe copii de chaperonine într-un organism au evoluat pentru a îndeplini funcții noi. Omologul GroEL dintr-un simbiot de insecte, Xenorhabdus nematophila, s-a dovedit a fi toxic pentru insecte, ceea ce este mediat prin legarea la alfa-chitină. Analiza mutațională a acestor omologi GroEL sugerează că aminoacidul critic pentru acest tip de activitate este diferit de cel al chaperoninei esențiale (Joshi et al., 2008). În M. tuberculosis, GroEL2 acționează ca o chaperonină generalistă (Hu et al., 2008), în timp ce GroEL1 este asociat cu nucleoizi (Basu et al., 2009). Astfel, este evident că duplicarea genelor GroEL a condus la diversitatea funcțională a chaperoninelor și/sau la un spectru distinct de substraturi pentru plierea proteinelor intracelulare.
Modificări post-traducționale/Formarea biofilmelor
Modificările post-traducționale ale proteinelor sunt utilizate de organisme pentru a-și modula procesele fiziologice și pentru a se adapta la mediul în continuă schimbare (Bernal et al., 2014). S-a raportat că chaperoninele au fost modificate posttranslațional în anumite organisme, iar această modificare a fost raportată la câștigarea/pierderea funcției lor. De exemplu, fracționarea lizatului celular de M. tuberculosis a arătat că forma tetradecamerică a GroEL1 este obținută numai în urma fosforilării la nivelul reziduurilor de serină (Kumar et al., 2009). În mod similar, într-un alt raport s-a demonstrat că fosforilarea are loc la nivelul reziduurilor de treonină (Canova et al., 2009). Ambele observații sugerează că oligomerizarea lui GroEL1 este rezultatul unei modificări post-translaționale.
Mulți agenți patogeni eludează răspunsul imunitar înnăscut și devin rezistenți la antibiotice prin formarea de biofilme pe celulele epiteliale (Hall-Stoodley și Stoodley, 2005). Rolul lui GroEL în formarea biofilmelor a fost elucidat la câteva organisme. De exemplu, mutantul GroEL1 din M. smegmatis nu reușește să formeze biofilme. Studiile mecaniciste au arătat că GroEL1 din M. smegmatis interacționează cu enzima KasA, care este esențială pentru biosinteza acidului micolic implicat în formarea biofilmului (Ojha et al., 2005). În mod interesant, s-a raportat recent că GroEL în tulpina patogenă B. anthracis este fosforilat și astfel modulează formarea biofilmului. Aceste constatări evidențiază faptul că fosforilarea lui GroEL are implicații funcționale (Arora et al., 2017). Acetilarea este o altă modificare post-translațională asociată cu chaperoninele din E. coli și M. tuberculosis, însă un rol funcțional nu a fost încă atribuit acestei modificări (Liu et al., 2014). În mod similar, cochaperonina mitocondrială (mtHsp10) suferă o modificare cu acetil și controlează plierea proteinelor mitocondriale în condiții de exces de nutrienți (Lu et al., 2015).
Diverse studii evidențiază importanța reziduurilor C-terminale ale GroEL în funcționarea generală a chaperoninei (Tang et al., 2006; Chen et al., 2013). În cazurile referitoare la copii multiple de chaperonine, acestea au un model distinct de reziduuri C-terminale. În timp ce terminația C-terminală a GroEL (din E. coli) are un motiv de 13 reziduuri (GGM)4M, omologii GroEL din alte organisme (care conțin copii multiple de chaperonine) au motive C-terminale distincte, cum ar fi:
a) Terminația C-terminală bogată în histidină, de exemplu, la micobacterii (Colaco și MacDougall, 2014)
b) Terminația C-terminală fără model, de ex, Rhizobia (George et al., 2004)
c) Repetări similare (GGM)4M, de exemplu, Myxobacteria (Wang et al., 2013)
d) Lipsa cozii de tip GGM, de exemplu, Methanosarcina (Figueiredo et al., 2004)
Se observă în mod clar că mulți paralogi ai chaperoninei din diferite organisme au un C-terminal de tip GGM. La aceste chaperonine se observă o gamă largă de organizare genomică. Mai mult decât atât, se observă diferențe și în ceea ce privește co-expresia lor cu co-chaperonina și esențialitatea funcției lor. Astfel, se observă cu uimire că acești paralogi sunt fie esențiali, fie neesențiali, fie co-exprimați împreună cu cochaperonina lor, fie neexprimați împreună și, eventual, funcționează ca chaperonine de menținere. Pe de altă parte, chaperoninele care nu posedă extremitatea C-terminală asemănătoare cu GGM au evoluat probabil pentru a îndeplini funcții noi (Ojha et al., 2005; Wang et al., 2013; Figura 3).

Figura 3. Multiple chaperonine din bacterii care prezintă diversitate la C-terminal. Alinierea secvenței care evidențiază regiunile C-terminale ale omologilor GroEL bacterieni reprezentativi cu GroEL din E. coli. Ultimele reziduuri C-terminale ale multiplelor GroEL selectate din diferite bacterii prezintă divergențe față de motivul canonic (GGM)4M al GroEL din E. coli indicat în caseta roșie punctată. Secvențele au fost preluate de pe www.uniprot.org și aliniate în MEGA6 cu ajutorul algoritmului MUSCLE (www.megasoftware.net). Formatarea secvențelor aliniate a fost realizată în Jalview alignment viewer (www.jalview.org). Reziduurile din aliniere urmează schema implicită de culori Clustal din Jalview.
Concluding Remarks
Caperoninele de tip I sunt importante în virtutea rolului lor în plierea proteinelor intracelulare. Sistemul GroEL-GroES din bacterii ajută la plierea a aproximativ 10-15% din proteinele citosolice. Diferite structuri ale GroEL rezolvate în forma apo-formă, în forma legată de nucleotide, precum și în complex cu cochaperonina GroES încearcă să explice rolul acestor chaperonine în plierea proteinelor (Saibil et al., 2013). Existența mai multor chaperonine și rolul lor în funcții variate indică o presiune evolutivă în direcția adaptării la diferite condiții de mediu. Structura GroEL2 din M. tuberculosis evidențiază o stare oligomerică mai scăzută și suprafețe hidrofobe mai expuse, probabil pentru a crește rezerva de substrat și conservarea energiei (Qamra și Mande, 2004; Qamra et al., 2004; Kumar și Mande, 2011). Datorită prezenței C-terminalului bogat în histidină în mai multe chaperonine, s-a propus ca acestea să contribuie la funcții biologice alternative. Legătura M. smegmatis GroEL1 cu fierul poate contribui la formarea biofilmului (Ojha et al., 2005). Defectul de supraviețuire al tulpinii GroEL1 knock-out din M. tuberculosis în condiții de aerare redusă ar putea contribui la detectarea oxigenului prin legarea directă la metale sau ar putea ajuta la plierea anumitor metaloproteine (Sharma et al., 2016). Structura altor proteine chaperonine omoloage va răspunde probabil la multitudinea de întrebări asociate cu funcțiile noi ale omologilor chaperoninei.
Contribuții ale autorilor
Toți autorii enumerați au avut o contribuție substanțială, directă și intelectuală la lucrare și au aprobat-o pentru publicare.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
MYA mulțumește sprijinului financiar pentru bursa de cercetare superioară a Departamentului de Biotehnologie (DBT), Ministerul Științei și Tehnologiei, Guvernul Indiei. Autorii ar dori să recunoască cu recunoștință sprijinul financiar pentru munca în laboratorul SCM prin granturile BT/PR15450/COE/34/46/2016 și BT/PR3260/BRB/10/967/2011 ale DBT.
An, Y. J., Rowland, S. E., Na, J. H., Spigolon, D., Hong, S. K., Yoon, Y. J., et al. (2017). Caracterizarea structurală și mecanică a unei chaperonine de tip arheal de la o bacterie termofilă. Nat. Commun. 8:827. doi: 10.1038/s41467-017-00980-z
PubMed Abstract | Text integral | Google Scholar
Arora, G., Sajid, A., Virmani, R., Singhal, A., Kumar, C. M. S. S., Dhasmana, N., et al. (2017). Reglarea protein-kinazei Ser/Thr PrkC mediată de GroEL este esențială pentru formarea biofilmului în Bacillus anthracis. NPJ Biofilms Microbiomes 3:7. doi: 10.1038/s41522-017-0015-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Barreiro, C., González-Lavado, E., Pátek, M., și Martín, J. F. (2004). Transcriptional analysis of the groES-groEL1, groEL2, and dnaK genes in Corynebacterium glutamicum: characterization of heat shock-induced promoters. J. Bacteriol. 186, 4813-4817. doi: 10.1128/JB.186.14.4813-4817.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Basu, D., Khare, G., Singh, S., Tyagi, A., Khosla, S., și Mande, S. C. (2009). O nouă proteină asociată nucleoidului din Mycobacterium tuberculosis este un omolog de secvență al GroEL. Nucleic Acids Res. 37, 4944-4954. doi: 10.1093/nar/gkp502
PubMed Abstract | CrossRef Full Text | Google Scholar
Bernal, V., Castaño-Cerezo, S., Gallego-Jara, J., Écija-Conesa, A., de Diego, T., Iborra, J. L., et al. (2014). Reglarea fiziologiei bacteriene prin acetilarea lizinei din proteine. N. Biotechnol. 31, 586-595. doi: 10.1016/j.nbt.2014.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohen, S. P., Kralli, A., și Yamamoto, K. R. (1995). Hold ‘em și fold’ em: chaperoni și transducția semnalului. Science 268, 1303-1304.
PubMed Abstract | Google Scholar
Bukau, B., și Horwich, A. L. (1998). Mașinile chaperone Hsp70 și Hsp60. Cell 92, 351-366. doi: 10.1016/S0092-8674(00)80928-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Canova, M. J., Kremer, L., and Molle, V. (2009). Chaperonul GroEL1 din Mycobacterium tuberculosis GroEL1 este un substrat al protein-kinazelor Ser/Thr. J. Bacteriol. 191, 2876-2883. doi: 10.1128/JB.01569-08
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, D. H., Madan, D., Weaver, J., Lin, Z., Schröder, G. F., Chiu, W., et al. (2013). Vizualizarea GroEL/ES în actul de încapsulare a unei proteine de pliere. Cell 153, 1354-1365. doi: 10.1016/j.cell.2013.04.052
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, M. Y., Hartl, F. U., Martin, J., Pollock, R. A., Kalousek, F., Neupert, W., et al. (1989). Proteina șocului termic mitocondrial hsp60 este esențială pentru asamblarea proteinelor importate în mitocondriile de drojdie. Nature 337, 620-625. doi: 10.1038/337620a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Chilukoti, N., Kumar, C. M., și Mande, S. C. (2015). GroEL2 din Mycobacterium tuberculosis dezvăluie importanța flexibilității structurale în funcția chaperoninei. J. Bacteriol. 198, 486-497. doi: 10.1128/JB.00844-15
PubMed Abstract | Full CrossRef Text | Google Scholar
Colaco, C. A., și MacDougall, A. (2014). Chaperonine micobacteriene: coada se mișcă câinele. FEMS Microbiol. Lett. 350, 20-24. doi: 10.1111/1574-6968.12276
PubMed Abstract | Reflect Full Text | Google Scholar
Cuéllar, J., Martín-Benito, J., Scheres, S. H., Sousa, R., Moro, F., López-Viñas, E., et al. (2008). Structura CCT-Hsc70 NBD sugerează un mecanism pentru livrarea Hsp70 a substraturilor către chaperonină. Nat. Struct. Mol. Biol. 15, 858-864. doi: 10.1038/nsmb.1464
PubMed Abstract | Text integral | Google Scholar
Dickson, R., Weiss, C., Howard, R. J., Alldrick, S. P., Ellis, R. J., Lorimer, G., et al. (2000). Reconstituirea tetradecamerilor chaperoninei 60 din cloroplastul plantelor superioare active în plierea proteinelor. J. Biol. Chem. 275, 11829-11835. doi: 10.1074/jbc.275.16.11829
PubMed Abstract | Text integral | Google Scholar
Duchêne, A. M., Thompson, C. J., și Mazodier, P. (1994). Analiza transcripțională a genelor groEL în Streptomyces coelicolor A3(2). Mol. Gen. Genet. 245, 61-68. doi: 10.1007/BF00279751
PubMed Abstract | Red Bull | Google Scholar
Fei, X., Ye, X., LaRonde, N. A., și Lorimer, G. H. (2014). Formarea și structurile lui GroEL:Fotolii de chaperonină GroES2, forma funcțională de pliere a proteinei. Proc. Natl. acad. Sci. U.S.A. 111, 12775-12780. doi: 10.1073/pnas.1412922111
PubMed Abstract | CrossRef Full Text | Google Scholar
Figueiredo, L., Klunker, D., Ang, D., Naylor, D. J., Kerner, M. J., Georgopoulos, C., et al. (2004). Caracterizarea funcțională a unui sistem de chaperonină arheală GroEL/GroES: semnificația încapsulării substratului. J. Biol. Chem. 279, 1090-1099. doi: 10.1074/jbc.M310914200
PubMed Abstract | Text integral | Google Scholar
Fischer, H. M., Babst, M., Kaspar, T., Acuña, G., Arigoni, F., și Hennecke, H. (1993). One member of a gro-ESL-like chaperonin multigene family in Bradyrhizobium japonicum is co-regulated with symbiotic nitrogen fixation genes. EMBO J. 12, 2901-2912.
PubMed Abstract | Google Scholar
George, R., Kelly, S. M., Price, N. C., Erbse, A., Fisher, M., și Lund, P. A. (2004). Trei omologi GroEL din Rhizobium leguminosarum au proprietăți distincte in vitro. Biochem. Biophys. Res. Commun. 324, 822-828. doi: 10.1016/j.bbrc.2004.09.140
PubMed Abstract | Ref. Full Text | Google Scholar
Gérard, H. C., Whittum-Hudson, J. A., Schumacher, H. R., și Hudson, A. P. (2004). Expresia diferențială a trei gene care codifică hsp60 de Chlamydia trachomatis în infecții active vs. persistente. Microb. Pathog. 36, 35-39. doi: 10.1016/j.micpath.2003.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberg, M. S., Zhang, J., Sondek, S., Matthews, C. R., Fox, R. O., și Horwich, A. L. (1997). Structura de tip nativ a unui intermediar de pliere a proteinelor legat de chaperonina GroEL. Proc. Natl. acad. Sci. U.S.A. 94, 1080-1085. doi: 10.1073/pnas.94.4.1080
PubMed Abstract | CrossRef Full Text | Google Scholar
Gould, P. S., Burgar, H. R., și Lund, P. A. (2007). Genele cpn60 omoloage din Rhizobium leguminosarum nu sunt echivalente din punct de vedere funcțional. Cell Stress Chaperones 12, 123-131. doi: 10.1379/CSC-227R.1
CrossRef Full Text | Google Scholar
Goyal, K., Qamra, R., and Mande, S. C. (2006). Duplicarea multiplă a genelor și evoluția rapidă în gena groEL: implicații funcționale. J. Mol. Evol. 63, 781-787. doi: 10.1007/s00239-006-0037-7
PubMed Abstract | Refef Full Text | Google Scholar
Grandvalet, C., Rapoport, G., și Mazodier, P. (1998). hrcA, care codifică represorul genelor groEL la Streptomyces albus G, este asociat cu o a doua genă dnaJ. J. Bacteriol. 180, 5129-5134.
Google Scholar
Hall-Stoodley, L., și Stoodley, P. (2005). Formarea și dispersia biofilmelor și transmiterea agenților patogeni umani. Trends Microbiol. 13, 7-10. doi: 10.1016/j.tim.2004.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Hayer-Hartl, M. K., Martin, J., și Hartl, F. U. (1995). Interacțiunea asimetrică a lui GroEL și GroES în ciclul ATPază de pliere asistată a proteinelor. Science 269, 836-841. doi: 10.1126/science.7638601
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, J. E. și Hemmingsen, S. M. (2001). Arabidopsis thaliana tip I și II chaperonine. Cell Stress Chaperones 6, 190-200. doi: 10.1379/1466-1268(2001)006<0190:ATTIAI>2.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Hu, Y., Henderson, B., Lund, P. A., Tormay, P., Ahmed, M. T., Gurcha, S. S., et al. (2008). Un mutant de Mycobacterium tuberculosis căruia îi lipsește omologul groEL cpn60.1 este viabil, dar nu reușește să inducă un răspuns inflamator în modelele animale de infecție. Infect. Immun. 76, 1535-1546. doi: 10.1128/IAI.01078-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Iizuka, R., So, S., Inobe, T., Yoshida, T., Zako, T., Kuwajima, K., et al. (2004). Rolul protuberanței elicoidale în schimbarea conformațională și în activitatea de chaperon molecular a chaperoninei arheale din grupul II. J. Biol. Chem. 279, 18834-18839. doi: 10.1074/jbc.M400839200
PubMed Abstract | CrossRef Full Text | Google Scholar
Joshi, M. C., Sharma, A., Kant, S., Birah, A., Gupta, G. P., Khan, S. R., et al. (2008). O proteină GroEL insecticidă cu activitate de legare a chitinei din Xenorhabdus nematophila. J. Biol. Chem. 283, 28287-28296. doi: 10.1074/jbc.M804416200
PubMed Abstract | Refef Full Text | Google Scholar
Kerner, M. J., Naylor, D. J., Ishihama, Y., Maier, T., Chang, H. C., Stines, A. P., et al. (2005). Proteome-wide analysis of chaperonin-dependent protein folding in Escherichia coli. Cell 122, 209-220. doi: 10.1016/j.cell.2005.05.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, Y. E., Hipp, M. S., Bracher, A., Hayer-Hartl, M., și Hartl, F. U. (2013). Funcțiile chaperonilor moleculari în plierea proteinelor și proteostazia. Annu. Rev. Biochem. 82, 323-355. doi: 10.1146/annurev-biochem-060208-092442
PubMed Abstract | Textul integral | Google Scholar
Kojima, K., și Nakamoto, H. (2007). O nouă reglare sensibilă la lumină și căldură a transcripției groE în absența HrcA sau CIRCE la cianobacterii. FEBS Lett. 581, 1871-1880. doi: 10.1016/j.febslet.2007.03.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Kol, A., Bourcier, T., Lichtman, A. H. și Libby, P. (1999). Chlamydial și proteina de șoc termic uman 60s activează endoteliul vascular uman, celulele musculare netede și macrofagele. J. Clin. Invest. 103, 571-577. doi: 10.1172/JCI5310
PubMed Abstract |Ref Full Text | Google Scholar
Koumoto, Y., Shimada, T., Kondo, M., Hara-Nishimura, I., și Nishimura, M. (2001). Cloroplastele au un nou Cpn10 în plus față de Cpn20 ca și co-chaperonine în Arabidopsis thaliana. J. Biol. Chem. 276, 29688-29694. doi: 10.1074/jbc.M102330200
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumar, C. M., Khare, G., Srikanth, C. V., Tyagi, A. K., Sardesai, A. A. și Mande, S. C. (2009). Oligomerizarea facilitată a GroEL micobacteriană: dovezi pentru oligomerizarea mediată de fosforilare. J. Bacteriol. 191, 6525-6538. doi: 10.1128/JB.00652-09
PubMed Abstract | Text integral | Google Scholar
Kumar, S., și Mande, S. (2011). Chaperone proteice și substraturi neproteice: pe promiscuitatea substratului lui GroEL. Curr. Sci. 100, 1646-1653.
Google Scholar
Kumar, C. M., Mande, S. C., și Mahajan, G. (2015). Chaperonine multiple în bacterii – funcții noi și comportamente necanonice. Cell Stress Chaperones 20, 555-574. doi: 10.1007/s12192-015-0598-8
CrossRef Full Text | Google Scholar
Lindquist, S. (1986). Răspunsul la șocul termic. Annu. Rev. Biochem. 55, 1151-1191. doi: 10.1146/annurev.bi.55.070186.005443
PubMed Abstract | CrossRef Full Text | Google Scholar
Lindquist, S., și Craig, E. A. (1988). Proteinele de șoc termic. Annu. Rev. Genet. 22, 631-677. doi: 10.1146/annurev.ge.22.120188.003215
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, F., Yang, M., Wang, X., Yang, S., Gu, J., Zhou, J., et al. (2014). Analiza acetilomului dezvăluie diverse funcții de acetilare a lizinei în Mycobacterium tuberculosis. Mol. Cell. Proteomics 13, 3352-3366. doi: 10.1074/mcp.M114.041962
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, Z., Chen, Y., Aponte, A. M., Battaglia, V., Gucek, M., și Sack, M. N. (2015). Postul prelungit identifică proteina de șoc termic 10 ca substrat Sirtuin 3, elucidând un nou mecanism care leagă acetilarea proteinelor mitocondriale de plierea și funcția enzimei de oxidare a acizilor grași. J. Biol. Chem. 290, 2466-2476. doi: 10.1074/jbc.M114.606228
PubMed Abstract | CrossRef Full Text | Google Scholar
Lund, P. A. (2009). Chaperonine multiple în bacterii – de ce atât de multe? FEMS Microbiol. Rev. 33, 785-800. doi: 10.1111/j.1574-6976.2009.00178.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Mande, S. C., Mehra, V., Bloom, B. R., și Hol, W. G. (1996). Structura proteinei șocului termic chaperonin-10 a proteinei șocului termic din Mycobacterium leprae. Science 271, 203-207. doi: 10.1126/science.271.5246.203
PubMed Abstract | CrossRef Full Text | Google Scholar
McNally, D., și Fares, M. A. (2007). Identificarea in silico a divergenței funcționale între multiplii paralogi ai genei groEL în Chlamydiae. BMC Evol. Biol. 7:81. doi: 10.1186/1471-2148-7-81
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, K. L., and Cowan, N. J. (1998). Un singur inel este suficient pentru o pliere productivă mediată de chaperonină in vivo. Mol. Cell 2, 93-99. doi: 10.1016/S1097-2765(00)80117-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Ogawa, J., și Long, S. R. (1995). Locusul groELc din Rhizobium meliloti este necesar pentru reglarea genelor de nod timpuriu de către activatorul de transcripție NodD. Genes Dev. 9, 714-729. doi: 10.1101/gad.9.6.714
PubMed Abstract | Text integral | Google Scholar
Ojha, A., Anand, M., Bhatt, A., Kremer, L., Jacobs, W. R., și Hatfull, G. F. (2005). GroEL1: un chaperon dedicat implicat în biosinteza acidului micolic în timpul formării biofilmului la micobacterii. Cell 123, 861-873. doi: 10.1016/j.cell.2005.09.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Qamra, R., și Mande, S. C. (2004). Structura cristalină a proteinei șocului termic de 65-kilodaltoni, chaperonina 60.2, din Mycobacterium tuberculosis. J. Bacteriol. 186, 8105-8113. doi: 10.1128/JB.186.23.8105-8113.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Qamra, R., Srinivas, V., și Mande, S. C. (2004). Omologii GroEL din Mycobacterium tuberculosis GroEL există în mod neobișnuit ca oligomeri inferiori și păstrează capacitatea de a suprima agregarea proteinelor substrat. J. Mol. Biol. 342, 605-617. doi: 10.1016/j.jmb.2004.07.066
PubMed Abstract | CrossRef Full Text | Google Scholar
Rajaram, H., și Apte, S. K. (2010). Reglarea diferențială a expresiei operonului groESL ca răspuns la căldură și lumină în Anabaena. Arch. Microbiol. 192, 729-738. doi: 10.1007/s00203-010-0601-9
PubMed Abstract | Full Text | Google Scholar
Ranson, N. A., White, H. E., și Saibil, H. R. (1998). Chaperonine. Biochem. J. 333(Pt 2), 233-242. doi: 10.1042/bj3330233
PubMed Abstract | CrossRef Full Text | Google Scholar
Richter, K., Haslbeck, M., and Buchner, J. (2010). Răspunsul la șocul termic: viața în pragul morții. Mol. Cell 40, 253-266. doi: 10.1016/j.molcel.2010.10.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Rinke de Wit, T. F., Bekelie, S., Osland, A., Miko, T. L., Hermans, P. W., van Soolingen, D., et al. (1992). Micobacteriile conțin două gene groEL: cea de-a doua genă groEL a Mycobacterium leprae este dispusă într-un operon cu groES. Mol. Microbiol. 6, 1995-2007. doi: 10.1111/j.1365-2958.1992.tb01372.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Robinson, C. V., Gross, M., Eyles, S. J., Ewbank, J. J., Mayhew, M., Hartl, F. U., et al. (1994). Conformation of GroEL-bound alpha-lactalbumin probed by mass spectrometry. Nature 372, 646-651. doi: 10.1038/372646a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Saibil, H. R., Fenton, W. A., Clare, D. K., și Horwich, A. L. (2013). Structura și alosteria chaperoninei GroEL. J. Mol. Biol. 425, 1476-1487. doi: 10.1016/j.jmb.2012.11.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Sameshima, T., Ueno, T., Iizuka, R., Ishii, N., Terada, N., Okabe, K., et al. (2008). Complexele GroEL-GroES în formă de fotbal și de glonț coexistă în timpul ciclului de reacție. J. Biol. Chem. 283, 23765-23773. doi: 10.1074/jbc.M802541200
PubMed Abstract | Full CrossRef Text | Google Scholar
Sato, S., Ikeuchi, M., și Nakamoto, H. (2008). Expresia și funcția unui paralog groEL în cianobacteria termofilă Thermosynechococcus elongatus în condiții de stres termic și rece. FEBS Lett. 582, 3389-3395. doi: 10.1016/j.febslet.2008.08.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Schirmer, E. C., Glover, J. R., Singer, M. A., și Lindquist, S. (1996). Proteinele HSP100/Clp: un mecanism comun explică diverse funcții. Trends Biochem. Sci. 21, 289-296. doi: 10.1016/S0968-0004(96)10038-4
PubMed Abstract | Ref Full Text | Google Scholar
Sharkia, R., Bonshtien, A. L., Mizrahi, I., Weiss, C., Niv, A., Lustig, A., et al. (2003). On the oligomeric state of chloroplast chaperonin 10 and chaperonin 20. Biochim. Biophys. Acta 1651, 76-84. doi: 10.1016/S1570-9639(03)00237-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharma, A., Rustad, T., Mahajan, G., Kumar, A., Rao, K. V., Banerjee, S., et al. (2016). Spre înțelegerea funcției biologice a chaperoninei neobișnuite Cpn60.1 (GroEL1) din Mycobacterium tuberculosis. Tuberc. Edinb. Scotl. 97, 137-146. doi: 10.1016/j.tube.2015.11.003
PubMed Abstract | Full Text | Google Scholar
Tang, Y. C. C., Chang, H. C. C., Roeben, A., Wischnewski, D., Wischnewski, N., Kerner, M. J., et al. (2006). Caracteristici structurale ale nanocasei GroEL-GroES necesare pentru plierea rapidă a proteinei încapsulate. Cell 125, 903-914. doi: 10.1016/j.cell.2006.04.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Techtmann, S. M., și Robb, F. T. (2010). Chaperonine asemănătoare arheilor în bacterii. Proc. Natl. acad. Sci. U.S.A. 107, 20269-20274. doi: 10.1073/pnas.1004783107
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsai, Y. C., Mueller-Cajar, O., Saschenbrecker, S., Hartl, F. U., și Hayer-Hartl, M. (2012). Cofactorii chaperoninei, Cpn10 și Cpn20, din algele verzi și plantele funcționează ca complexe inelare hetero-oligomerice. J. Biol. Chem. 287, 20471-20481. doi: 10.1074/jbc.M112.365411
PubMed Abstract | Refef Full Text | Google Scholar
Viitanen, P. V., Lorimer, G. H., Seetharam, R., Gupta, R. S.., Oppenheim, J., Thomas, J. O., et al. (1992). Chaperonina 60 mitocondrială a mamiferelor funcționează ca un singur inel toroidal. J. Biol. Chem. 267, 695-698.
PubMed Abstract | Google Scholar
Wang, Y., Zhang, W. Y., Zhang, Z., Li, J., Li, Z. F., Li, Z. F., Tan, Z. G., et al. (2013). Mecanisme implicate în divergența funcțională a chaperoninelor GroEL duplicate în Myxococcus xanthus DK1622. PLoS Genet. 9:e1003306. doi: 10.1371/journal.pgen.1003306
PubMed Abstract | CrossRef Full Text | Google Scholar
Ye, X., și Lorimer, G. H. (2013). Proteina substratului comută chaperoninele GroE de la ciclul asimetric la cel simetric prin catalizarea schimbului de nucleotide. Proc. Natl. acad. Sci. U.S.A. 110, E4289-E4297. doi: 10.1073/pnas.1317702110
PubMed Abstract | CrossRef Full Text | Google Scholar
.