08 aug 2019
Menționați ApoE și Alzheimer, iar conversația se îndreaptă spre alela E4, cea mai puternică genă de susceptibilitate pentru această boală. Dar ApoE are și o altă față, în ApoE2. Deși această izoformă protejează împotriva bolii Alzheimer, oamenii de știință abia au studiat-o. Acum, ApoE2 atrage atenția, deoarece oamenii de știință se întreabă cum anume își mențin unii oameni acuitatea mentală până la o vârstă înaintată. În cadrul Conferinței Internaționale a Asociației Alzheimer, care a avut loc în perioada 14-18 iulie la Los Angeles, un studiu al genotipurilor ApoE la 5.000 de cazuri de AD confirmate prin autopsie a dezvăluit că persoanele cu două copii de E2 își văd riscul de demență scăzând cu un procent uimitor de 90 la sută în comparație cu cele cu genotipul comun E3/E3. Alte lucrări au sugerat că acest lucru s-ar putea datora faptului că ApoE2 reduce patologia amiloidă și tau și crește volumul materiei cenușii în regiunile critice ale creierului. Beneficiile E2 par a fi specifice bolii Alzheimer, nu generice pentru neurodegenerare.
ApoE este principala proteină purtătoare de colesterol din creier. A fost studiată de la descoperirea sa ca o genă de risc pentru AD la începutul anilor 1990, dar apare recent ca un centru pentru răspunsurile gliale la depunerea de agregate amiloide și tau (știri din august 2018; știri din septembrie 2017). Gena există sub forma a trei alele polimorfe – E2, E3 și E4 – cu o frecvență la nivel mondial de 8 la sută, 78 la sută și, respectiv, 14 la sută. Sunt cunoscute, de asemenea, mai multe forme mutante, de exemplu așa-numitele mutații Heidelberg, Pittsburgh și Christchurch (Feussner et al., 1992; Kamboh et al., 1999; Wardell et al., 1987).
ApoE4 primește de departe cea mai mare atenție din partea cercetătorilor în domeniul AD, deoarece crește riscul de AD de până la 15 ori, în funcție de populația studiată, și apare la 40 la sută dintre persoanele cu AD. E2, alela protectoare, a primit puțină atenție, deoarece este cea mai puțin frecventă dintre cele trei și este în mare parte absentă din eșantioanele de AD. Persoanele cu o singură copie a E2 au jumătate din șansele de a dezvolta DA în comparație cu cele cu genotipul E3/E3, mai frecvent. Dar are E2 suplimentar un efect dincolo de acesta? „Nu am știut dacă doza E2 are un risc diferențiat, adică dacă riscul E2/2 este semnificativ mai mic decât E2/3”, a declarat Eric Reiman în prezentarea studiului.
Pentru a afla, Reiman și colegii de la Banner Alzheimer’s Institute, Phoenix, Gyungah Jun de la Universitatea din Boston, Joseph Arboleda de la Massachusetts Eye and Ear, Yakeel Quiroz de la Massachusetts General Hospital și colegii de la AD Genetics Consortium au decis să analizeze datele de la o mulțime de creiere. Aceștia au analizat contribuția tuturor celor trei alele ApoE la riscul de demență și la patologie în 5.007 creiere din cadrul ADGC. Acest eșantion a inclus 4.018 cazuri de demență Alzheimer confirmate prin autopsie, plus 989 donatori neafectați din punct de vedere patologic și cognitiv. Pe lângă faptul că oferă un număr suficient pentru a studia homozigoții E2/E2, această cohortă evită problema de confuzie a diagnosticului greșit prin eliminarea demențelor care nu se datorează bolii Alzheimer, precum și a persoanelor care aveau patologie de Alzheimer la momentul decesului, dar nu aveau demență.
După cum era de așteptat, homozigoții ApoE2 au fost rari – numărând doar 24 din mai mult de 5.000 de persoane, sau 0,5 la sută. În comparație cu alte genotipuri, ei au fost mult mai puțin susceptibili de a avea AD. Homozigoții E2 reprezentau 0,1 la sută din cazuri, dar 1,9 la sută din controalele sănătoase. În schimb, homozigoții ApoE4/4 au reprezentat 15,6 la sută din cazuri și doar 1 la sută din controale. Cu alte cuvinte, 19 dintre cei 24 de ApoE2/2 erau sănătoși din punct de vedere cognitiv, dar doar 10 dintre cei 633 de ApoE4/4 erau sănătoși.
Omozigoții ApoE2 au avut o reducere a riscului de 66 la sută în comparație chiar și cu purtătorii E2/3, o reducere a riscului de 87 la sută în comparație cu cel mai comun genotip, E3/3, și o reducere uriașă a riscului de 99,6 la sută în comparație cu persoanele care erau E4/4. Practic, majoritatea persoanelor cu E4/4 fac demență Alzheimer, în timp ce puțini dintre cei cu ApoE 2/2 fac acest lucru.
Deținerea a două alele E2 s-a corelat cu mai puțină patologie a plăcii amiloide și a încurcăturilor neurofibrilare tau. Efectul protector al ApoE2 asupra patologiei tau a fost încă evident chiar și atunci când a fost ajustat pentru încărcătura de plăci amiloide. Acest lucru reflectă datele recente de pe animale care sugerează că ApoE4 acționează pentru a înrăutăți patologia tau independent de amiloid (Shi et al., 2017).
Concluzia principală a noului studiu o reflectă pe cea a unui studiu anterior realizat de Pieter-Jelle Visser, Universitatea Maastricht, Olanda, și colegii săi. Aceștia găsiseră 16 purtători ApoE2/2 într-un eșantion de 7.583 de persoane, dintre care 10 erau normale din punct de vedere cognitiv și amiloid-negative, în timp ce 301 dintre cei 386 de purtători ApoE4/4 din eșantion aveau demență Alzheimer. Cu toate acestea, acest eșantion nu a fost confirmat din punct de vedere patologic (Jansen et al., 2015).
Cât de importantă este confirmarea neuropatologică? Reiman et al. au comparat estimările de risc derivate din cohorta verificată prin autopsie cu cele calculate dintr-o cohortă de 23.857 de persoane în viață care au fost diagnosticate clinic ca având demență Alzheimer probabilă sau fiind normale din punct de vedere cognitiv și care aveau un statut amiloid necunoscut. În această analiză, atât efectul protector al 2/2, cât și riscul crescut datorat 4/4, au fost subestimate. De exemplu, cercetătorii au constatat că raportul de șanse asociat cu E4/E4 față de E3/E3 în eșantionul clinic a fost de 10,7, față de 31,22 în cazurile confirmate patologic. Efectele dozei atât pentru E2, cât și pentru E4 au fost, de asemenea, subestimate în eșantionul viu. Astfel, analiza autopsiei oferă estimări de risc actualizate și, probabil, mai precise pentru toate genotipurile ApoE, consideră Reiman și colegii săi, cel puțin pentru acești participanți albi nehispanici la cercetare.
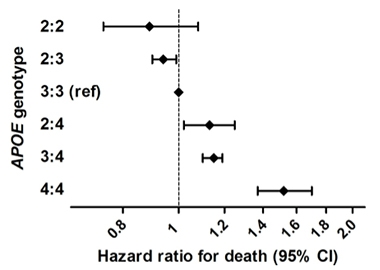
Prelungirea vieții. Într-un studiu epidemiologic amplu care a combinat șase cohorte populaționale de persoane cu ascendență europeană, homozigoții ApoE2 au prezentat un risc mai scăzut de deces decât alte genotipuri. Omozigoții ApoE4 au prezentat cel mai mare risc.
Se știe că impactul ApoE asupra bolii Alzheimer diferă între grupurile etnice. Acest tip de studiu este necesar cu subiecți mai diverși, cu mai mulți homozigoți E2/2 și luând în considerare posibilele efecte ale alelelor ApoE asupra supraviețuirii, care ar putea distorsiona rezultatele. Cu toate acestea, Reiman a spus: „Rezultatele noastre sugerează că homozigozitatea ApoE2 este asociată cu un risc excepțional de AD, că impactul APOE și al variantelor sale asupra riscului de AD este semnificativ mai mare decât s-a apreciat anterior și că există un motiv imperios pentru a descoperi tratamente care să promoveze acest efect protector.”
Acest lucru se potrivește cu rezultatele recente ale lui Sudha Seshadri, University of Texas Health, San Antonio, Frank Wolters, Erasmus Medical Center, Rotterdam, Olanda, și colegii săi. Aceștia au descoperit un avantaj de supraviețuire pentru purtătorii ApoE2 într-un studiu de 38.537 de persoane din șase cohorte bazate pe populație (Wolters et al., 2019). Ei au identificat 239 de homozigoți E2, care au dus cele mai lungi vieți. Efectul E2 a fost explicat doar parțial prin efectele sale asupra lipidelor din sânge sau a bolilor vasculare. Homozigoții E4 au avut cel mai mare risc de deces, iar acest lucru a fost explicat în mare parte prin asocierea sa cu demența. Seshadri a declarat pentru Alzforum că cercetătorii vor analiza AD și schimbările cognitive și, de asemenea, măsurile PET de amiloid și tau în acest eșantion.
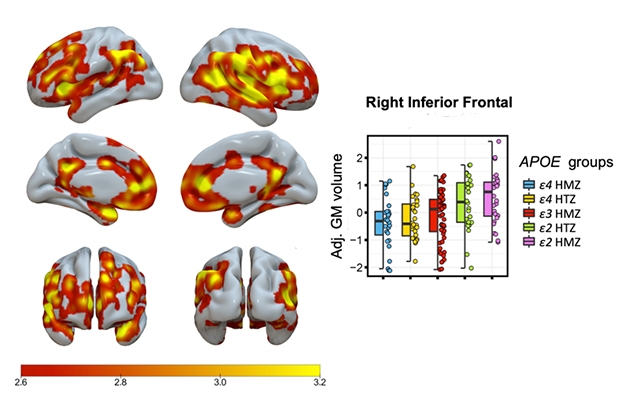
Bit by Bit. Umbrirea indică zonele cu o creștere semnificativă în trepte, legată de genotipul ApoE, a volumului de materie cenușie, homozigoții E4/4 având cel mai mic volum și E2/2s cel mai mare volum. Graficul prezintă date pentru o regiune a creierului.
Cum ar putea ApoE2 conferi reziliență? Pentru a afla, Gemma Salvadó, de la Barcelonaβeta Brain Research Center, Spania, a prezentat un studiu în care ea și coautorii au adunat date imagistice de la diferite eșantioane de la cât mai mulți homozigoți ApoE2 mai în vârstă posibil. Scopul lor a fost de a compara structura cerebrală a E2/2s cu cea a altor genotipuri ApoE.
Anterior, E2 a fost legat de modificări subtile ale morfologiei creierului la persoanele sănătoase, inclusiv o atrofie hipocampală mai lentă la bătrânețe și hipocampi mai mari la vârsta mijlocie (Chiang et al., 2010; Fennema-Notestine et al., 2011). În copilărie, s-a raportat că purtătorii E2 au cortexul entorhinal mai gros decât homozigoții E3 sau purtătorii E4 (Shaw et al., 2007). Dar toate aceste studii s-au concentrat asupra persoanelor cu o singură copie a E2.
Pentru a afla ce ar face acel E2 suplimentar, Salvadó a colectat și a analizat datele RMN ale persoanelor fără deficiențe cognitive din studiul ALFA din Barcelona (Molinuevo et al. 2016), cohorta Centrului Medical al Universității din Amsterdam, studiile de imagistică cu acces deschis OASIS și ADNI. Ea a găsit 28 de homozigoți E2/E2. I-a comparat pe fiecare dintre ei cu alți cinci subiecți din același centru în funcție de vârstă, sex și nivel de educație, precum și cu câte unul din fiecare alt genotip ApoE. Asta a dat un total de 168 de subiecți, cu o vârstă medie de 62 de ani.
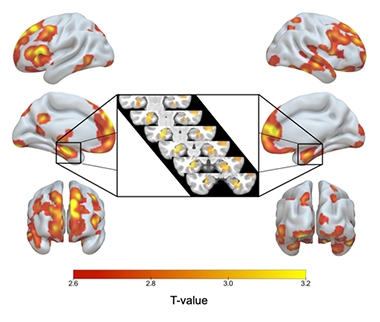
ApoE2/2 Peste 3/3. Umbrirea de la roșu la galben indică regiunile creierului în care homozigoții ApoE2 aveau mai multă materie cenușie decât homozigoții E3, inclusiv ambele hipocampi (inset).
În comparație cu corespondenții lor E3/3, E2/2 au avut un volum mai mare de materie cenușie în hipocampi și în alte zone caracteristice AD, inclusiv cortexul temporal medial, temporal inferior, polul temporal, precuneus și regiunile parietale superioare. Homozigoții E2 aveau, de asemenea, mai multă materie cenușie în zonele legate de reziliența cognitivă la îmbătrânire, și anume în zonele cingulate anterioare și prefrontale mediale (Arenaza-Urquijo et al., 2019; Harrison et al., 2018). În comparație cu heterozigoții E2/3, homozigoții E2 s-au lăudat cu puține diferențe semnificative în materie cenușie, dar au avut hipocampi chiar mai mari decât cei 2/3.
Salvadó a raportat o creștere în trepte, legată de genotip, a volumului materiei cenușii, homozigoții E4/4 având cel mai mic volum, E3/3s având un volum intermediar, E2/3s mai mare, iar E2/2s cel mai mare volum (vezi imaginea de mai jos).

ApoE2/2 Peste 2/3. Comparativ cu următorul genotip protector, ApoE2/3, homozigoții E2 au mai multă materie cenușie doar în câteva zone mici.
Ea crede că materia cenușie mai mare în zonele strategice ale creierului poate ajuta homozigoții E2 să facă față patologiei AD, dacă și când aceasta apare. Deoarece ApoE2 umflă cortexul entorinal încă din copilărie, reziliența poate izvorî din procesele de dezvoltare, a spus ea.
„Acestea sunt descoperiri foarte importante”, a comentat Reiman. „Ele sugerează că, dacă atrofia este ca și cum ar eroda banda de rulare în anvelope, homozigoții E2 pot începe cu mai multă bandă de rulare”, a spus el. Salvadó încearcă să extindă studiul pentru a examina mai mulți homozigoți din cohorte suplimentare, precum și alte moduri de imagistică.
Terry Goldberg, Universitatea Columbia, New York, studiază de ani de zile mecanismele potențiale de neuroprotecție mediată de ApoE2 (Conejero-Goldberg et al., 2014). La AAIC, Goldberg a prezentat rezultatele privind relația dintre alelele ApoE și neuropatologia în AD și a extins analiza la alte boli.
Acesta a folosit date privind 1.557 de creiere din baza de date a Centrului Național de Coordonare Alzheimer, care aveau atât evaluări clinice, cât și neuropatologice. Deoarece a avut atât de puțini homozigoți E2, Goldberg a grupat împreună genotipurile E2/E2 și E2/E3, pentru un eșantion de 130 de persoane. În acest grup combinat, unul din patru creiere avea modificări neuropatice AD, în comparație cu 40 la sută dintre E3/3, 65 la sută dintre E3/4 și 85 la sută dintre E4/4. În concordanță cu lucrările anterioare, purtătorii E2 au avut cea mai ușoară patologie amiloidă, cele mai puține plăci neuronale și cea mai ușoară patologie tau. O analiză de mediere statistică a sugerat că asocierea ApoE2 cu reducerea încurcăturilor a trecut parțial prin efectul său asupra amiloidului și a fost parțial independentă de amiloid. Acest lucru se potrivește cu rezultatele lui Reiman.
În acest set de date, de asemenea, ApoE2 a protejat puternic, chiar dacă Goldberg nu a analizat homozigoții: E2 a redus riscul de patologie amiloidă și tau la jumătate în comparație cu E3, și cu 90 la sută în comparație cu E4.
Ce este mai puternic, E2 sau E4? Comparând genotipurile E2/E4 și E3/E4, Goldberg a găsit niveluri comparabile de patologie. În orice caz, împerecherea E2/E4 a fost mai rea. Acest lucru sugerează că E4 copleșește efectele protectoare ale lui E2. „Se poate spune că E4 este toxic”, a concluzionat Goldberg. Acest lucru sugerează că terapiile care utilizează construcții virale pentru a introduce E2 în țesutul cerebral care exprimă E4 ar putea să nu fie de ajutor, a spus el.
Ce se întâmplă cu alte boli neurodegenerative?
Literatura oferă rezultate mixte cu privire la E2 și E4 în demența frontotemporală. Unele studii sugerează că E2 promovează riscul (știre din martie 2016), în timp ce altele îl creditează cu protecție și pun riscul pe seama lui E4 (Mishra et al., 2017). La AAIC, Goldberg a raportat că E2 a fost asociat cu o patologie TDP-43 mai severă în 103 cazuri de demență frontotemporală și cu mai multă patologie tau în 28 de cazuri de boală Pick și 51 de cazuri de paralizie supranucleară progresivă. El a avertizat că aceste cifre sunt atât de mici, încât rezultatele ar putea fi false. Goldberg nu știe dacă acești pacienți au avut mutații C9ORF72 sau progranulină, iar acumularea TDP-43 poate fi asociată cu vârsta. În cazurile de patologie cu α-sinucleină, Goldberg a constatat că ApoE4 promovează, iar E2 reduce răspândirea patologiei cu corpuri Lewy în afara originii sale din mezencefal, în zonele limbice și neocorticale
Împreună, aceste studii evidențiază o apreciere reînnoită a impactului enorm pe care ApoE îl exercită asupra patogenezei AD (de exemplu, a se vedea Wu și Zhao, 2016). Protecția profundă oferită de E2 va reaprinde probabil interesul în rândul dezvoltatorilor de medicamente, care au mai încercat înainte și au eșuat, dar care acum ar putea considera potrivit să revină asupra acestei ținte.-Pat McCaffrey
Citărilor de știri
- ApoE: Vinovatul microglial comun în îmbătrânire, Alzheimer și Tauopatie? 11 Aug 2018
- ApoE4 înrăutățește toate lucrurile Tau, de la început până la sfârșit 20 Sep 2017
- Et Tu, ApoE2? Paper Claims Allele Boosts Risk for Dementia-in ALS 1 mar 2016
Paper Citations
- Feussner G, Funke H, Weng Weng, Assmann G, Lackner KJ, Ziegler R.Severe type III hyperlipoproteinemia associated with unusual apolipoprotein E1 phenotype and epsilon 1/’null’ genotype. Eur J Clin Invest. 1992 Sep;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST.O nouă mutație în gena apolipoproteinei E (APOE*4 Pittsburgh) este asociată cu riscul de boală Alzheimer cu debut tardiv. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoproteina E2-Christchurch (136 Arg—-Ser). O nouă variantă a apolipoproteinei umane E la un pacient cu hiperlipoproteinemie de tip III. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.ApoE4 exacerbează în mod marcat neurodegenerarea mediată de tau într-un model de șoarece de tauopatie. Nature. 2017 Sep 28;549(7673):523-527. Epub 2017 Sep 20 PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Prevalența patologiei amiloide cerebrale la persoanele fără demență: o meta-analiză. JAMA. 2015 May 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE investigators.Impactul genotipului APOE asupra supraviețuirii: Rezultatele a 38.537 de participanți din șase cohorte bazate pe populație (E2-CHARGE). PLoS One. 2019;14(7):e0219668. Epub 2019 iul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .Hippocampal rate de atrofie și biomarkeri CSF la subiecții vârstnici APOE2 normali. Neurologie. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.Prezența alelei ApoE ε4 asociată cu cortexul frontal mai subțire la vârsta mijlocie. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN.Morfologia corticală la copii și adolescenți cu diferite polimorfisme ale genei apolipoproteinei E: un studiu observațional. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.The ALFA project: O platformă de cercetare pentru identificarea caracteristicilor fiziopatologice timpurii ale bolii Alzheimer. Alzheimers Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3 PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P. Semnătura metabolică a creierului de reziliență cognitivă la 80+: dincolo de patologiile Alzheimer. Brain. 2019 Apr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ.Morfologia creierului, cogniția și β-amiloidul la adulții în vârstă cu performanțe superioare de memorie. Neurobiol Aging. 2018 Jul;67:162-170. Epub 2018 Mar 27 PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE.APOE2 îmbunătățește neuroprotecția împotriva bolii Alzheimer prin mecanisme moleculare multiple. Mol Psychiatry. 2014 Feb 4; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium.Gene-based association studies report genetic links for clinical subtypes of frontotemporal dementia. Brain. 2017 Apr 5; PubMed.
- Wu L, Zhao L.ApoE2 and Alzheimer’s disease: time to take a closer look. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
Lecturi suplimentare
Nici o lectură suplimentară disponibilă
.